單克隆抗體(mAbs)發現與開發的五種技術
文章來源公眾號:生物屋 作者:屋中人
01 引言
抗體是適應性免疫系統的重要組成部分,由B細胞產生,用于特異性識別和中和多種抗原,如病毒、病原體和惡性細胞。自從Köhler和Milstein在開發雜交瘤技術方面的開創性工作以來,單克隆抗體(mAbs)已成為基礎研究和臨床醫學中不可或缺的工具。迄今為止,已有超過100種治療性抗體被批準用于臨床,為自身免疫性疾病、代謝疾病、傳染病和多種癌癥提供了有效的治療選擇。治療性抗體的開發傳統上依賴于幾種策略,包括動物免疫、組合抗體庫、B細胞克隆和轉基因小鼠的使用,這些方法使得能夠發現具有理想治療特性的高親和力抗體。最近,計算生物學和人工智能(AI)的進展為抗體發現引入了強大的新方法。這些工具,如用于結構預測的AlphaFold3、分子對接和從頭設計,正越來越多地與生成擴散模型相結合,以創造出具有更高特異性、親和力和功效的抗體。在本綜述中,我們總結了五種主要的抗體生成方法,這些方法(圖1)正在擴展治療性抗體發現的領域,提供了加速開發和改善人類疾病治療的創新策略。
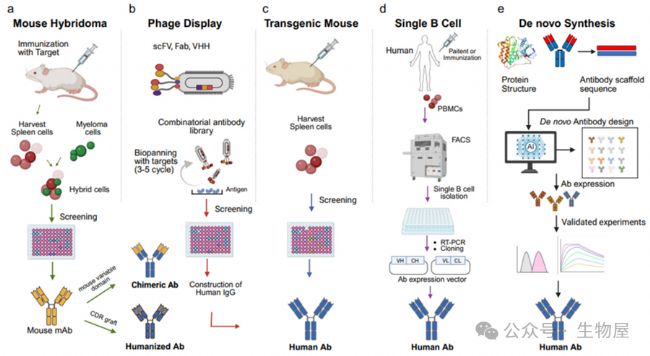
圖1. 治療性抗體開發的五種關鍵方法概述:(a) 小鼠雜交瘤, (b) 噬菌體展示, (c) 轉基因小鼠, (d) 單B細胞分離, 和(e)從頭設計。 每種方法通過不同的免疫、篩選或計算策略實現單克隆抗體的生成。
(a) 小鼠雜交瘤技術: 用靶抗原免疫小鼠,將脾臟B細胞與永生化骨髓瘤細胞融合以產生雜交瘤。篩選雜交瘤克隆以獲取特異性抗體生產,隨后通過互補決定區(CDR)移植進行抗體人源化。
(b) 噬菌體展示: 以單鏈可變片段(scFv)、抗原結合片段(Fab)或單域抗體(VHH)格式生成組合抗體庫。針對固定化抗原進行多輪生物淘選,富集高親和力結合物用于篩選和IgG重建。
(c) 轉基因小鼠平臺: 對表達人類免疫球蛋白基因的基因工程小鼠進行靶抗原免疫。從脾臟中分離產生人抗體的B細胞并進行篩選以獲得全人源抗體。
(d) 單B細胞分離: 從免疫過或患者的人類供體收集外周血單核細胞(PBMCs)。通過熒光激活細胞分選(FACS)分離抗原特異性B細胞,通過逆轉錄聚合酶鏈反應(RT-PCR)擴增抗體基因,并克隆到表達載體中以獲得全人源抗體。
(e) 從頭(De novo)抗體設計: 使用人工智能(AI)和基于結構的建模,從支架結構計算生成抗體序列。預測的抗體被表達并通過實驗驗證其親和力、穩定性和功能。
02 雜交瘤技術
多年來,抗體一直是生物醫學研究中的重要工具,在多個領域具有潛在應用。抗體的高特異性和選擇性結合已將其應用擴展到流式細胞術、磁性細胞分選、免疫分析、治療方法等。1975年,基于雜交瘤的技術被用于生產批次間變異最小的單克隆抗體,實現了持續和無限的生產。雜交瘤技術由Kohler和Milstein于1975年首次發明,作為獲取單克隆抗體的一種方法,涉及將免疫動物(如小鼠)脾臟中產生的B細胞與永生化骨髓瘤細胞融合。雜交瘤技術是最原始、最基礎且最成功的分離單克隆抗體的方法,這項技術引人注目,并已被用于發現數千種用于各種應用的抗體。雜交瘤技術的基本實際優勢在于,一旦雜交瘤克隆建立,單克隆抗體的生產就變得簡單而高效。該技術仍然廣泛用于抗體治療和診斷試劑的開發,其核心價值在于保留了來自B細胞自然重組過程的抗體序列完整性和生物活性。第一種治療性單抗,莫羅單抗-CD3(Orthoclone OKT3),于1986年獲得美國FDA批準,它包含一種針對T細胞表達的CD3的小鼠單抗,作為免疫抑制劑用于治療急性移植排斥反應。為了規避免疫原性潛力和功效降低的問題,同時使抗體能夠長期治療使用,研究人員開發了技術將嚙齒類動物抗體轉化為更類似于人抗體的結構,而不損失結合特性。隨后,第一種具有腫瘤適應癥的單抗,利妥昔單抗,一種嵌合抗CD20 IgG1,于1997年獲得美國FDA批準用于治療非霍奇金淋巴瘤。最近的創新,例如通過熒光激活細胞分選(FACS)富集的抗體分泌細胞(ASCs)的電融合,顯著提高了融合效率和功能性雜交瘤產量。通過選擇具有高跨膜激活劑和CAML相互作用因子(TACI)和CD138表達的ASC亞群,研究人員實現了超過60%的抗原特異性單抗生產,且具有納摩爾級親和力。這些改進克服了先前隨機配對和低PEG介導融合的限制,將雜交瘤定位為一個復興的、高產量的治療和診斷抗體開發平臺。
除了小鼠雜交瘤,兔單克隆抗體也可以從雜交瘤技術中產生,兔抗體顯示出優異的親和力、更廣泛的表位識別(包括隱蔽或構象表位)以及更高的治療和診斷靈敏度。兔單克隆抗體在幾個關鍵免疫學維度上超越了其鼠源對應物:
·卓越的親和力——增強的結合動力學能夠實現更精確的抗原檢測和靶向。
·擴展的表位識別——能夠識別結構復雜或在小鼠中免疫原性差的表位。
·對翻譯后修飾的敏感性——非常適合檢測疾病狀態下細微的生化變化。
兔單克隆抗體(RabMAbs)提供高特異性和親和力,通常能夠識別鼠源抗體無法接近的表位,使其對于抗體-藥物偶聯物(ADCs)和檢查點抑制劑具有價值。FDA批準了brolucizumab,一種針對VEGF-A的兔源ScFv,標志著首個治療性RabMAb的誕生。Brolucizumab是一種單鏈可變片段(ScFv)單抗,能有效抑制VEGF。由于其小尺寸,與其他治療性單抗形式相比,ScFv可以以更高濃度遞送,并且可以更有效地穿透組織以發揮其治療作用。然而,使brolucizumab與其他單抗區別開的一個關鍵點是,它是一種源自兔的人源化ScFv,使得這種單抗成為市場上的首創。相比之下,大多數其他治療性單抗源自小鼠。其他例子包括Zilovertamab vedotin,一種針對受體酪氨酸激酶樣孤兒受體1(ROR1)的ADC,以及OR502,靶向白細胞免疫球蛋白樣受體B2(LILRB2)以增強抗腫瘤免疫力。
03 噬菌體展示技術
噬菌體展示是首個用于體外抗體篩選的技術,并且仍然是使用最廣泛的方法。該技術由George P. Smith于1985年首次描述,他證明了絲狀噬菌體可以通過將DNA插入外殼蛋白基因而在其表面呈現外源肽,該技術已得到廣泛發展。主要進展來自分子生物學實驗室(英國劍橋)的Winter和McCafferty,斯克里普斯研究所(美國拉霍亞)的Lerner和Barbas,以及德國癌癥研究中心(德國海德堡)的Breitling和Dubel,他們開創了在絲狀噬菌體中構建組合抗體庫的工作。這些里程碑牢固確立了噬菌體展示作為治療性抗體工程的強大平臺,導致了全人源抗體的開發。組合抗體庫是通過使用PCR從B細胞、免疫供體或患者擴增VH和VL區域,然后克隆到與噬菌體外殼蛋白(如pIII)融合的噬菌粒載體中來構建的。這創建了直接的基因型-表型聯系,使得抗體片段能夠在噬菌體表面展示。庫可以超過 10^11 個變體,提供廣泛的多樣性。針對固定化抗原進行結合、洗滌和洗脫的迭代輪次富集了抗原特異性噬菌體,之后通過ELISA篩選結合物,進行測序,并重新格式化為scFv、Fab或IgG分子進行測試。重要的是,噬菌體展示繞過了免疫耐受,允許產生針對自身抗原(如TNF-α)的抗體。阿達木單抗(Humira)的批準,第一種噬菌體展示來源的全人單克隆抗體,說明了其臨床意義。有許多噬菌體展示來源的人源抗體獲得美國FDA批準用于治療人類疾病,證明了該技術作為抗體發現平臺的可靠性。
除了常規的結合物選擇,噬菌體展示已經發展到能夠實現直接的功能性抗體發現,如圖2所示。功能性抗體的鑒定已成為研究的中心焦點,體內和表型篩選方法進一步拓寬了噬菌體展示的應用。在整個生物體中進行基于遷移的選擇揭示了能夠調節受體多效性和細胞分化的抗體,這些策略使得能夠鑒定出驅動干細胞分化為巨噬細胞、小膠質細胞、棕色脂肪細胞或β樣細胞命運的抗體。基于形態學的篩選甚至產生了能夠防止病毒誘導細胞死亡的抗體。在腫瘤學中,功能性噬菌體展示已鑒定出激活非經典通路的激動劑抗體和一種針對PKM2的抗凋亡胞內抗體,揭示了腫瘤存活的機制。這些進展說明了噬菌體展示如何演變成一個多功能發現引擎,用于尋找超越單純結合功能的治療性抗體。此外,從雜交瘤或噬菌體展示獲得的抗體通常經過進一步工程化以改善結合。通過在VH/VL區域引入突變并重新選擇改進的克隆,噬菌體展示模擬了在V(D)J重組后發生在生發中心的自然親和力成熟過程。這個過程富集了具有更高抗原親和力的變體,有時達到低皮摩爾級的結合強度,并且對于優化抗體用于治療用途至關重要。
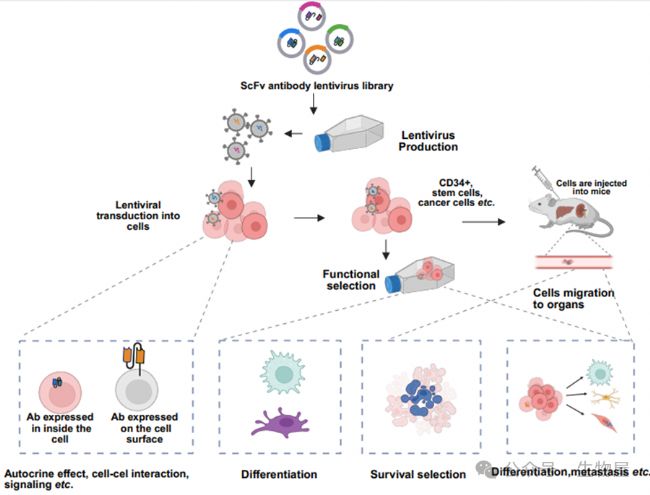
圖2. 調節細胞命運的功能性抗體發現示意圖。
通過慢病毒遞送抗體庫使得抗體能夠在細胞內和表面表達。在細胞和體內進行功能性選擇,鑒定出能夠調節信號傳導、分化和細胞命運的抗體。功能性抗體可以誘導細胞命運的改變,能夠被分泌、在細胞質中表達、錨定在質膜上。通過使用抗體庫,可以在細胞環境中分離功能性抗體,并修飾細胞表面信號組件的功能。這些抗體還可以以自分泌或旁分泌方式影響細胞存活、增殖和譜系分化,為發現調節細胞穩態和命運決定的抗體提供了一個強大的平臺。
04 轉基因小鼠技術
源自野生型小鼠的抗體通常需要廣泛的下游工程化以消除免疫原性鼠源序列并確保與人類Fc受體的正確相互作用。雖然野生型小鼠廣泛可用且使用簡單,但它們對于治療性抗體發現并非最佳選擇。為了應對免疫原性的挑戰,設計了轉基因小鼠模型以產生全人源抗體。然而,這些模型的早期世代缺乏鼠源恒定區,導致B細胞發育缺陷和小鼠體內抗體成熟受損。轉基因小鼠技術的原理是通過基因工程將人類免疫球蛋白(Ig)基因引入小鼠基因組,使小鼠能夠產生全人源抗體。這通常通過胚胎干細胞(ES細胞)中的同源重組或通過將重組人抗體基因片段顯微注射到受精卵中,然后進行胚胎移植和育種以建立穩定的轉基因品系來實現。整合的人Ig基因與小鼠免疫系統協同作用,確保正常的B細胞發育、體細胞高頻突變和親和力成熟。與野生型小鼠相比,這些轉基因小鼠產生具有更高臨床相關性、更低免疫原性并保留免疫監視功能的人源抗體。
·第一個里程碑報道于1989年,Brüggemann等構建了一個包含兩個VH片段、多樣性(D)元件、JH簇和μ恒定區的人重鏈基因盒。這個25 kb的構建體通過顯微注射到受精卵中隨機整合到小鼠基因組中,大約4%的B細胞表達人μ鏈,并且可以從這些小鼠中產生產生人IgM的雜交瘤。
·Taylor等引入了一個包含單個Vκ、Jκ簇和Cκ的人κ輕鏈構建體,共表達人VH-D-JH-Cμ-Cγ1和κ構建體的小鼠能夠產生人源抗體,但水平低于總Ig的10%,反映了與內源性鼠源Ig表達的有限兼容性。同時,開發了基因敲除小鼠模型以消除內源性鼠源Ig的產生。
·1993年,Chen等通過靶向缺失破壞了鼠源JH和Jκ基因座,廢除了天然Ig的表達。當與人類IgH和IgL轉基因品系雜交時,這些敲除小鼠顯示出更廣泛的人源抗體庫。
·一個重大進展出現在1994年,Lonberg等產生了HuMabMouse,這是第一個在鼠源Ig缺陷背景下攜帶人IgH和Igκ基因的小鼠品系。盡管完整的人IgH和Igκ基因座跨越1.29 Mb和1.39 Mb,但引入的構建體小于80 kb,這限制了抗體的多樣性。
·隨后,應用了酵母人工染色體(YAC)技術。1993年,研究人員使用YAC成功組裝了人Igκ(~300 kb)和IgH(~85 kb)的大基因組片段。隨后,Green等通過酵母原生質體-ES融合將基于YAC的人Igκ(~170 kb)和IgH(~220 kb)引入小鼠ES細胞。在此基礎上,Mendez等生成了更大的YAC構建體,包括人Igκ(~700 kb)和IgH(~1 Mb),并將它們引入Ig缺陷小鼠,創建了XenoMouse。
這些小鼠僅表達全人源抗體,不受鼠源Ig干擾。總之,轉基因動物的開發提供了突破性的平臺,使得能夠高效生成全人源治療性抗體。除了XenoMouse,已經開發了越來越多先進的轉基因小鼠平臺,例如Atlas™ Mouse、HuMab Mouse和VelocImmune® Mouse。這些模型采用精確的基因敲入策略,用近乎全面的人源序列替換鼠源重鏈和輕鏈可變區,從而在保留自然結構特征的同時增強抗體多樣性。更新一代的模型還融入了創新,如固定輕鏈或二元輕鏈策略,這簡化了雙特異性抗體的高效生成,并改善了可開發性和藥代動力學特性。總的來說,這些創新擴展了治療性抗體的功能多樣性,并為藥物開發流程提供了更大的靈活性。盡管該技術仍然成本高昂且技術要求高,但此類轉基因小鼠模型正迅速成為行業標準,在解決復雜疾病和滿足高臨床需求方面展現出巨大價值。
05 單B細胞技術
在人類免疫系統中,抗體反應是強大的、高度特異性的,并且通常具有強效的中和作用。生成治療性單克隆抗體的傳統策略,如鼠源雜交瘤技術或使用轉基因小鼠,需要冗長的免疫方案和廣泛的篩選。此外,鼠源抗體在人類中具有顯著的免疫原性風險,常常導致人抗鼠抗體(HAMA)反應的發展。為了克服這些限制,一個早期的替代方案是使用愛潑斯坦-巴爾病毒(EBV)轉化永生化人B細胞。雖然這種方法在某些條件下能夠生產人源抗體,但它存在關鍵缺陷,包括在某些供體中效率低下以及EBV轉化克隆的不穩定性。一個變革性的進展是單B細胞技術,它允許直接回收人源抗體而無需動物免疫。使用逆轉錄聚合酶鏈反應(RT-PCR),可以從單個B細胞中擴增可變重鏈(VH)和輕鏈(VL)并進行重組表達。B細胞通常從外周血單核細胞(PBMCs)、骨髓或淋巴組織中分離,通常在密度梯度離心后進行,抗原特異性B細胞使用FACS基于階段特異性標志物進行鑒定和分選。早期的方法使用抗原包被的珠子來富集稀有B細胞,從而產生了第一批針對病毒病原體的人單克隆抗體。如今,多參數流式細胞術和高通量單細胞克隆能夠快速鑒定和表達配對的VH/VL基因。這些方法通過提供一種高效、無動物的策略徹底改變了抗體發現,特別適用于緊急公共衛生危機,如新發病毒爆發,例如大流行性流感。這種策略的應用已得到廣泛證實,例如,通過使用HIV包膜蛋白作為誘餌,從感染或接種疫苗的個體中分離出了針對HIV-1的廣泛中和抗體(bnAbs)。這些抗體通常靶向病毒膜糖蛋白上的保守表位,從而實現強效和交叉反應性中和。最近,單B細胞方法使得能夠快速鑒定針對SARS-CoV-2的強效中和抗體,在COVID-19大流行開始后不久,就分離并表征了靶向刺突蛋白的抗體組合,為治療和疫苗設計提供了關鍵見解。總的來說,與傳統的雜交瘤方法相比,單B細胞抗體發現平臺代表了一項變革性的進步,能夠更快、更直接、更臨床相關地回收全人源單克隆抗體。
06 從頭抗體設計
傳統的抗體發現和優化技術,如雜交瘤技術、噬菌體展示、轉基因小鼠、B細胞克隆等,被廣泛用于治療性抗體篩選。然而,其中一些方法勞動密集、耗時且成本高昂,通常需要六個多月才能產生可行的抗體。隨后,通過同源建模、分子對接和基于結構的設計策略,進行優化步驟以增強結合親和力、生物物理穩定性和可開發性。蛋白質數據獲取、GPU計算機和機器學習(ML)的最新進展預計將徹底改變抗體發現和優化篩選的過程,大量蛋白質結構、相互作用和功能數據的可用性為訓練復雜的機器學習模型提供了大型數據集,而增強的計算能力使得能夠高效執行復雜的模型和模擬。機器學習模型已廣泛用于蛋白質研究,涵蓋神經網絡、轉換器和蛋白質語言建模等技術。從頭抗體設計是指在不依賴天然模板的情況下生成新的抗體序列。最近的研究使用這種方法,通過模擬抗原-抗體相互作用界面,基于準確的分子間相互作用建模,計算預測具有高結合親和力的序列。AlphaFold3和 RoseTTAFold模型在直接從氨基酸序列預測蛋白質結構方面達到了高精度,生成模型如 ProteinBERT、ProteinMPNN和 RFdiffusion通過預測蛋白質骨架、為特定結構設計序列以及過濾低質量蛋白質候選物,推進了計算蛋白質設計。研究人員可以使用這些模型來設計和優化具有所需特性的蛋白質,例如酶活性和結合能力。專門模型專注于抗體設計,特別是靶向互補決定區(CDRs)。IgFold可以使用預訓練的語言模型和圖神經網絡快速預測抗體結構,而像DiffAb這樣的模型可以用于聯合生成靶向CDR優化的抗體序列和結構。
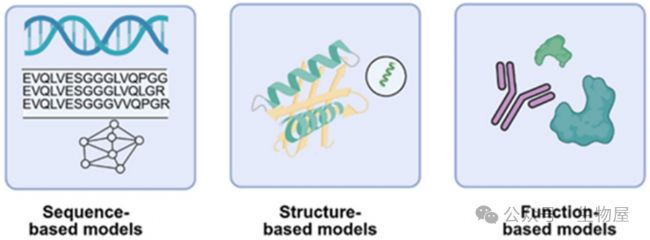
圖3: 用于抗體設計的機器學習模式示意圖。
基于序列的模型利用氨基酸序列學習表示并生成新的變體,實現從頭設計。基于結構的模型結合結構約束來指導序列生成和優化。基于功能的模型利用實驗、已發表數據或預測的功能蛋白質(如催化活性或結合)進行監督學習。
用于功能性蛋白質設計的機器學習涵蓋三個核心模式:基于序列的模型、基于結構的模型和基于功能的模型(圖3),每種模式利用不同的數據類型來優化蛋白質特性。
·基于序列的模型包括經典的基于比對的方法,使用多序列比對來捕捉進化約束,以及條件生成模型,如變分自編碼器和轉換器,它們基于家族特異性或序列同源性上下文生成新序列。一個生成對抗網絡(GAN)被設計出來,并在超過400,000個人類抗體輕鏈和重鏈序列上進行了訓練,有效地學習了抗體形成的基本原理。
·基于結構的模型包括結構預測工具,如AlphaFold3和RoseTTAFold,用于創建3D折疊的RF-diffusion模型,以及在結構框架內優化序列的設計模型。David Baker的團隊最近開發了RFdiffusion,一個用于從頭設計靶向流感血凝素和艱難梭菌毒素B(TcdB)的VHHs和scFvs的生成模型,它在結構和表位靶向方面都達到了原子級精度。這些整合序列和結構數據的方法越來越多地用于迭代優化抗體設計,結合兩種模式的優勢以增強功能結果。
·基于功能的模型側重于設計具有特定生物活性的抗體,通常從已知支架開始,并引入靶向突變以增強結合、特異性。這些方法經常參考受體口袋、天然配體或激動劑、拮抗劑相互作用來指導功能性抗體的設計,這些模型使得能夠合理設計激動劑、拮抗劑和治療性蛋白質。
總之,這些模式提供了加速蛋白質工程的互補策略,在抗體設計、優化和合成生物學中的應用日益增長。總的來說,最近的策略匯聚在生成式AI框架內,可以大致分為三類:語言模型、擴散模型和混合模型(圖4)。
·語言模型(例如,Absci, AbGPT, AntiBARTy)在大型抗體序列庫上進行訓練,以生成新序列,特別是在高度多樣化的區域,如CDRH3。
·擴散模型細分為基于結構的(例如,RFdiffusion, DiffDock-A),它們使用來自PDB或SAbDab的實驗解析的抗體-抗原復合物來設計新的3D骨架,然后通過Protein MPNN進行序列優化;以及基于序列的(例如,Abdiffuser),它們利用抗體序列數據集與預測結構來生成新序列。
·混合模型(例如,Refine GNN)整合了配對的序列和結構數據,使得能夠同時優化序列和結構。總之,這些生成框架提供了互補的策略,擴展了抗體發現的領域,并加速了功能性治療候選物的設計。
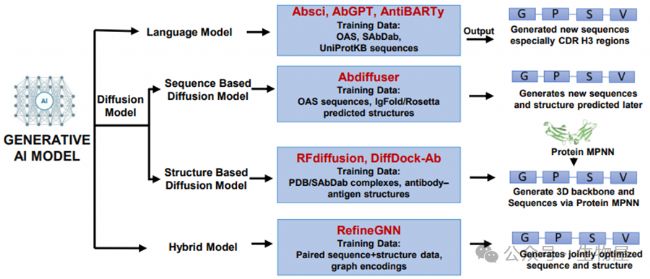
圖4. 使用生成式AI模型生成抗體的示意圖。
生成式AI方法包括語言模型(基于序列的設計)、擴散模型(基于序列或結構引導的生成)和混合模型(整合序列和結構進行同步優化)。一個集成框架將抗體發現從已發表的經驗篩選轉變為數據驅動的設計。
現在,AI輔助的抗體設計已經在多種靶點上展示了顯著的通用性,包括病毒蛋白、膜受體致癌蛋白。隨著計算建模和高通量實驗的融合,從頭抗體生成有望成為一個由機器學習和結構生物信息學驅動的自動化、迭代過程。這種整合有望更快、更精確地開發治療性抗體,加速在癌癥、傳染病和免疫治療方面的突破,AI輔助的抗體設計代表了一種正在重塑抗體發現的新趨勢。
07 總結與展望
本綜述重點介紹了抗體發現的多種策略,包括雜交瘤技術、噬菌體展示庫、轉基因小鼠、單B細胞分離和從頭合成方法。盡管取得了這些進展,但每種抗體發現方法仍然存在獨特的挑戰和權衡。雜交瘤方法受限于物種特異性免疫反應,如免疫耐受,而噬菌體展示可能引入庫偏差并丟失天然抗體配對。轉基因小鼠平臺成本高昂,單B細胞技術面臨通量和數據解釋的限制。此外,當前AI驅動和從頭計算設計方法仍然難以準確預測抗體折疊、動力學和功能功效,強調了在下一代抗體開發中需要整合、多平臺策略。此外,除了這五種抗體生成策略,生產后工程如Fc修飾、半衰期延長和糖工程也持續增強抗體的功效、穩定性和治療指數。這些創新補充了發現平臺,將抗體生成與臨床優化連接起來,用于下一代生物制劑。綜上所述,總結了五種主要的抗體生成方法,這些方法正在擴展治療性抗體發現的邊界,提供了加速開發過程并增強人類疾病治療功效的創新策略。總的來說,這些平臺不僅能夠快速生成傳統的中和抗體,還能生成調節信號通路和驅動細胞分化的功能性激動劑。新興的方法,如基于自分泌和基于遷移的選擇、體內功能性篩選和形態學引導的分析,進一步擴展了抗體發現的潛力,特別是在癌癥和免疫學領域。這些進展提供了強大的手段來靶向病毒、腫瘤和免疫受體,同時也為受體多效性和細胞命運調控提供了新的見解。從頭設計,越來越多地與AI驅動的建模和高通量篩選相結合,代表了一種正在重塑抗體發現的新趨勢。展望未來,這些方法與下一代計算工具的融合將加速跨傳染病、腫瘤學及其他領域的創新治療性抗體的開發。






