apricot DC1自動化液體處理工作站在qPCR 實驗體系構建中的應用
引言
qPCR是一種融合了PCR擴增與熒光檢測技術的高靈敏度方法,能夠對樣品中的DNA或cDNA進行精確定量。該技術已廣泛應用于基因表達分析、微生物與病原體檢測,以及NGS建庫中的文庫定量等多個科研與診斷領域。
qPCR技術擁有極寬的動態(tài)檢測范圍,其定量依賴于通過系列稀釋陽性對照建立Ct值與對數(shù)濃度的標準曲線。然而,逐級稀釋對移液誤差極為敏感:即便每步誤差僅2%–3%,累積后也可能導致最低濃度點的顯著偏離,甚至使標準曲線失效。因此,高質量的qPCR質控必須采用高精密度和準確度的移液設備或自動化工作站。
本文展示了來自英國SPT Labtech 公司的多功能液體工作站apricot DC1的液體處理性能,并驗證其在qPCR實驗體系構建中的適用性。該工作站的核心優(yōu)勢在于實現(xiàn)了全自動的qPCR實驗流程:從精準分裝qPCR試劑盒中的單個試劑,到自動完成標準曲線的制作、樣品梯度稀釋和PCR反應體系配置的整個流程。
材料與方法
液體處理
本文展示的主要液體處理步驟均在SPT Labtech公司的apricot DC1自動化液體處理工作站上完成。該工作站是一款緊湊型臺式設備,其核心配置與特點如下:
-
多功能移液系統(tǒng):配備獨特的4合1移液頭與雙分配核心,支持1/8/12通道,并可自動更換槍頭,量程范圍: 0.5–1000 µL。
-
靈活的工作臺面:提供縱向與橫向兩種布局選擇,可分別容納最多9個和7個臺面器件,便于集成多種實驗模塊。
-
高耗材兼容性:廣泛兼容SBS標準規(guī)格的24、96、384孔板(包括深孔板與PCR板),以及1.5/2.0/5.0 mL微量離心管、PCR管與試劑槽等實驗室常用耗材。
- 模塊化擴展功能:支持選配溫控模塊、振蕩器與磁力架等多種功能模塊,以滿足復雜的實驗需求。

qPCR實驗體系配置
本次qPCR實驗采用 TaqMan™ 基因表達預混試劑(Applied Biosystems, Cat. 4369016),以濃度為 108 ng/mL 的陽性病毒對照作為起始樣本,在 apricot DC1 自動化液體處理工作站上,于 96 孔 U 底板中完成陽性對照的連續(xù)梯度稀釋。每個稀釋度設 3 個復孔。具體操作流程如下:
-
使用 8 通道 125 μL 量程吸頭,向梯度稀釋中間板的第 2–8 列每孔加入 90 μL 稀釋緩沖液;
-
向同一板的第 1 列加入 20 μL 陽性對照;
-
使用 8 通道,從第 1 列吸取 10 μL 陽性對照轉移至第 2 列,與 90 μL 稀釋緩沖液混合,完成第一次 1:10 稀釋;
-
依次對第 3–8 列繼續(xù)進行 10 倍梯度稀釋,每次混勻體積為 70 μL,混勻次數(shù)為 10 次,確保均勻混合。
隨后,使用 SPT Labtech 的 dragonfly discovery 分液器,向 qPCR 檢測板(Applied Biosystems, Cat. 4306737)的第 1–8 列每孔加入 9 μL qPCR 預混試劑。將該板置于 apricot DC1 工作臺面上,由 DC1 自動從梯度稀釋板中吸取 1 μL 樣品,轉移至 qPCR 檢測板對應孔中。
具體實驗流程與臺面布局見下圖figure 1

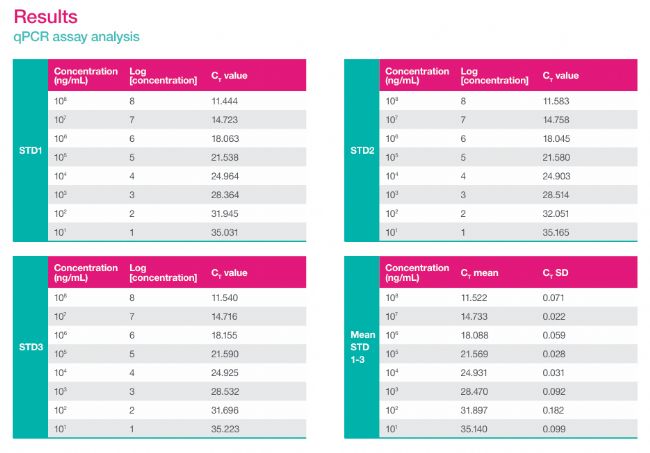
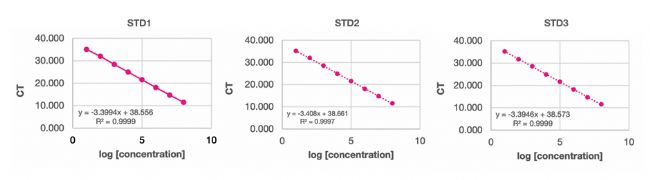
qPCR檢測板使用封板膜(Applied Biosystems, 4311971)密封后,置于QuantStudio 6 Flex qPCR儀(Applied Biosystems, 4485697)上進行檢測。所用程序如下:95°C 10分鐘;隨后進行40個循環(huán)的95°C 15秒退火/延伸。檢測完成后,將獲得的Ct值相對于陽性對照濃度的對數(shù)值繪制散點圖,并擬合線性回歸模型,以確定該標準曲線的斜率與R²值。
結論
實驗結果表明,配備獨特4合1移液頭的apricot DC1是實現(xiàn)準確梯度稀釋的理想平臺。該設備支持自動更換吸頭,有效避免了樣品在連續(xù)稀釋過程中的殘留風險。此外,apricot DC1具備多達9個擴展臺面,并可在1、8或12通道模式間靈活切換,既能處理單一樣品分裝,也能高效完成多列連續(xù)梯度稀釋及后續(xù)qPCR反應體系的構建。綜上所述,apricot DC1為建立自動化qPCR工作流程提供了一個功能靈活、操作簡便且經(jīng)濟高效的整體解決方案。
DC1視頻全解析
https://v.douyin.com/TywL1yu83wg






