阿爾茲海默癥研究備受關(guān)注的10個(gè)熱門(mén)靶點(diǎn)及其抑制劑/激動(dòng)劑的機(jī)制
阿爾茨海默癥(AD)的病理機(jī)制涉及β-淀粉樣蛋白(Aβ)沉積、Tau蛋白過(guò)度磷酸化、神經(jīng)信號(hào)通路異常、神經(jīng)炎癥反應(yīng)失調(diào)等多重因素。近年來(lái),針對(duì)上述AD不同生理過(guò)程的抑制劑研究取得顯著突破,在大鼠、小鼠、恒河猴等多種動(dòng)物AD模型中有著廣泛的研究應(yīng)用。AbMole為全球科研客戶提供高純度、高生物活性的抑制劑、細(xì)胞因子、人源單抗、天然產(chǎn)物、熒光染料、多肽、靶點(diǎn)蛋白、化合物庫(kù)、抗生素等科研試劑,全球大量文獻(xiàn)專(zhuān)利引用。
一、神經(jīng)遞質(zhì)與信號(hào)通路調(diào)節(jié)劑
1. 乙酰膽堿酯酶(AChE)抑制劑
AD的早期特征之一是基底前腦(BFB)區(qū)域中的膽堿能神經(jīng)元丟失,導(dǎo)致乙酰膽堿的釋放減少,進(jìn)而影響大腦多個(gè)區(qū)域中神經(jīng)元的功能活性,并最終導(dǎo)致學(xué)習(xí)和記憶功能障礙。在動(dòng)物AD模型中,通過(guò)注射乙酰膽堿酯酶(AChE)抑制劑可增加大腦中乙酰膽堿的水平,從而改改善上述狀況。在科研領(lǐng)域中,備受關(guān)注的AChE抑制劑有Donepezil(E2020,AbMole,M3601)、Rivastigmine(ENA 713,AbMole,M10928)、Galantamine(AbMole,M14548)、Tacrine(AbMole,M54846)等,它們可有效抑制AChE家族的活性。上述抑制劑除了能提高AD模型中的乙酰膽堿酶水平,還能抑制Aβ蛋白的產(chǎn)生,其機(jī)制如下:AChE抑制劑可通過(guò)升高乙酰膽堿的水平促進(jìn)淀粉樣前體蛋白(APP)通過(guò)非淀粉樣蛋白途徑代謝,減少Aβ肽的產(chǎn)生[1];部分乙酰膽堿酯酶抑制劑如Donepezil(E2020)、Rivastigmine(ENA 713)等可通過(guò)增加乙酰膽堿水平間接抑制γ-分泌酶的活性。γ-分泌酶負(fù)責(zé)切割A(yù)PP產(chǎn)生Aβ肽,其活性的抑制可以減少Aβ蛋白的生成[2]。

2. N-甲基-D-天冬氨酸(NMDA)受體抑制劑
NMDA受體(N-甲基-D-天冬氨酸受體)是中樞神經(jīng)系統(tǒng)中的一種離子型谷氨酸受體,廣泛表達(dá)于大腦的各個(gè)區(qū)域。NMDA受體的過(guò)度激活將導(dǎo)致鈣離子內(nèi)流增加,破壞細(xì)胞內(nèi)鈣穩(wěn)態(tài),進(jìn)而引發(fā)一系列細(xì)胞內(nèi)信號(hào)通路的紊亂,最終導(dǎo)致神經(jīng)元死亡和AD樣變化。NMDA受體拮抗劑如Memantine(AbMole,M3326)可通過(guò)抑制NMDA受體保護(hù)神經(jīng)元,在多種動(dòng)物模型(大鼠、小鼠)中表現(xiàn)出良好的AD抑制效果。例如Memantine可保護(hù)由Aβ1-40 誘導(dǎo)的大鼠神經(jīng)元細(xì)胞損傷[4]。
3. 毒蕈堿受體(mAChR)激活劑
毒蕈堿受體(mAChR)在哺乳動(dòng)物的認(rèn)知功能中扮演著重要的角色,分為M1至M5五個(gè)亞型,廣泛分布于大腦皮層、海馬和基底神經(jīng)節(jié)等區(qū)域,與認(rèn)知功能密切相關(guān)。Blarcamesine(AbMole,M6203)和ML380(AbMole,M28716)是mAChR的激動(dòng)劑,可通過(guò)調(diào)節(jié)細(xì)胞內(nèi)鈣穩(wěn)態(tài),減少Aβ蛋白對(duì)神經(jīng)元的毒性作用,這種調(diào)節(jié)作用有助于維持神經(jīng)元的正常功能,減少神經(jīng)退行性變化。
4. 煙堿型乙酰膽堿受體(nAChRs)激動(dòng)劑
煙堿型乙酰膽堿受體(nAChRs)激動(dòng)劑也是AD動(dòng)物模型研究中常用的一類(lèi)工具化合物。ABT-089(Pozanicline,AbMole,M8553)是煙堿 α4β2和α6β2受體的激動(dòng)劑,可顯著改善實(shí)驗(yàn)動(dòng)物的認(rèn)知功能[5]。Varenicline(CP 526555,AbMole,M6268)、Isopronicline(TC-1734,ACD3480AbMole,M29693)作為α4β2或α7 nAChR的激動(dòng)劑可以在多種動(dòng)物體內(nèi)調(diào)節(jié)神經(jīng)遞質(zhì)釋放、減少氧化應(yīng)激和炎癥反應(yīng),提供神經(jīng)保護(hù)以及增強(qiáng)突觸可塑性,促進(jìn)學(xué)習(xí)和記憶[5]。
二、作用于淀粉樣蛋白(Aβ)的抑制劑
淀粉樣蛋白的異常聚集是AD的核心標(biāo)志之一。Aβ蛋白的異常產(chǎn)生和清除失衡導(dǎo)致其在腦內(nèi)聚集,形成寡聚體和原纖維并破壞突觸的結(jié)構(gòu)與功能。Aβ蛋白的形成是一個(gè)多步驟的蛋白水解過(guò)程,核心涉及淀粉樣前體蛋白(APP)的切割。APP是一種表達(dá)于神經(jīng)元表面的跨膜蛋白,在正常生理?xiàng)l件下,APP 更易被α-分泌酶切割。但當(dāng)APP被 β-分泌酶(如BACE1)首先切割時(shí),則會(huì)產(chǎn)生 C 端片段(C99),C99則進(jìn)一步被γ-分泌酶切割后將產(chǎn)生不同長(zhǎng)度的 Aβ肽段,包括Aβ1-40(約占 90%)和 Aβ1-42(約占 10%)。Aβ1-42 (Amyloid β-Peptide 1-42)因疏水性更強(qiáng),更易發(fā)生錯(cuò)誤折疊并形成聚集物,也是動(dòng)物AD模型最常用的造模劑之一[6]。
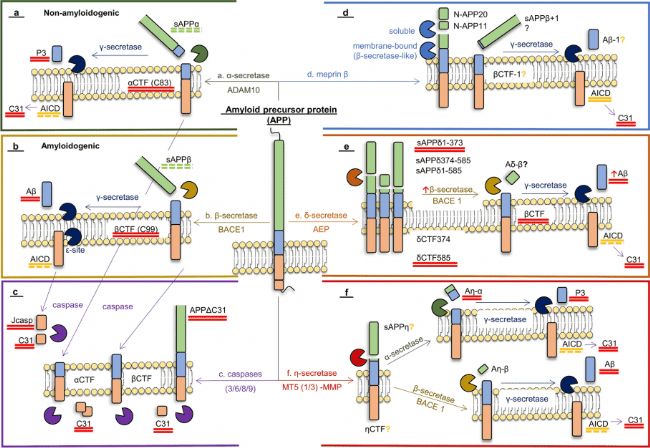
1. Aβ蛋白合成抑制劑
β分泌酶抑制劑
β-分泌酶(也稱(chēng)為β位點(diǎn)APP裂解酶; BACE1),是切割A(yù)PP并產(chǎn)生Aβ蛋白的起始和核心步驟。β-分泌酶在AD研究領(lǐng)域中一直是熱門(mén)靶點(diǎn),Verubecestat (MK-8931,AbMole,M9386) 可通過(guò)高親和力結(jié)合BACE1的疏水位點(diǎn),抑制其活性,Verubecestat在小鼠和靈長(zhǎng)類(lèi)動(dòng)物模型中顯著降低了腦脊液和大腦中的Aβ蛋白水平[7]。此外, AZD3293 (Lanabecestat,AbMole,M5227) 、Atabecestat (JNJ-54861911,AbMole,M10943) 、Elenbecestat (E2609,AbMole,M10942) 、Umibecestat(CNP520,AbMole,M28304)、LY2886721(AbMole,M1987)等也是動(dòng)物實(shí)驗(yàn)中常用的β-分泌酶(BACE1)抑制劑。
γ分泌酶抑制劑和調(diào)節(jié)劑
γ-分泌酶是負(fù)責(zé)Aβ生成最后一步的酶,也是AD研究的另一個(gè)重要靶點(diǎn)。Semagacestat(LY450139,AbMole,M2277)是一種經(jīng)典的γ-分泌酶抑制劑(GSIs),通過(guò)抑制γ-分泌酶的活性,減少Aβ蛋白的產(chǎn)生。Avagacestat(BMS-708163,AbMole,M1947)則是一種選擇性的γ-分泌酶抑制劑,能夠在降低Aβ蛋白水平的同時(shí)減少對(duì)Notch信號(hào)通路的影響。Nirogacestat(PF-3084014,AbMole,M9041)是一種可以通過(guò)灌胃形式或混在動(dòng)物飲用水中給予實(shí)驗(yàn)動(dòng)物的γ-分泌酶抑制劑,適合長(zhǎng)期研究使用。Begacestat(GSI-953,AbMole,M3619)也是一種對(duì)Notch-1通路具有低抑制活性的γ-分泌酶抑制劑,能夠優(yōu)先抑制APP的切割,保留Notch1的信號(hào)。除了上述幾款抑制劑,LY-411575(LSN-411575,AbMole,M2130)、MK-0752(AbMole,M2120)等抑制劑也可用于動(dòng)物AD模型的研究,抑制Aβ的產(chǎn)生。2014年,AbMole的兩款抑制劑分別被西班牙國(guó)家心血管研究中心和美國(guó)哥倫比亞大學(xué)用于動(dòng)物體內(nèi)實(shí)驗(yàn),相關(guān)科研成果發(fā)表于頂刊 Nature 和 Nature Medicine。
α-分泌酶激活劑
α分泌酶活性的上調(diào)可以促進(jìn)APP 以非淀粉樣蛋白的形式切割,以此減少 Aβ蛋白的形成并增加可溶性結(jié)構(gòu)域(sAPPα)的產(chǎn)生。Etazolate(AbMole,M56752)是磷酸二酯酶 (PDE4) 抑制劑和GABAα受體調(diào)節(jié)劑,有文獻(xiàn)證實(shí)Etazolate可激活神經(jīng)元α分泌酶,在具體實(shí)驗(yàn)中Etazolate可以通過(guò)口服形式給與動(dòng)物,便于開(kāi)展實(shí)驗(yàn)研究[7]。Bryostatin-1(苔蘚抑素1,AbMole,M7647)、Epigallocatechin Gallate(EGCG,表沒(méi)食子兒茶素沒(méi)食子酸酯,AbMole,M4208)等調(diào)節(jié)劑可通過(guò)激活蛋白激酶C(PKC)提高α-分泌酶的活性,促進(jìn)APP的非淀粉樣蛋白途徑代謝[8]。Gemfibrozil(AbMole,CI-719,M7822)則可通過(guò)刺激ADAM10(α-分泌酶家族重要亞型)的啟動(dòng)子活性,增加ADAM10的表達(dá),從而減少Aβ蛋白的產(chǎn)生。雌二醇(Estradiol,β-Estradiol,AbMole,M5625)是一種激素,最近的文獻(xiàn)發(fā)現(xiàn)雌二醇可通過(guò)激活A(yù)kt和mTOR信號(hào)通路,增加α-分泌酶的活性,促進(jìn)APP的非淀粉樣蛋白途徑代謝[9]。
2. Aβ蛋白聚集抑制劑
Aβ蛋白產(chǎn)生神經(jīng)毒性的主要機(jī)制之一是聚集體的形成。在動(dòng)物實(shí)驗(yàn)中,Aβ蛋白聚集抑制劑通過(guò)阻止Aβ蛋白的聚集,可減少后者對(duì)神經(jīng)元的毒性。銅和鋅離子等金屬離子在Aβ蛋白的聚集過(guò)程中起關(guān)鍵作用,Clioquinol(PBT1,AbMole,M5528)是一種羥基喹啉離子載體,可通過(guò)螯合上述金屬離子減少Aβ蛋白的聚集[10]。Scyllo-inositol(Scyllitol,AZD103, ELND-005,AbMole,M21016)可通過(guò)穩(wěn)定Aβ1-42的低聚態(tài)構(gòu)象,阻止Aβ蛋白的進(jìn)一步聚集。在動(dòng)物研究中,Scyllo-inositol(ELND-005)降低了可溶性和不溶性 Aβ1–40的濃度,并改善了突觸丟失和神經(jīng)膠質(zhì)炎癥反應(yīng)。此外,胰島素信號(hào)傳導(dǎo)在維持突觸功能和認(rèn)知功能中起著重要作用,Scyllo-inositol(AZD 103, ELND-005)還能增強(qiáng)胰島素信號(hào)傳導(dǎo)改善實(shí)驗(yàn)動(dòng)物的認(rèn)知和學(xué)習(xí)能力[11]。
三、靶向Tau蛋白的調(diào)節(jié)劑
Tau(微管相關(guān)蛋白Tau,MAPT)是一種細(xì)胞質(zhì)蛋白,主要的生理功能是與微管蛋白結(jié)合,穩(wěn)定微管。在阿爾茨海默癥中,Tau蛋白異常磷酸化,產(chǎn)生對(duì)神經(jīng)元有害的聚集體(神經(jīng)原纖維纏結(jié))。以Tau蛋白為靶點(diǎn)的調(diào)節(jié)劑主要分為兩類(lèi),第一類(lèi)是調(diào)節(jié)Tau磷酸化相關(guān)的信號(hào)通路、激酶或者去磷酸化酶(如GSK3、PP2A等);第二類(lèi)則是抑制磷酸化Tau蛋白形成纏結(jié)。
1. Tau蛋白磷酸化調(diào)節(jié)劑
Valproic acid(AbMole,M1876)、SB216763(AbMole,M2061)、Tideglusib (NP-12,NP031112,AbMole,M2306)等化合物是高效的GSK3抑制劑,可通過(guò)抑制GSK-3β的活性,減少Tau蛋白在多個(gè)位點(diǎn)(如 Ser396、Thr231)的磷酸化。在動(dòng)物模型中,這類(lèi)抑制劑可降低Tau磷酸化水平,并改善與Tau相關(guān)的神經(jīng)元結(jié)構(gòu)異常。還有研究發(fā)現(xiàn)細(xì)胞周期蛋白依賴性激酶 5(CDK5)在神經(jīng)元中過(guò)度激活時(shí)會(huì)導(dǎo)致Tau磷酸化。Roscovitine(Seliciclib, CYC202,AbMole,M1974)可特異性抑制CDK5的活性,在實(shí)驗(yàn)中能減少Tau磷酸化產(chǎn)物的生成。蛋白磷酸酶2A(PP2A)是Tau去磷酸化的主要酶類(lèi),F(xiàn)orskolin被文獻(xiàn)證實(shí)可以通過(guò)激活PP2A,增強(qiáng)Tau的去磷酸化。Davunetide(NAP,AbMole,M29256)是一種由8個(gè)氨基酸組成的多肽,來(lái)源于活性依賴性神經(jīng)保護(hù)蛋白 (ADNP)。Davunetide已在阿爾茨海默癥動(dòng)物模型中進(jìn)行了測(cè)試,并表現(xiàn)出調(diào)節(jié)微管組裝,以及抑制Tau過(guò)度磷酸化和減少Aβ蛋白等功能。
2. Tau蛋白聚集抑制劑
Methylene blue(亞甲藍(lán),亞甲基藍(lán),AbMole,M5783)可與Tau蛋白的聚集核心結(jié)合,抑制Tau原纖維的形成,并促進(jìn)已形成的聚集體解聚,Methylene blue被用于減少小鼠模型中Tau聚集物的沉積,改善神經(jīng)元的存活狀態(tài)。TRx0237(Leucomethylene blue mesylate,AbMole,M14554)是一種Methylene blue (亞甲基藍(lán))的一種還原形式,在阿爾茲海默癥動(dòng)物模型中的早期Tau蛋白的聚集表現(xiàn)出顯著的抑制活性。Curcumin(Diferuloylmethane,姜黃素,AbMole,M2198)是一種具有多種活性的天然產(chǎn)物,近期有研究發(fā)現(xiàn)Curcumin可抑制Tau蛋白的聚集。Lithium chloride(LiCl,氯化鋰,M9977)也是一種GSK3抑制劑,廣泛用于中樞神經(jīng)系統(tǒng)特別是AD模型的研究。
3. 靶向Tau蛋白的其它調(diào)節(jié)劑
Salsalate(Disalicylic acid,雙水楊酸酯,AbMole,M2998)是一種小分子非甾體抗炎劑,已被證明可以抑制Tau乙酰化。在轉(zhuǎn)基因小鼠模型中,Salsalate降低了海馬萎縮并減少了記憶缺陷。LY3372689(Ceperognastat,AbMole,M29407)是一種O-GlcNAcase (OGA) 酶抑制劑,O-GlcNAcase酶負(fù)責(zé)去除蛋白質(zhì)上的O-GlcNAc修飾。LY3372689通過(guò)抑制OGA,進(jìn)而增加Tau蛋白的O-GlcNAcylation水平,減少Tau蛋白在相關(guān)位點(diǎn)的磷酸化,降低Tau蛋白的聚集傾向。TPI-287(Abeotaxane,AbMole,M30686)是一種合成的紫杉烷衍生物,最初用于研究中樞神經(jīng)系統(tǒng)惡性腫瘤。TPI-287通過(guò)靶向微管蛋白(Tubulin),發(fā)揮微管穩(wěn)定作用。在正常神經(jīng)元中,Tau蛋白有助于微管的穩(wěn)定,而當(dāng)Tau蛋白功能失調(diào)時(shí),微管會(huì)變得不穩(wěn)定,導(dǎo)致軸突運(yùn)輸受損。TPI-287通過(guò)穩(wěn)定微管,有助于補(bǔ)償因Tau蛋白功能失調(diào)導(dǎo)致的微管不穩(wěn)定性。在Tau轉(zhuǎn)基因小鼠模型中,TPI-287能夠降低大腦中過(guò)度磷酸化的Tau蛋白水平,并改善認(rèn)知表現(xiàn)。Nicotinamide(Niacinamide,煙酰胺,AbMole,M4896)是NAD和NADP的活性成分,煙酰胺可以預(yù)防阿爾茨海默癥小鼠模型的認(rèn)知缺陷,并能降低磷酸化Tau蛋白(Thr231)在大腦中的濃度。此外,煙酰胺還能抑制大腦sirtuin脫乙酰酶,上調(diào)乙酰基α-微管蛋白、蛋白 p25 和 MAP2c,上述這些變化都與微管穩(wěn)定性的增加有關(guān)。
四、靶向線粒體功能障礙的調(diào)節(jié)劑
靶向細(xì)胞器(例如線粒體)是抑制阿爾茨海默癥的一種新方法,與目前主導(dǎo)研究的以蛋白質(zhì)為重點(diǎn)的策略不同。線粒體功能障礙在阿爾茨海默癥早期發(fā)生,促進(jìn)突觸損傷和細(xì)胞凋亡,并被認(rèn)為是神經(jīng)退化的重要因素[12]。 MitoQ(Mitoquinone,AbMole,M9068)是一種線粒體靶向抗氧化劑,能夠穿透線粒體并中和自由基,從而減少氧化應(yīng)激[13]。 Latrepirdine(Dimebolin,AbMole,M2231)是一種具有神經(jīng)保護(hù)、抗凋亡作用等多種活性的化合物,Dimebon抑制線粒體通透性轉(zhuǎn)換孔(mPTP)的開(kāi)放,增加線粒體膜電位,改善ATP合成。Latrepirdine在動(dòng)物實(shí)驗(yàn)中顯示出改善認(rèn)知和學(xué)習(xí)的效果。除了上述幾種化合物,Resveratrol(SRT501,白藜蘆醇,AbMole,M2267)等也可以增強(qiáng)線粒體功能、減少氧化應(yīng)激并抑制AD動(dòng)物模型中的退行性神經(jīng)變化。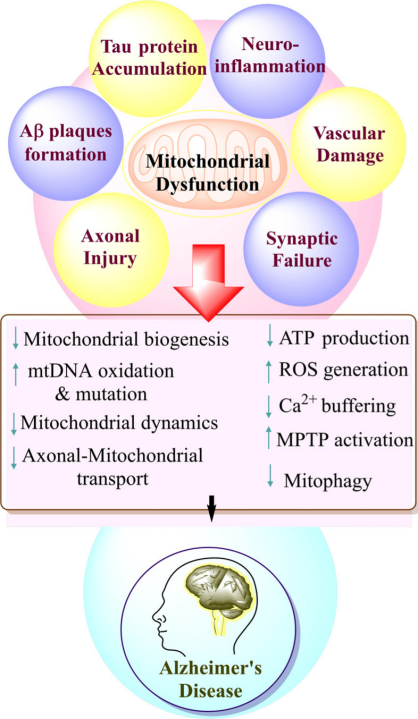
五、靶向神經(jīng)炎癥的抑制劑

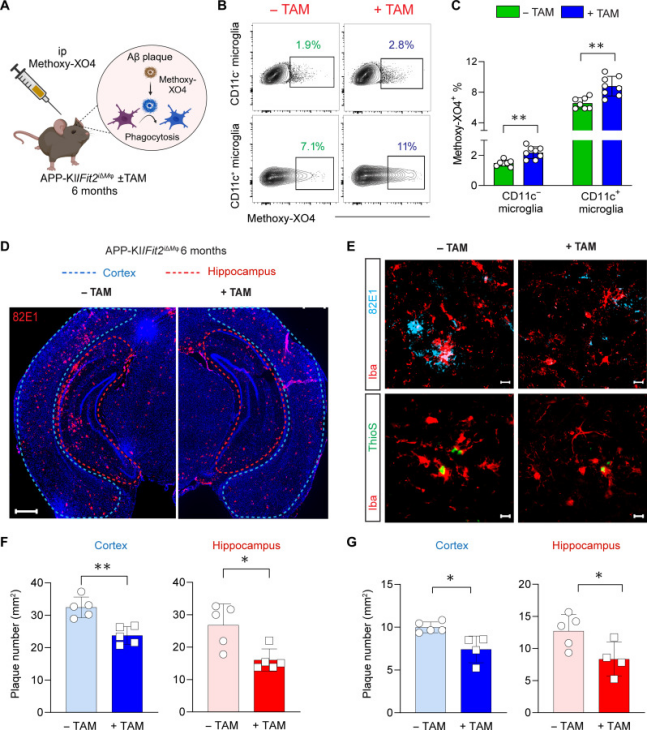
圖 5. Microglial FIT2 deficiency reduces Aβ load in the AD brain[15]
2. Small Struct. 2024, 5, 2400241.
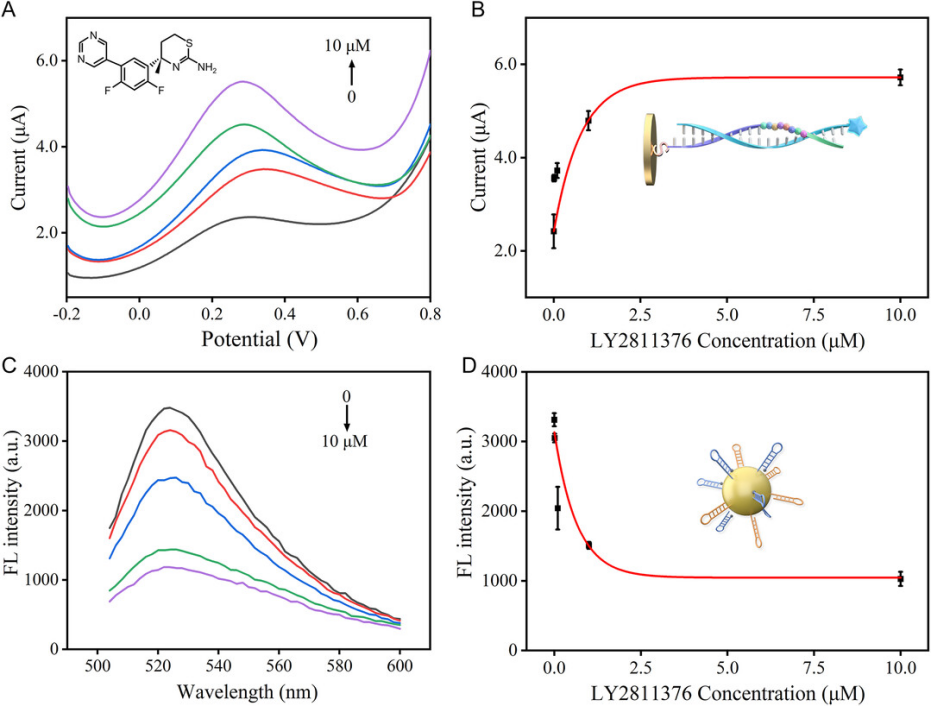

圖 6. Inhibition of BACE1 by the LY2811376. A) SWV curves of incubation with different concentrations of LY2811376 (0, 0.01, 0.1, 1, and 10 μm)[16]


參考文獻(xiàn)及鳴謝
[1] Marco Racchi, Michela Mazzucchelli, S. Carolina Lenzken, et al., Role of acetylcholinesterase inhibitors in the regulation of amyloid β precursor protein (AβPP) metabolism, Chemico-Biological Interactions 157-158 (2005) 335-338.
[2] Marta Goschorska, Izabela Gutowska, Irena Baranowska-Bosiacka, et al., Influence of Acetylcholinesterase Inhibitors Used in Alzheimer’s Disease Treatment on the Activity of Antioxidant Enzymes and the Concentration of Glutathione in THP-1 Macrophages under Fluoride-Induced Oxidative Stress, 16(1) (2019) 10.
[3] Jae-Kwon Jo, Gihyun Lee, Cong D. Nguyen, et al., Effects of Donepezil Treatment on Brain Metabolites, Gut Microbiota, and Gut Metabolites in an Amyloid Beta-Induced Cognitive Impairment Mouse Pilot Model, Molecules (Basel, Switzerland), 2022.
[4] N. M. Rozumna, V. V. Hanzha, E. A. Lukyanetz, Memantine protects the cultured rat hippocampal neurons treated by NMDA and amyloid β1-42, Frontiers in neuroscience 17 (2023) 1269664.
[5] A. Crestini, E. Carbone, R. Rivabene, et al., A Systematic Review on Drugs Acting as Nicotinic Acetylcholine Receptor Agonists in the Treatment of Dementia, Cells 13(3) (2024).
[6] A. Delport, R. Hewer, The amyloid precursor protein: a converging point in Alzheimer's disease, Molecular neurobiology 59(7) (2022) 4501-4516.
[7] S. Singh, F. Yang, A. Sivils, et al., Amylin and Secretases in the Pathology and Treatment of Alzheimer's Disease, Biomolecules 12(7) (2022).
[8] A. E. Abdallah, Review on anti-alzheimer drug development: approaches, challenges and perspectives, RSC advances 14(16) (2024) 11057-11088.
[9] Y. J. Cheng, C. H. Lin, H. Y. Lane, From Menopause to Neurodegeneration-Molecular Basis and Potential Therapy, International journal of molecular sciences 22(16) (2021).
[10] Y. J. Kang, Y. N. Diep, M. Tran, et al., Therapeutic Targeting Strategies for Early- to Late-Staged Alzheimer's Disease, International journal of molecular sciences 21(24) (2020).
[11] J. Pitt, M. Thorner, D. Brautigan, et al., Protection against the synaptic targeting and toxicity of Alzheimer's-associated Aβ oligomers by insulin mimetic chiro-inositols, FASEB journal : official publication of the Federation of American Societies for Experimental Biology 27(1) (2013) 199-207.
[12] P. H. Reddy, M. F. Beal, Amyloid beta, mitochondrial dysfunction and synaptic damage: implications for cognitive decline in aging and Alzheimer's disease, Trends in molecular medicine 14(2) (2008) 45-53.
[13] S. Bhatia, R. Rawal, P. Sharma, et al., Mitochondrial Dysfunction in Alzheimer's Disease: Opportunities for Drug Development, Current neuropharmacology 20(4) (2022) 675-692.
[14] D. Kothandan, D. S. Singh, G. Yerrakula, et al., Advanced Glycation End Products-Induced Alzheimer's Disease and Its Novel Therapeutic Approaches: A Comprehensive Review, Cureus 16(5) (2024) e61373.
[15] X. Wu, J. A. Miller, B. T. K. Lee, et al., Reducing microglial lipid load enhances β amyloid phagocytosis in an Alzheimer's disease mouse model, Science advances 11(6) (2025) eadq6038.
[16] Tao Cheng, Peifen Lu, Yixi Dong, et al., A Bilingual Nanobiosensor for Cross‐Category Integrated Decoding of the Beta‐Site Amyloid Precursor Protein‐Cleaving Enzyme 1–Aβ Oligomer Signaling Pathway, Small Structures 5(11) (2024).
一、神經(jīng)遞質(zhì)與信號(hào)通路調(diào)節(jié)劑
1. 乙酰膽堿酯酶(AChE)抑制劑
AD的早期特征之一是基底前腦(BFB)區(qū)域中的膽堿能神經(jīng)元丟失,導(dǎo)致乙酰膽堿的釋放減少,進(jìn)而影響大腦多個(gè)區(qū)域中神經(jīng)元的功能活性,并最終導(dǎo)致學(xué)習(xí)和記憶功能障礙。在動(dòng)物AD模型中,通過(guò)注射乙酰膽堿酯酶(AChE)抑制劑可增加大腦中乙酰膽堿的水平,從而改改善上述狀況。在科研領(lǐng)域中,備受關(guān)注的AChE抑制劑有Donepezil(E2020,AbMole,M3601)、Rivastigmine(ENA 713,AbMole,M10928)、Galantamine(AbMole,M14548)、Tacrine(AbMole,M54846)等,它們可有效抑制AChE家族的活性。上述抑制劑除了能提高AD模型中的乙酰膽堿酶水平,還能抑制Aβ蛋白的產(chǎn)生,其機(jī)制如下:AChE抑制劑可通過(guò)升高乙酰膽堿的水平促進(jìn)淀粉樣前體蛋白(APP)通過(guò)非淀粉樣蛋白途徑代謝,減少Aβ肽的產(chǎn)生[1];部分乙酰膽堿酯酶抑制劑如Donepezil(E2020)、Rivastigmine(ENA 713)等可通過(guò)增加乙酰膽堿水平間接抑制γ-分泌酶的活性。γ-分泌酶負(fù)責(zé)切割A(yù)PP產(chǎn)生Aβ肽,其活性的抑制可以減少Aβ蛋白的生成[2]。


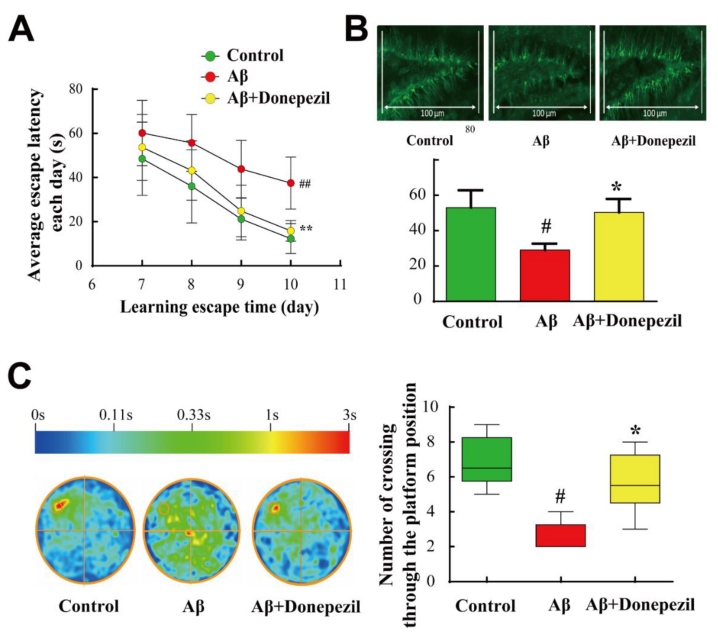
圖 1. Donepezil可以改善Aβ25-35肽誘導(dǎo)的小鼠AD模型的水迷宮測(cè)試表現(xiàn)[3]
2. N-甲基-D-天冬氨酸(NMDA)受體抑制劑
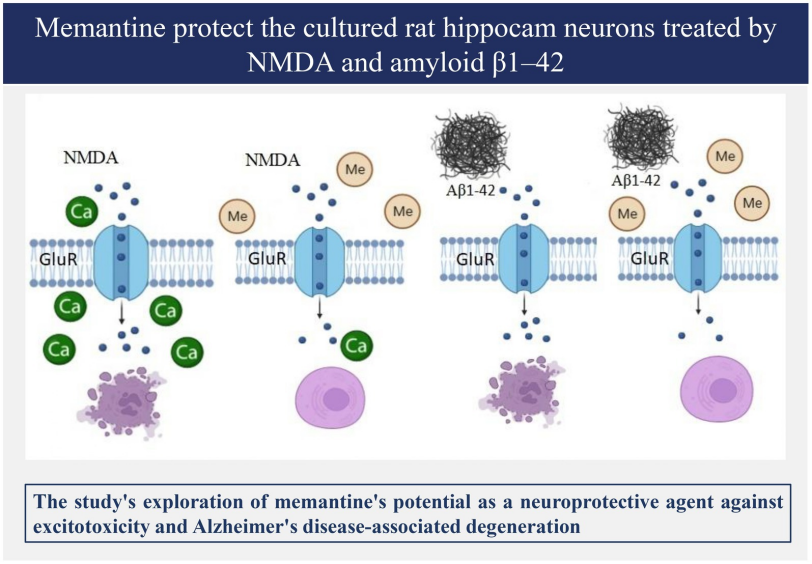
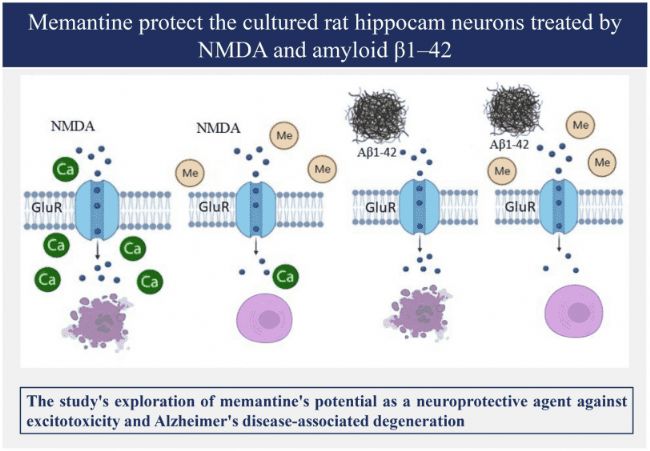
NMDA受體(N-甲基-D-天冬氨酸受體)是中樞神經(jīng)系統(tǒng)中的一種離子型谷氨酸受體,廣泛表達(dá)于大腦的各個(gè)區(qū)域。NMDA受體的過(guò)度激活將導(dǎo)致鈣離子內(nèi)流增加,破壞細(xì)胞內(nèi)鈣穩(wěn)態(tài),進(jìn)而引發(fā)一系列細(xì)胞內(nèi)信號(hào)通路的紊亂,最終導(dǎo)致神經(jīng)元死亡和AD樣變化。NMDA受體拮抗劑如Memantine(AbMole,M3326)可通過(guò)抑制NMDA受體保護(hù)神經(jīng)元,在多種動(dòng)物模型(大鼠、小鼠)中表現(xiàn)出良好的AD抑制效果。例如Memantine可保護(hù)由Aβ1-40 誘導(dǎo)的大鼠神經(jīng)元細(xì)胞損傷[4]。


圖 2. Memantine對(duì)淀粉樣β蛋白1-42處理的大鼠海馬神經(jīng)元細(xì)胞的保護(hù)作用示意圖[4]
3. 毒蕈堿受體(mAChR)激活劑
毒蕈堿受體(mAChR)在哺乳動(dòng)物的認(rèn)知功能中扮演著重要的角色,分為M1至M5五個(gè)亞型,廣泛分布于大腦皮層、海馬和基底神經(jīng)節(jié)等區(qū)域,與認(rèn)知功能密切相關(guān)。Blarcamesine(AbMole,M6203)和ML380(AbMole,M28716)是mAChR的激動(dòng)劑,可通過(guò)調(diào)節(jié)細(xì)胞內(nèi)鈣穩(wěn)態(tài),減少Aβ蛋白對(duì)神經(jīng)元的毒性作用,這種調(diào)節(jié)作用有助于維持神經(jīng)元的正常功能,減少神經(jīng)退行性變化。
4. 煙堿型乙酰膽堿受體(nAChRs)激動(dòng)劑
煙堿型乙酰膽堿受體(nAChRs)激動(dòng)劑也是AD動(dòng)物模型研究中常用的一類(lèi)工具化合物。ABT-089(Pozanicline,AbMole,M8553)是煙堿 α4β2和α6β2受體的激動(dòng)劑,可顯著改善實(shí)驗(yàn)動(dòng)物的認(rèn)知功能[5]。Varenicline(CP 526555,AbMole,M6268)、Isopronicline(TC-1734,ACD3480AbMole,M29693)作為α4β2或α7 nAChR的激動(dòng)劑可以在多種動(dòng)物體內(nèi)調(diào)節(jié)神經(jīng)遞質(zhì)釋放、減少氧化應(yīng)激和炎癥反應(yīng),提供神經(jīng)保護(hù)以及增強(qiáng)突觸可塑性,促進(jìn)學(xué)習(xí)和記憶[5]。
二、作用于淀粉樣蛋白(Aβ)的抑制劑
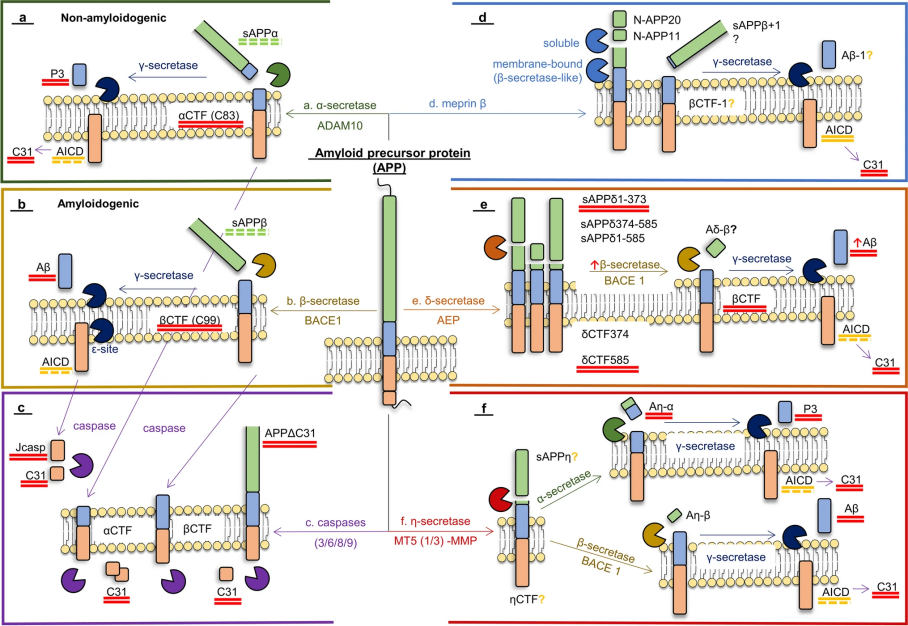
淀粉樣蛋白的異常聚集是AD的核心標(biāo)志之一。Aβ蛋白的異常產(chǎn)生和清除失衡導(dǎo)致其在腦內(nèi)聚集,形成寡聚體和原纖維并破壞突觸的結(jié)構(gòu)與功能。Aβ蛋白的形成是一個(gè)多步驟的蛋白水解過(guò)程,核心涉及淀粉樣前體蛋白(APP)的切割。APP是一種表達(dá)于神經(jīng)元表面的跨膜蛋白,在正常生理?xiàng)l件下,APP 更易被α-分泌酶切割。但當(dāng)APP被 β-分泌酶(如BACE1)首先切割時(shí),則會(huì)產(chǎn)生 C 端片段(C99),C99則進(jìn)一步被γ-分泌酶切割后將產(chǎn)生不同長(zhǎng)度的 Aβ肽段,包括Aβ1-40(約占 90%)和 Aβ1-42(約占 10%)。Aβ1-42 (Amyloid β-Peptide 1-42)因疏水性更強(qiáng),更易發(fā)生錯(cuò)誤折疊并形成聚集物,也是動(dòng)物AD模型最常用的造模劑之一[6]。


圖 3. 淀粉樣蛋白的產(chǎn)生示意圖[6]
1. Aβ蛋白合成抑制劑
β分泌酶抑制劑
β-分泌酶(也稱(chēng)為β位點(diǎn)APP裂解酶; BACE1),是切割A(yù)PP并產(chǎn)生Aβ蛋白的起始和核心步驟。β-分泌酶在AD研究領(lǐng)域中一直是熱門(mén)靶點(diǎn),Verubecestat (MK-8931,AbMole,M9386) 可通過(guò)高親和力結(jié)合BACE1的疏水位點(diǎn),抑制其活性,Verubecestat在小鼠和靈長(zhǎng)類(lèi)動(dòng)物模型中顯著降低了腦脊液和大腦中的Aβ蛋白水平[7]。此外, AZD3293 (Lanabecestat,AbMole,M5227) 、Atabecestat (JNJ-54861911,AbMole,M10943) 、Elenbecestat (E2609,AbMole,M10942) 、Umibecestat(CNP520,AbMole,M28304)、LY2886721(AbMole,M1987)等也是動(dòng)物實(shí)驗(yàn)中常用的β-分泌酶(BACE1)抑制劑。
γ分泌酶抑制劑和調(diào)節(jié)劑
γ-分泌酶是負(fù)責(zé)Aβ生成最后一步的酶,也是AD研究的另一個(gè)重要靶點(diǎn)。Semagacestat(LY450139,AbMole,M2277)是一種經(jīng)典的γ-分泌酶抑制劑(GSIs),通過(guò)抑制γ-分泌酶的活性,減少Aβ蛋白的產(chǎn)生。Avagacestat(BMS-708163,AbMole,M1947)則是一種選擇性的γ-分泌酶抑制劑,能夠在降低Aβ蛋白水平的同時(shí)減少對(duì)Notch信號(hào)通路的影響。Nirogacestat(PF-3084014,AbMole,M9041)是一種可以通過(guò)灌胃形式或混在動(dòng)物飲用水中給予實(shí)驗(yàn)動(dòng)物的γ-分泌酶抑制劑,適合長(zhǎng)期研究使用。Begacestat(GSI-953,AbMole,M3619)也是一種對(duì)Notch-1通路具有低抑制活性的γ-分泌酶抑制劑,能夠優(yōu)先抑制APP的切割,保留Notch1的信號(hào)。除了上述幾款抑制劑,LY-411575(LSN-411575,AbMole,M2130)、MK-0752(AbMole,M2120)等抑制劑也可用于動(dòng)物AD模型的研究,抑制Aβ的產(chǎn)生。2014年,AbMole的兩款抑制劑分別被西班牙國(guó)家心血管研究中心和美國(guó)哥倫比亞大學(xué)用于動(dòng)物體內(nèi)實(shí)驗(yàn),相關(guān)科研成果發(fā)表于頂刊 Nature 和 Nature Medicine。
α-分泌酶激活劑
α分泌酶活性的上調(diào)可以促進(jìn)APP 以非淀粉樣蛋白的形式切割,以此減少 Aβ蛋白的形成并增加可溶性結(jié)構(gòu)域(sAPPα)的產(chǎn)生。Etazolate(AbMole,M56752)是磷酸二酯酶 (PDE4) 抑制劑和GABAα受體調(diào)節(jié)劑,有文獻(xiàn)證實(shí)Etazolate可激活神經(jīng)元α分泌酶,在具體實(shí)驗(yàn)中Etazolate可以通過(guò)口服形式給與動(dòng)物,便于開(kāi)展實(shí)驗(yàn)研究[7]。Bryostatin-1(苔蘚抑素1,AbMole,M7647)、Epigallocatechin Gallate(EGCG,表沒(méi)食子兒茶素沒(méi)食子酸酯,AbMole,M4208)等調(diào)節(jié)劑可通過(guò)激活蛋白激酶C(PKC)提高α-分泌酶的活性,促進(jìn)APP的非淀粉樣蛋白途徑代謝[8]。Gemfibrozil(AbMole,CI-719,M7822)則可通過(guò)刺激ADAM10(α-分泌酶家族重要亞型)的啟動(dòng)子活性,增加ADAM10的表達(dá),從而減少Aβ蛋白的產(chǎn)生。雌二醇(Estradiol,β-Estradiol,AbMole,M5625)是一種激素,最近的文獻(xiàn)發(fā)現(xiàn)雌二醇可通過(guò)激活A(yù)kt和mTOR信號(hào)通路,增加α-分泌酶的活性,促進(jìn)APP的非淀粉樣蛋白途徑代謝[9]。
2. Aβ蛋白聚集抑制劑
Aβ蛋白產(chǎn)生神經(jīng)毒性的主要機(jī)制之一是聚集體的形成。在動(dòng)物實(shí)驗(yàn)中,Aβ蛋白聚集抑制劑通過(guò)阻止Aβ蛋白的聚集,可減少后者對(duì)神經(jīng)元的毒性。銅和鋅離子等金屬離子在Aβ蛋白的聚集過(guò)程中起關(guān)鍵作用,Clioquinol(PBT1,AbMole,M5528)是一種羥基喹啉離子載體,可通過(guò)螯合上述金屬離子減少Aβ蛋白的聚集[10]。Scyllo-inositol(Scyllitol,AZD103, ELND-005,AbMole,M21016)可通過(guò)穩(wěn)定Aβ1-42的低聚態(tài)構(gòu)象,阻止Aβ蛋白的進(jìn)一步聚集。在動(dòng)物研究中,Scyllo-inositol(ELND-005)降低了可溶性和不溶性 Aβ1–40的濃度,并改善了突觸丟失和神經(jīng)膠質(zhì)炎癥反應(yīng)。此外,胰島素信號(hào)傳導(dǎo)在維持突觸功能和認(rèn)知功能中起著重要作用,Scyllo-inositol(AZD 103, ELND-005)還能增強(qiáng)胰島素信號(hào)傳導(dǎo)改善實(shí)驗(yàn)動(dòng)物的認(rèn)知和學(xué)習(xí)能力[11]。
三、靶向Tau蛋白的調(diào)節(jié)劑
Tau(微管相關(guān)蛋白Tau,MAPT)是一種細(xì)胞質(zhì)蛋白,主要的生理功能是與微管蛋白結(jié)合,穩(wěn)定微管。在阿爾茨海默癥中,Tau蛋白異常磷酸化,產(chǎn)生對(duì)神經(jīng)元有害的聚集體(神經(jīng)原纖維纏結(jié))。以Tau蛋白為靶點(diǎn)的調(diào)節(jié)劑主要分為兩類(lèi),第一類(lèi)是調(diào)節(jié)Tau磷酸化相關(guān)的信號(hào)通路、激酶或者去磷酸化酶(如GSK3、PP2A等);第二類(lèi)則是抑制磷酸化Tau蛋白形成纏結(jié)。
1. Tau蛋白磷酸化調(diào)節(jié)劑
Valproic acid(AbMole,M1876)、SB216763(AbMole,M2061)、Tideglusib (NP-12,NP031112,AbMole,M2306)等化合物是高效的GSK3抑制劑,可通過(guò)抑制GSK-3β的活性,減少Tau蛋白在多個(gè)位點(diǎn)(如 Ser396、Thr231)的磷酸化。在動(dòng)物模型中,這類(lèi)抑制劑可降低Tau磷酸化水平,并改善與Tau相關(guān)的神經(jīng)元結(jié)構(gòu)異常。還有研究發(fā)現(xiàn)細(xì)胞周期蛋白依賴性激酶 5(CDK5)在神經(jīng)元中過(guò)度激活時(shí)會(huì)導(dǎo)致Tau磷酸化。Roscovitine(Seliciclib, CYC202,AbMole,M1974)可特異性抑制CDK5的活性,在實(shí)驗(yàn)中能減少Tau磷酸化產(chǎn)物的生成。蛋白磷酸酶2A(PP2A)是Tau去磷酸化的主要酶類(lèi),F(xiàn)orskolin被文獻(xiàn)證實(shí)可以通過(guò)激活PP2A,增強(qiáng)Tau的去磷酸化。Davunetide(NAP,AbMole,M29256)是一種由8個(gè)氨基酸組成的多肽,來(lái)源于活性依賴性神經(jīng)保護(hù)蛋白 (ADNP)。Davunetide已在阿爾茨海默癥動(dòng)物模型中進(jìn)行了測(cè)試,并表現(xiàn)出調(diào)節(jié)微管組裝,以及抑制Tau過(guò)度磷酸化和減少Aβ蛋白等功能。
2. Tau蛋白聚集抑制劑
Methylene blue(亞甲藍(lán),亞甲基藍(lán),AbMole,M5783)可與Tau蛋白的聚集核心結(jié)合,抑制Tau原纖維的形成,并促進(jìn)已形成的聚集體解聚,Methylene blue被用于減少小鼠模型中Tau聚集物的沉積,改善神經(jīng)元的存活狀態(tài)。TRx0237(Leucomethylene blue mesylate,AbMole,M14554)是一種Methylene blue (亞甲基藍(lán))的一種還原形式,在阿爾茲海默癥動(dòng)物模型中的早期Tau蛋白的聚集表現(xiàn)出顯著的抑制活性。Curcumin(Diferuloylmethane,姜黃素,AbMole,M2198)是一種具有多種活性的天然產(chǎn)物,近期有研究發(fā)現(xiàn)Curcumin可抑制Tau蛋白的聚集。Lithium chloride(LiCl,氯化鋰,M9977)也是一種GSK3抑制劑,廣泛用于中樞神經(jīng)系統(tǒng)特別是AD模型的研究。
3. 靶向Tau蛋白的其它調(diào)節(jié)劑
Salsalate(Disalicylic acid,雙水楊酸酯,AbMole,M2998)是一種小分子非甾體抗炎劑,已被證明可以抑制Tau乙酰化。在轉(zhuǎn)基因小鼠模型中,Salsalate降低了海馬萎縮并減少了記憶缺陷。LY3372689(Ceperognastat,AbMole,M29407)是一種O-GlcNAcase (OGA) 酶抑制劑,O-GlcNAcase酶負(fù)責(zé)去除蛋白質(zhì)上的O-GlcNAc修飾。LY3372689通過(guò)抑制OGA,進(jìn)而增加Tau蛋白的O-GlcNAcylation水平,減少Tau蛋白在相關(guān)位點(diǎn)的磷酸化,降低Tau蛋白的聚集傾向。TPI-287(Abeotaxane,AbMole,M30686)是一種合成的紫杉烷衍生物,最初用于研究中樞神經(jīng)系統(tǒng)惡性腫瘤。TPI-287通過(guò)靶向微管蛋白(Tubulin),發(fā)揮微管穩(wěn)定作用。在正常神經(jīng)元中,Tau蛋白有助于微管的穩(wěn)定,而當(dāng)Tau蛋白功能失調(diào)時(shí),微管會(huì)變得不穩(wěn)定,導(dǎo)致軸突運(yùn)輸受損。TPI-287通過(guò)穩(wěn)定微管,有助于補(bǔ)償因Tau蛋白功能失調(diào)導(dǎo)致的微管不穩(wěn)定性。在Tau轉(zhuǎn)基因小鼠模型中,TPI-287能夠降低大腦中過(guò)度磷酸化的Tau蛋白水平,并改善認(rèn)知表現(xiàn)。Nicotinamide(Niacinamide,煙酰胺,AbMole,M4896)是NAD和NADP的活性成分,煙酰胺可以預(yù)防阿爾茨海默癥小鼠模型的認(rèn)知缺陷,并能降低磷酸化Tau蛋白(Thr231)在大腦中的濃度。此外,煙酰胺還能抑制大腦sirtuin脫乙酰酶,上調(diào)乙酰基α-微管蛋白、蛋白 p25 和 MAP2c,上述這些變化都與微管穩(wěn)定性的增加有關(guān)。
四、靶向線粒體功能障礙的調(diào)節(jié)劑
靶向細(xì)胞器(例如線粒體)是抑制阿爾茨海默癥的一種新方法,與目前主導(dǎo)研究的以蛋白質(zhì)為重點(diǎn)的策略不同。線粒體功能障礙在阿爾茨海默癥早期發(fā)生,促進(jìn)突觸損傷和細(xì)胞凋亡,并被認(rèn)為是神經(jīng)退化的重要因素[12]。 MitoQ(Mitoquinone,AbMole,M9068)是一種線粒體靶向抗氧化劑,能夠穿透線粒體并中和自由基,從而減少氧化應(yīng)激[13]。 Latrepirdine(Dimebolin,AbMole,M2231)是一種具有神經(jīng)保護(hù)、抗凋亡作用等多種活性的化合物,Dimebon抑制線粒體通透性轉(zhuǎn)換孔(mPTP)的開(kāi)放,增加線粒體膜電位,改善ATP合成。Latrepirdine在動(dòng)物實(shí)驗(yàn)中顯示出改善認(rèn)知和學(xué)習(xí)的效果。除了上述幾種化合物,Resveratrol(SRT501,白藜蘆醇,AbMole,M2267)等也可以增強(qiáng)線粒體功能、減少氧化應(yīng)激并抑制AD動(dòng)物模型中的退行性神經(jīng)變化。


圖 4. AD模型中與線粒體功能的破壞[13]
五、靶向神經(jīng)炎癥的抑制劑
在阿爾茨海默癥(AD)的形成機(jī)制中,神經(jīng)炎癥被認(rèn)為是驅(qū)動(dòng)神經(jīng)元損傷和認(rèn)知功能衰退的關(guān)鍵環(huán)節(jié)之一。這種炎癥反應(yīng)主要由小膠質(zhì)細(xì)胞、星形膠質(zhì)細(xì)胞的異常激活及促炎因子的過(guò)度釋放介導(dǎo),并與β-淀粉樣蛋白(Aβ)沉積、Tau蛋白聚集形成惡性循環(huán)。Masitinib(AB1010,AbMole,M1838)是一種新型的,具有口服活性的Kit和PDGFRα/β抑制劑,可通過(guò)調(diào)節(jié)小膠質(zhì)細(xì)胞和星形膠質(zhì)細(xì)胞的激活來(lái)減輕神經(jīng)炎癥,可用于研究動(dòng)物AD模型。Triolex(NE3107,AbMole,M40910)、Selnoflast(RO-7486967,AbMole,M54582)等免疫調(diào)節(jié)劑也在AD研究中有著重要的應(yīng)用。Azeliragon(TTP488,AbMole,M9483)是一種RAGE(晚期糖基化終末產(chǎn)物受體)抑制劑,Azeliragon通過(guò)與RAGE的細(xì)胞外結(jié)構(gòu)域競(jìng)爭(zhēng)結(jié)合,阻止RAGE與其配體(如Aβ、AGEs、HMGB1和S100B)的結(jié)合,從而抑制RAGE的激活,這種抑制作用可以減少炎癥信號(hào)的傳導(dǎo),減輕神經(jīng)炎癥。在轉(zhuǎn)基因小鼠模型中,Azeliragon顯著減少了中樞神經(jīng)系統(tǒng)中的Aβ沉積和炎癥標(biāo)志物(如TNF-α、TGF-β和IL-1)的表達(dá),并改善了認(rèn)知功能[14]。
范例詳解
1. Sci Adv. 2025 Feb 7;11(6):eadq6038.
南洋理工大學(xué)的科研團(tuán)隊(duì)在上述研究中探究了阿爾茨海默癥(AD)小鼠模型中腦內(nèi)巨噬細(xì)胞(包括小膠質(zhì)細(xì)胞和邊界相關(guān)巨噬細(xì)胞,BAMs)的脂滴(LDs)積累與 β 淀粉樣蛋白(Aβ)清除功能的關(guān)系,核心發(fā)現(xiàn)如下:AD模型小鼠(APP-KI)中,靠近 Aβ 斑塊的小膠質(zhì)細(xì)胞(尤其是CD11c⁺激活亞型)和 CD206⁺BAMs脂滴積累顯著增多。小膠質(zhì)細(xì)胞的脂滴含量與吞噬 Aβ蛋白、凋亡細(xì)胞的能力呈負(fù)相關(guān),脂滴積累導(dǎo)致其吞噬功能受損。AbMole的Methoxy-XO4(AbMole,M6952)是一種能穿過(guò)血腦屏障的熒光探針,可特異性標(biāo)記腦內(nèi)的 Aβ。在上述文章中被實(shí)驗(yàn)人員用于探究小膠質(zhì)細(xì)胞對(duì)Aβ蛋白的吞噬能力:通過(guò)檢測(cè)小膠質(zhì)細(xì)胞對(duì) Methoxy-XO4 標(biāo)記的Aβ的攝取率,直接評(píng)估小膠質(zhì)細(xì)胞的體內(nèi)Aβ吞噬活性[15]。


圖 5. Microglial FIT2 deficiency reduces Aβ load in the AD brain[15]
2. Small Struct. 2024, 5, 2400241.
中國(guó)科學(xué)院蘇州生物醫(yī)學(xué)工程與技術(shù)研究所、山東第一醫(yī)科大學(xué)的科研人員在該文章中,開(kāi)發(fā)了一種序列響應(yīng)肽-DNA(SRPD)納米生物傳感器,用于檢測(cè)阿爾茨海默癥(AD)相關(guān)的淀粉樣蛋白信號(hào)通路中的上游分子β-分泌酶(BACE1)的活性和下游β淀粉樣蛋白寡聚體(Aβ蛋白)的水平。由AbMole提供的LY2811376 (AbMole,M2172)作為一種已知的高效 BACE1 抑制劑,在該研究中作為陽(yáng)性對(duì)照,用于驗(yàn)證上述傳感器對(duì)BACE1活性的檢測(cè)能力:通過(guò)檢測(cè)不同濃度的LY2811376 處理后檢測(cè)傳感器的信號(hào)變化,證明該傳感器可檢測(cè)到BACE1的蛋白酶活性變化[16]。


圖 6. Inhibition of BACE1 by the LY2811376. A) SWV curves of incubation with different concentrations of LY2811376 (0, 0.01, 0.1, 1, and 10 μm)[16]


參考文獻(xiàn)及鳴謝
[1] Marco Racchi, Michela Mazzucchelli, S. Carolina Lenzken, et al., Role of acetylcholinesterase inhibitors in the regulation of amyloid β precursor protein (AβPP) metabolism, Chemico-Biological Interactions 157-158 (2005) 335-338.
[2] Marta Goschorska, Izabela Gutowska, Irena Baranowska-Bosiacka, et al., Influence of Acetylcholinesterase Inhibitors Used in Alzheimer’s Disease Treatment on the Activity of Antioxidant Enzymes and the Concentration of Glutathione in THP-1 Macrophages under Fluoride-Induced Oxidative Stress, 16(1) (2019) 10.
[3] Jae-Kwon Jo, Gihyun Lee, Cong D. Nguyen, et al., Effects of Donepezil Treatment on Brain Metabolites, Gut Microbiota, and Gut Metabolites in an Amyloid Beta-Induced Cognitive Impairment Mouse Pilot Model, Molecules (Basel, Switzerland), 2022.
[4] N. M. Rozumna, V. V. Hanzha, E. A. Lukyanetz, Memantine protects the cultured rat hippocampal neurons treated by NMDA and amyloid β1-42, Frontiers in neuroscience 17 (2023) 1269664.
[5] A. Crestini, E. Carbone, R. Rivabene, et al., A Systematic Review on Drugs Acting as Nicotinic Acetylcholine Receptor Agonists in the Treatment of Dementia, Cells 13(3) (2024).
[6] A. Delport, R. Hewer, The amyloid precursor protein: a converging point in Alzheimer's disease, Molecular neurobiology 59(7) (2022) 4501-4516.
[7] S. Singh, F. Yang, A. Sivils, et al., Amylin and Secretases in the Pathology and Treatment of Alzheimer's Disease, Biomolecules 12(7) (2022).
[8] A. E. Abdallah, Review on anti-alzheimer drug development: approaches, challenges and perspectives, RSC advances 14(16) (2024) 11057-11088.
[9] Y. J. Cheng, C. H. Lin, H. Y. Lane, From Menopause to Neurodegeneration-Molecular Basis and Potential Therapy, International journal of molecular sciences 22(16) (2021).
[10] Y. J. Kang, Y. N. Diep, M. Tran, et al., Therapeutic Targeting Strategies for Early- to Late-Staged Alzheimer's Disease, International journal of molecular sciences 21(24) (2020).
[11] J. Pitt, M. Thorner, D. Brautigan, et al., Protection against the synaptic targeting and toxicity of Alzheimer's-associated Aβ oligomers by insulin mimetic chiro-inositols, FASEB journal : official publication of the Federation of American Societies for Experimental Biology 27(1) (2013) 199-207.
[12] P. H. Reddy, M. F. Beal, Amyloid beta, mitochondrial dysfunction and synaptic damage: implications for cognitive decline in aging and Alzheimer's disease, Trends in molecular medicine 14(2) (2008) 45-53.
[13] S. Bhatia, R. Rawal, P. Sharma, et al., Mitochondrial Dysfunction in Alzheimer's Disease: Opportunities for Drug Development, Current neuropharmacology 20(4) (2022) 675-692.
[14] D. Kothandan, D. S. Singh, G. Yerrakula, et al., Advanced Glycation End Products-Induced Alzheimer's Disease and Its Novel Therapeutic Approaches: A Comprehensive Review, Cureus 16(5) (2024) e61373.
[15] X. Wu, J. A. Miller, B. T. K. Lee, et al., Reducing microglial lipid load enhances β amyloid phagocytosis in an Alzheimer's disease mouse model, Science advances 11(6) (2025) eadq6038.
[16] Tao Cheng, Peifen Lu, Yixi Dong, et al., A Bilingual Nanobiosensor for Cross‐Category Integrated Decoding of the Beta‐Site Amyloid Precursor Protein‐Cleaving Enzyme 1–Aβ Oligomer Signaling Pathway, Small Structures 5(11) (2024).
- Hepcidin-25的作用機(jī)制及在炎癥、心血管與腫瘤等動(dòng)物模型中的應(yīng)用
- Klotho蛋白的分子形式、功能及其在疾病與衰老進(jìn)程中的核心作用
- 二甲雙胍(Metformin)在代謝、腫瘤、衰老與神經(jīng)疾病動(dòng)物模型中的作用
- Romidepsin作為HDAC1/2抑制劑在細(xì)胞分化與損傷修復(fù)中的作用
- 白細(xì)胞介素-2(IL-2)的功能、信號(hào)調(diào)控機(jī)制及對(duì)免疫穩(wěn)態(tài)調(diào)控的雙面性
- 腫瘤/纖維化EMT研究中mIHC染色指標(biāo)的組合及選擇方法
- Hepcidin-25(鐵調(diào)素)在鐵代謝與免疫反應(yīng)中的調(diào)節(jié)機(jī)制
- Vadimezan作為多功能STING激動(dòng)劑與血管破壞劑的作用機(jī)制
- 上海天能RapGel系列彩色凝膠快速制備試劑盒新品上市
- 博鷺騰試劑年終大促來(lái)襲,買(mǎi)三免一、爆款特價(jià)等你來(lái)
- 睿杰生物與宇優(yōu)生物聯(lián)袂推出年終狂歡購(gòu)活動(dòng)
- 尚睿生物邀您試用基因編輯利器—Cas12a核酸酶
- 默瑞(上海)生物科技有限公司誠(chéng)聘技術(shù)支持,銷(xiāo)售經(jīng)理
- 尚睿生物基因編輯工具酶(CAS蛋白)誠(chéng)招經(jīng)銷(xiāo)商
- SBC新品高效動(dòng)物組織細(xì)胞核分離試劑盒重磅上線
- 杭州沃森受邀參展第六屆BCM-CUHK-ZJU臨床遺傳學(xué)大會(huì)
Copyright(C) 1998-2025 生物器材網(wǎng) 電話:021-64166852;13621656896 E-mail:info@bio-equip.com






