CAR-T技術從基礎研發到臨床轉化的發展及在腫瘤等疾病中的應用
文章來源公眾號:細胞基因研究圈 作者:南開細胞工程
摘要
摘要:CAR-T細胞療法是近年來癌癥治療領域的一項重大突破,它通過基因工程改造T細胞使其表達特異性靶向腫瘤抗原的嵌合抗原受體(CAR),從而高效清除腫瘤細胞。本文綜述了CAR-T技術從基礎研發到臨床轉化的演進歷程,著重闡述在血液腫瘤、實體瘤、自身免疫性疾病等方面的研究進展,并對CAR-T技術的研究現狀進行了綜述,展望了其未來的研究方向。
01 ✦CAR-T技術的概念及發展
CAR-T,全稱為 Chimeric Antigen Receptor T-Cell Immunotherapy(嵌合抗原受體T細胞免疫療法)。它是一種高度個性化的細胞免疫治療方法,被譽為腫瘤治療領域的一場革命。其中T細胞來源于患者自身(自體)或健康供體(異體),是人體免疫系統中的“主力軍”,能夠識別并殺死異常細胞。嵌合抗原受體(CAR)是一個通過基因工程手段人工設計、合成的蛋白質受體。它被“安裝”在T細胞的表面,充當一個“導航頭”和“激活開關”。簡單來說,CAR-T技術的原理就是通過基因工程,給患者的T細胞裝上一套“GPS導航系統(CAR)”,使其能精準識別并高效摧毀帶有特定“標簽”(抗原)的腫瘤細胞,見圖一。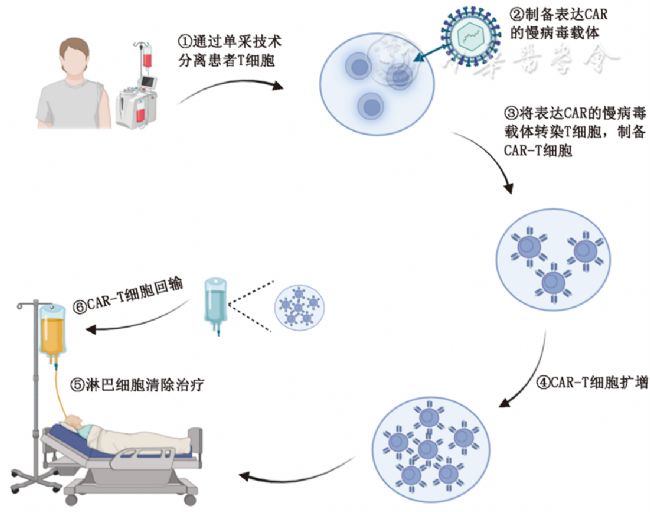
圖1 CAR-T細胞治療流程示意圖[1]
然而CAR-T技術的發展并非一蹴而就,其歷程大致可分為以下幾個階段:
1. 概念萌芽與初步探索
1987年首次提出了嵌合抗原受體(CAR)的概念;1989年首次將嵌合受體導入T細胞,實現了T細胞通過嵌合受體識別抗原。
2.技術突破與效果驗證
其中共刺激信號的引入是CAR-T技術走向成功的最關鍵一步。研究人員(如Kowolik等研究人員)在CAR結構中加入了共刺激域(如CD28)[2]。這種改進如同給T細胞同時提供了“點火開關”和“加油踏板”,使其在體內的增殖、持久性和殺傷能力得到了指數級提升。
3. 臨床轉化與商業化
這一時期,大規模的臨床試驗不斷證實了CAR-T在血液腫瘤中的巨大潛力。2017年成為CAR-T技術的“元年”。美國FDA首次批準了兩款CAR-T產品上市:
Kymriah(諾華公司,靶向CD19):用于治療兒童和年輕成人B細胞ALL。
Yescarta(Kite Pharma,靶向CD19):用于治療特定類型的大B細胞淋巴瘤。
此后,多款靶向CD19或BCMA(用于多發性骨髓瘤)的CAR-T產品相繼獲批,標志著CAR-T療法正式從實驗室走向臨床應用,成為一個全新的腫瘤治療類別。
4. 深化發展與應對挑戰
當前的研究重點在于解決CAR-T技術的局限性并拓展其邊界:如應對實體瘤挑戰、提升安全性與可及性、拓展適應癥等。
02 ✦CAR-T技術的應用
1. 血液腫瘤
血液腫瘤主要分為白血病(Leukemia)、淋巴瘤(Lymphoma)和骨髓瘤(Myeloma)三大類。CAR-T細胞療法作為血液腫瘤的主要治療手段之一,也是第一個獲得美國食品和藥物管理局(FDA)批準用于臨床的基因療法,它通過調動患者自身的免疫系統來攻擊癌細胞可有效醫治復發/難治的B細胞淋巴瘤。有相關學者表示,治療B細胞淋巴瘤的最佳選擇是CAR-T,相較于其他的血液腫瘤治療手段其對于復發和難治性患者的預后具有一定優勢[3]。CAR-T細胞療法為某些復發或難治性血液系統惡性腫瘤患者提供了新的治療選擇和治愈希望。雖然CAR-T技術目前主要集中在B細胞惡性腫瘤,且面臨成本、毒副作用等挑戰,但持續的科研創新和技術優化(如新型靶點、通用型CAR-T、聯合策略等)正在不斷推動這一領域向前發展,未來有望惠及更多患者。
✦2.實體瘤
雖然CAR-T細胞療法在血液系統腫瘤治療中取得了較為顯著的成功,其在實體瘤治療中仍存在諸多障礙。值得注意的是CAR-T細胞療法在治療過程中會引起多種免疫相關不良反應,如嚴重的細胞因子釋放綜合征(CRS)[4]、免疫效應細胞相關神經毒性綜合征(immune effector cell-associated neurotoxicity syndrome,ICANS)[4]以及脫靶效應[5,6]。
針對上述挑戰,研究人員開發了多種創新策略來提升CAR-T在實體瘤中的效果:
2.1增強CAR-T細胞功能與持久性
“裝甲化”CAR-T:讓CAR-T細胞分泌免疫刺激因子(如IL-12)[7],以改變腫瘤微環境,增強自身功能并招募內源性免疫細胞。
聯合檢查點抑制劑:阻斷PD-1/PD-L1等抑制信號,防止CAR-T細胞耗竭[8]。
基因編輯技術:利用CRISPR/Cas9等技術敲除耗竭相關基因,延長CAR-T細胞存活時間[9]。
2.2改善腫瘤靶向性與安全性
雙靶點或多靶點CAR-T:同時靶向兩個或多個腫瘤抗原,采用“AND”邏輯門策略,只在腫瘤細胞同時表達兩個抗原時才激活,提高精準性,減少脫靶毒性[10]。
2.3克服免疫抑制微環境
表達趨化因子受體:讓CAR-T細胞表達特定的趨化因子受體(如CXCR2)[11],更好地被招募到腫瘤部位。
分泌降解酶:改造CAR-T細胞使其分泌肝素酶等物質,破壞腫瘤的物理屏障,促進浸潤[12]。
CAR-T細胞療法在實體瘤治療中雖然目前廣泛應用仍面臨挑戰,但通過各種創新策略不斷突破瓶頸,已在臨床試驗中展現出初步的療效和巨大的潛力。從改造CAR-T細胞本身到調控腫瘤微環境,再到革命性的體內制備和精準調控技術,這一領域正在飛速發展。
3. 自身免疫性疾病
CAR-T細胞療法在自身免疫性疾病(如系統性紅斑狼瘡[13]、多發性硬化[14]等)領域的應用,是近年來醫療技術的一個引人注目的進展。它通過基因工程改造患者自身的T細胞,使其能精準識別并清除導致疾病的免疫細胞,從而為一些傳統治療無效的患者帶來了新的希望。CAR-T療法對付自身免疫性疾病的思路,和它對付癌癥的思路有相似之處,但目標不同。其思路為首先從患者體內提取T細胞,在實驗室通過基因工程技術,給這些T細胞裝上能特異性識別B細胞表面抗原(如CD19、CD20等)的“導航裝置”——嵌合抗原受體(CAR)。
然后將這些改造好的CAR-T細胞在體外擴增到一定數量后,回輸到患者體內。最后CAR-T細胞會識別并清除那些攜帶特定抗原的B細胞。這些B細胞在很多自身免疫性疾病中異常活化,產生攻擊自身組織的自身抗體,是導致疾病發生和發展的重要“元兇”。清除掉這些“搗亂”的B細胞后,患者的免疫系統有機會“重啟”。隨著新的、正常的B細胞重新生成,免疫系統可能逐漸恢復平衡,從而達到長期緩解甚至“治愈”的效果[15]。
綜上所述,CAR-T技術作為基因工程驅動的細胞免疫治療手段,歷經概念萌芽、技術突破、臨床轉化到深化發展四階段,已從實驗室走向臨床。其核心是通過改造T細胞表面的CAR受體,實現對目標細胞的精準識別與清除,在醫療領域展現出多維度應用價值與顯著進展,同時也面臨待突破的挑戰。
在應用層面,該技術在血液腫瘤治療中成果突出,成為復發/難治性B細胞淋巴瘤等疾病的重要治療選擇,多款靶向CD19、BCMA的產品獲批,為患者帶來治愈希望;在實體瘤領域,雖受CRS、ICANS、脫靶效應及免疫抑制微環境等問題制約,但通過“裝甲化”CAR-T、雙靶點設計、聯合檢查點抑制劑等創新策略,已在臨床試驗中顯現潛力;在自身免疫性疾病治療中,其通過清除異常活化B細胞、助力免疫系統“重啟”的思路,也為傳統治療無效的患者提供了新方向。未來,隨著對安全性提升、適應癥拓展、可及性優化等方向的持續探索,CAR-T技術有望在更多疾病治療領域發揮更大作用。






