實現PROTAC前藥的靶向激活以提升治療特異性的方法
蛋白質降解技術(PROTAC)借助細胞內天然的泛素-蛋白酶體系統,實現目標蛋白的特異性降解,已成為新藥研發領域的重要策略。然而,傳統PROTAC分子在體內應用中仍面臨脫靶毒性、組織非特異性分布以及由過度活化引起的非預期蛋白降解等問題,嚴重限制其臨床轉化潛力。
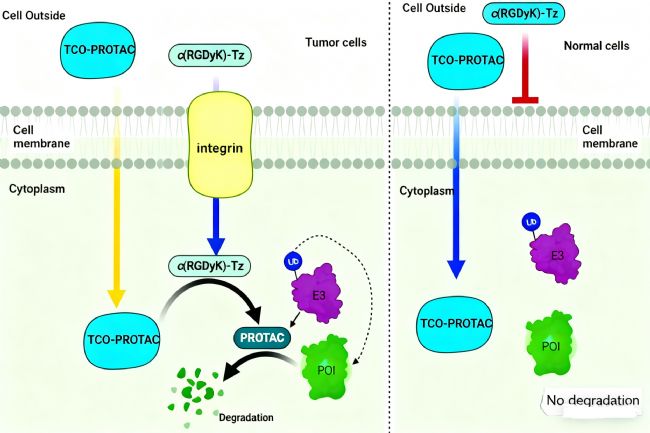
針對上述挑戰,發表于《Journal of the American Chemical Society》的一項研究提出了一種新型“生物正交前藥”策略。該研究設計了一類基于逆電子需求狄爾斯-阿爾德(IEDDA)反應的“點擊釋放型PROTAC前藥”(crPROTAC)。IEDDA反應因其優異的生物相容性、高速率常數和高正交性,特別適用于復雜生物環境中的靶向激活。
具體而言,研究團隊合成了兩種惰性前藥形式:TCO-ARV-771 和 TCO-DT2216。它們通過在PROTAC分子上引入反式環辛烯(TCO)保護基團,阻斷其與E3泛素連接酶及目標蛋白的正常結合,從而避免在非靶區域激活。當前藥與帶有疊氮苯并環辛炔(Tz)修飾的靶向配體——例如常用于腫瘤靶向的c(RGDyK)肽——相遇時,TCO與Tz發生IEDDA反應,原位釋放出具有活性的PROTAC分子,實現精準的靶點激活和蛋白降解。
該策略不僅在細胞模型中顯著降低了脫靶降解,還提高了PROTAC在異種移植瘤模型中的抗腫瘤效果與安全性,為開發基于生物標志物響應型的下一代PROTAC前藥提供了堅實理論基礎和技術路徑。
2. 如何實時監測E3連接酶活性并推進高通量藥物篩選?
E3泛素連接酶在調控蛋白質穩定性、信號轉導及細胞進程等方面發揮核心作用,其功能異常與腫瘤、神經退行性疾病等多種病理狀態密切相關。然而,由于缺乏實時、高效的酶活監測工具,E3連接酶的研究及其抑制劑開發一直面臨較大困難。
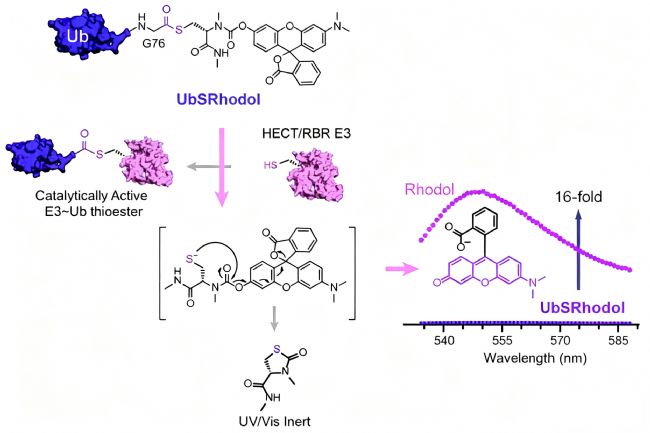
近期,《Angewandte Chemie International Edition》報道了一種開創性的遺傳編碼型前熒光探針——UbSRhodol,可用于實時、定量檢測依賴于半胱氨酸的E3連接酶活性。該探針巧妙地將泛素(Ub)的C端通過氨基甲酸酯鍵連接至掩蔽狀態的羅丹明熒光團,形成硫酯中間體模擬物。在自然狀態下,羅丹明以內酯形式存在,幾乎無熒光;而當E3連接酶催化半胱氨酸攻擊該硫酯鍵時,會發生轉硫酯化反應,生成E3~Ub共價復合物,并同時釋放出游離的羅丹明,恢復強烈熒光信號。
研究者驗證了UbSRhodol在多種E3酶(如Ube2T、Parkin等)活性檢測中的適用性,并展示了其應用于高通量抑制劑篩選平臺的潛力。不僅如此,該探針還可用于監測蛋白質-蛋白質相互作用引起的構象變化及酶動力學過程,為理解泛素信號網絡的動態調控提供了新型化學工具。
這一技術不僅推動E3連接酶功能研究的深度和廣度,也為針對E3的藥物發現和化學生物學研究提供了強有力的手段。
杭州斯達特 (www.starter-bio.com)志在為全球生命科學行業提供優質的抗體、蛋白、試劑盒等產品及研發服務。依托多個開發平臺:重組兔單抗、重組鼠單抗、快速鼠單抗、重組蛋白開發平臺(E.coli,CHO,HEK293,InsectCells),已正式通過歐盟98/79/EC認證、ISO9001認證、ISO13485。






