單細胞力譜技術助力量化細胞黏附力,突破耐藥菌困境
全球范圍內,每年因耐藥菌感染導致的死亡人數已超127萬,傳統抗生素在“超級細菌”面前逐漸失效,一項發表在《Journal of Controlled Release》的突破性研究為人類對抗耐藥菌帶來了全新希望。北京大學團隊提出的基于RGDS肽的新型抗菌策略,不僅精準阻斷了細菌感染路徑,更將抗生素用量減少75%,這一革命性發現的背后,多功能單細胞顯微操作FluidFM技術功不可沒,扮演了“關鍵證人”的角色,為科學家打開了觀察細菌與宿主細胞互動的微觀窗口。

高水平文獻助力神器:多功能單細胞顯微操作系統- FluidFM OMNIUM
細菌感染的“致命第一步”:看不見的粘附力
細菌要在人體內興風作浪,第一步就是“粘住”宿主細胞。就像病毒需要鑰匙打開細胞大門,細菌也會通過表面的粘附蛋白(如FnBPs),牢牢抓住人體細胞外基質中的纖連蛋白(Fn),這種“分子級握手”是感染的必經之路。而耐藥菌之所以難治,正是因為它們在進化中強化了這種粘附能力,讓抗生素難以滲透。過去,科學家雖知道“粘附”很重要,卻始終無法簡單方便、精準測量這種微觀力的大小——直到FluidFM技術的介入。
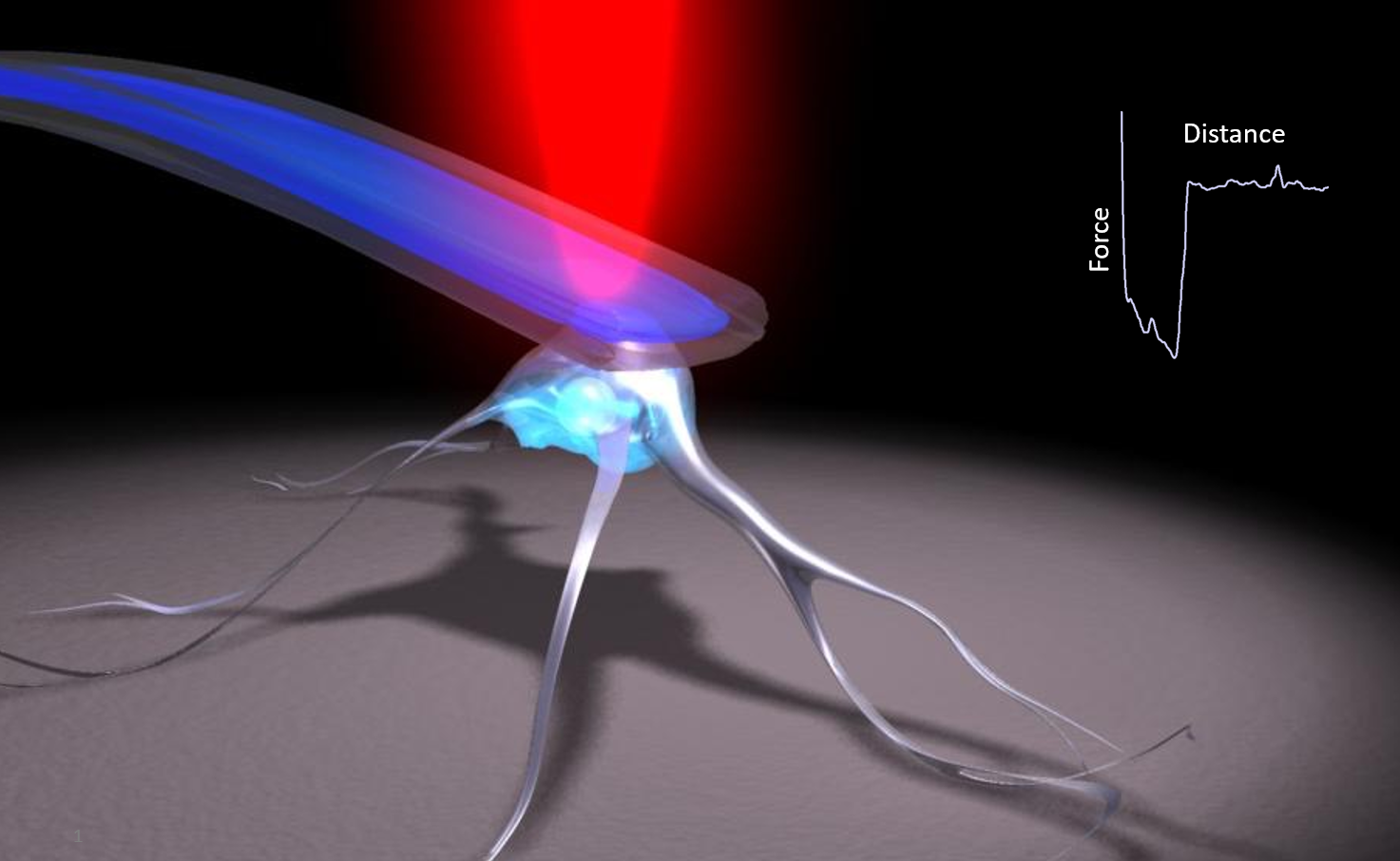
FluidFM:微觀世界的“力傳感器”,讓隱形力顯形
搭載了“納米天平”的機械手,能輕輕抓起單個細菌,并精準地靠近宿主細胞,記錄下兩者接觸、分離時的每一絲力量變化——這就是FluidFM技術的神奇之處。
- 精準捕獲: FluidFM探針可通過施加負壓,如同一只微型的“納米吸管”,精準地捕獲單個活體細菌(如金黃色葡萄球菌)。
- 可控接觸: 探針攜帶著單個細菌,精確控制地接近經過RGDS肽處理或未處理的宿主細胞(如人角質形成細胞HaCaT)。
- 實時測力: 當細菌與細胞表面接觸并短暫停留后,探針按設定程序回撤。在這個過程中,FluidFM實時、高精度地測量細菌與細胞表面分離所需的力——這就是細菌-宿主界面的黏附力(Adhesion Force)。
- 量化比較: 通過對比處理組和對照組測得的黏附力數據,FluidFM提供了直接、定量、單細胞水平的證據。
FluidFM揭示的關鍵發現:
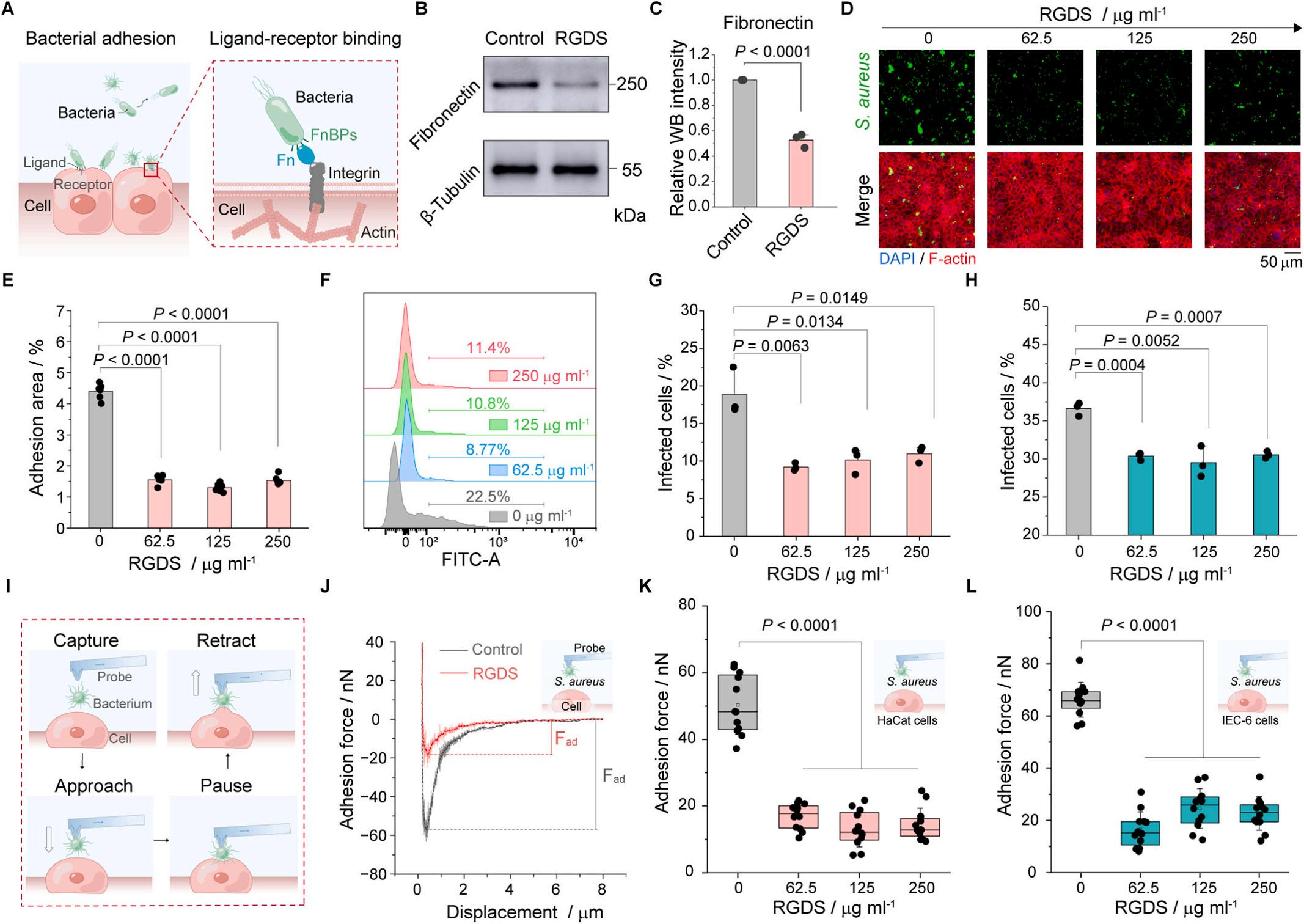
- 黏附力顯著降低: 實驗結果顯示,經RGDS肽預處理后,金黃色葡萄球菌與宿主細胞(HaCaT和IEC-6)之間的黏附力顯著降低(例如,HaCaT細胞上的黏附力從約50 nN降至約20 nN)。
- 劑量效應清晰呈現: FluidFM測量的數據清晰展現了RGDS肽的濃度效應,濃度越高,黏附力降低越明顯,解釋了為何RGDS肽能有效減少細菌在細胞表面的定植面積和感染細胞數量(通過共聚焦顯微鏡和流式細胞術驗證)。
- 機制直觀確認: 這些精確的力學測量數據,直觀而有力地證明了RGDS肽通過競爭性抑制Fn-FnBPs結合,成功削弱了細菌與宿主細胞界面的物理黏附力,從而阻止了細菌感染的第一步。
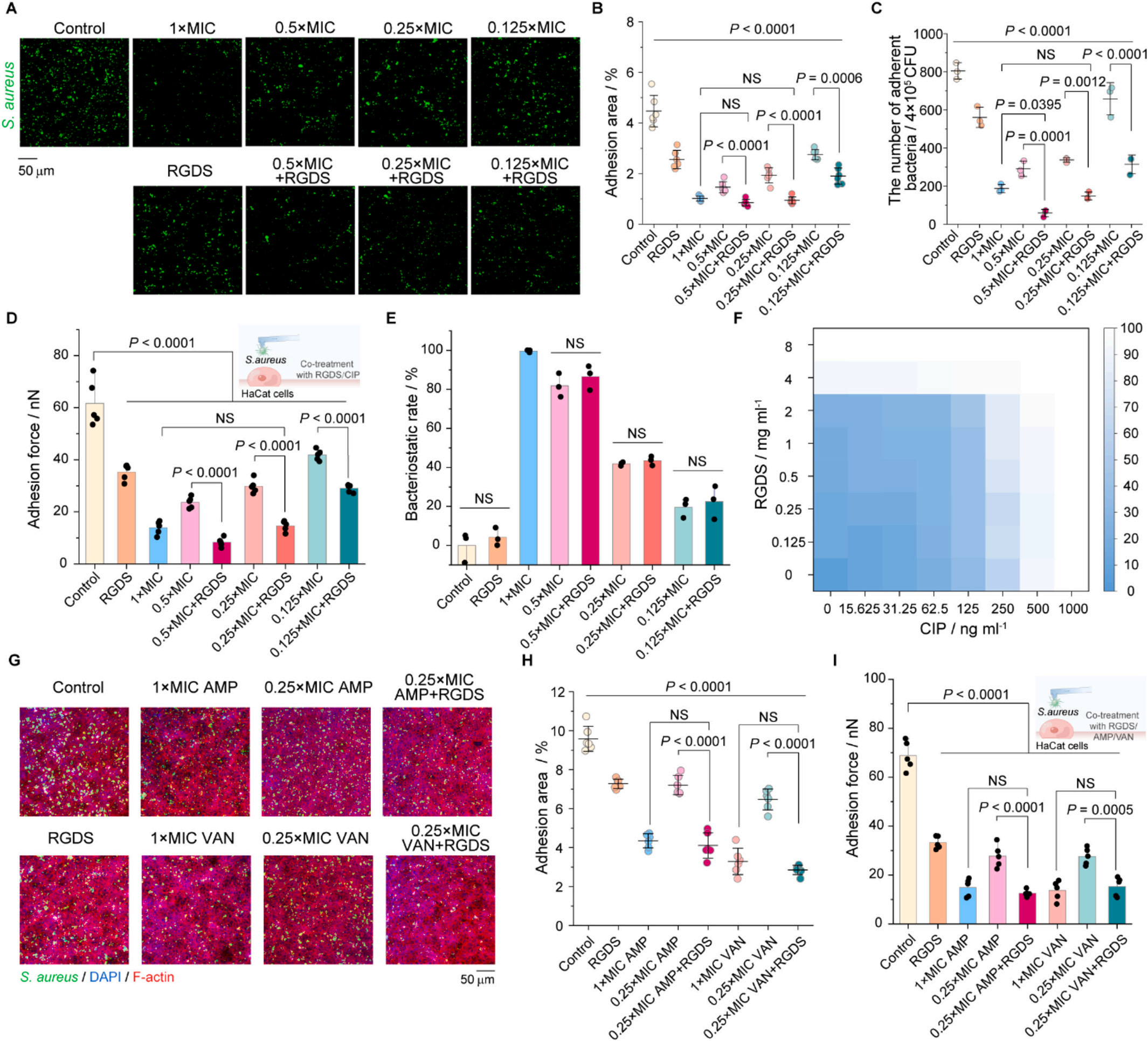
RGDS 肽與抗生素攜手合作,發揮出 “1 + 1 > 2” 的強大協同效應。研究人員驚喜地發現,當 RGDS 與環丙沙星、氨芐西林等常用抗生素聯用時,抗生素的劑量可以減少 75%,然而殺菌效果卻依然與標準劑量的抗生素相當,甚至在某些情況下更為出色。
下圖結果證實 RGDS 肽可通過抑制細菌 - 宿主界面粘附,增強低劑量抗生素的抗菌效果,且這種作用具有廣譜性,為減少抗生素用量(最高可降低 75%)提供了實驗依據。
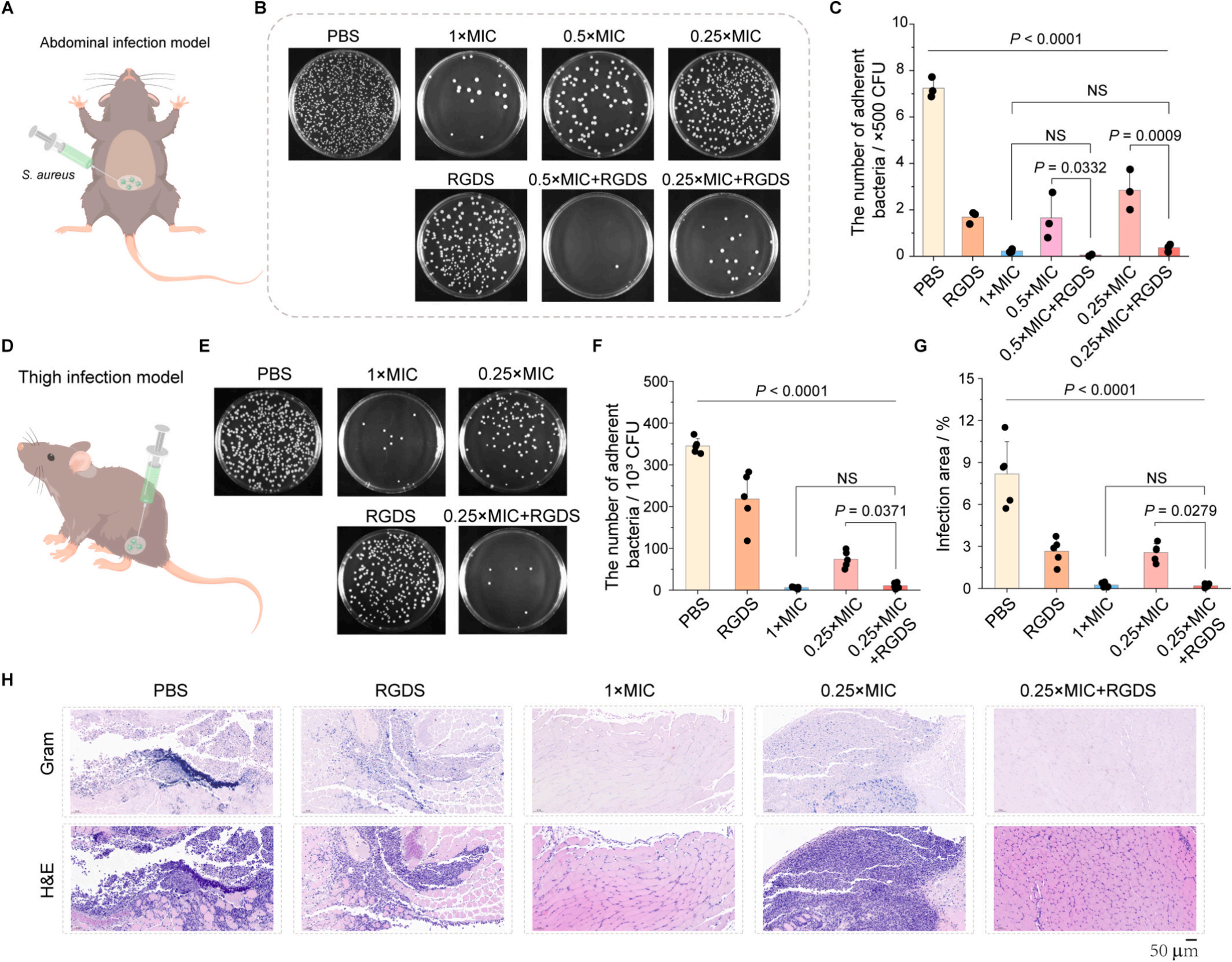
為了進一步驗證 RGDS 肽與低劑量抗生素聯合使用在實際應用中的療效,科學家在三種不同的動物模型中展開研究:
在小鼠腹腔感染模型中,研究人員將金黃色葡萄球菌注入小鼠腹腔,模擬細菌在人體內廣泛傳播引發全身性感染的場景。然后,分別給予小鼠不同的治療方案:一組使用標準劑量的抗生素,一組使用低劑量抗生素 + RGDS 肽的組合,另一組作為對照組不進行任何治療。經過一段時間的觀察和檢測,低劑量抗生素 + RGDS 肽組的細菌清除能力與標準劑量組相當,并且在對小鼠的心、肝、腎等重要器官進行檢測時發現,該組合治療對這些器官沒有造成任何明顯的損傷,充分證明了其安全性和有效性。
在小鼠大腿感染模型中,科研人員將細菌直接注射到小鼠大腿肌肉組織內,模擬局部感染的情況。通過對不同治療組小鼠大腿感染部位的觀察和分析,發現接受低劑量抗生素 + RGDS 肽聯合治療的小鼠,其感染范圍迅速縮小,炎癥反應明顯減輕。與標準劑量抗生素組相比,不僅治療效果毫不遜色,而且在減少抗生素用量的同時,降低了藥物對小鼠整體身體機能的潛在影響。
而在大鼠傷口感染模型中,研究人員在大鼠皮膚上制造傷口,并接種金黃色葡萄球菌,模擬日常生活中常見的傷口感染場景。結果顯示,低劑量抗生素 + RGDS 肽的聯合治療不僅能夠減少 70% 以上的細菌負荷,有效控制傷口處的細菌感染,還能顯著促進傷口的愈合。在實驗觀察的 14 天內,聯合治療組的傷口表皮厚度比傳統治療組增加了 30%,傷口愈合速度提升了近一倍。這一結果表明,該聯合治療方案不僅能夠對抗細菌感染,還對傷口的修復和愈合過程起到了積極的促進作用,為臨床治療傷口感染提供了新的有效策略。
這項由北京大學科研團隊完成的研究,從 “力生物學” 這一全新的角度,深入揭示了細菌 - 宿主黏附力與感染之間的緊密關聯,為人類對抗耐藥菌感染開辟了一條全新的道路。RGDS 肽作為一種創新的 “抗生素佐劑”,其潛力巨大,不僅能夠顯著降低抗生素的使用劑量,從而減少治療成本,還能有效減少細菌耐藥性的產生,為解決全球公共衛生危機帶來了新的希望。
未來,該策略有望擴展至更多耐藥菌類型,并通過水凝膠等載體實現局部精準遞送,為臨床治療皮膚感染、腹腔感染等提供新方案。正如研究團隊指出,這種 “宿主導向” 的力學生物學策略,可能成為應對全球耐藥菌危機的重要武器。
相關產品:
多功能單細胞顯微操作系統- FluidFM OMNIUM http://www.053xs.cc/show1equip.asp?equipid=4310883






