Cell子刊文章分享:CAR-T/CAR-NK/CAR-M對(duì)膠質(zhì)母細(xì)胞瘤療效對(duì)比
文章來(lái)源公眾號(hào):Chestnut Studying 作者:Chestnut
摘要
Chimeric antigen receptor (CAR) T cell therapy is a promising immunotherapy against cancer. Although there is a growing interest in other cell types, a comparison of CAR immune effector cells in challenging solid tumor contexts is lacking. Here, we compare mouse and human NKG2D-CAR-expressing T cells, natural killer (NK) cells, and macrophages against glioblastoma, the most aggressive primary brain tumor. In vitro we show that T cell cancer killing is CAR dependent, whereas intrinsic cytotoxicity overrules CAR dependence for NK cells, and CAR macrophages reduce glioma cells in co-culture assays. In orthotopic immunocompetent glioma mouse models, systemically administered CAR T cells demonstrate superior accumulation in the tumor, and each immune cell type induces distinct changes in the tumor microenvironment. An otherwise low therapeutic efficacy is significantly enhanced by co-expression of pro-inflammatory cytokines in all CAR immune effector cells, underscoring the necessity for multifaceted cell engineering strategies to overcome the immunosuppressive solid tumor microenvironment.
嵌合抗原受體(CAR)T細(xì)胞療法是治療癌癥極具前景的免疫療法。盡管其他細(xì)胞類(lèi)型的研究日益受到關(guān)注,但在復(fù)雜實(shí)體瘤環(huán)境中對(duì)CAR免疫效應(yīng)細(xì)胞的比較研究仍顯不足。本研究通過(guò)小鼠與人類(lèi)NKG2D-CAR表達(dá)T細(xì)胞、自然殺傷(NK)細(xì)胞及巨噬細(xì)胞對(duì)抗最具侵襲性的原發(fā)性腦腫瘤——膠質(zhì)母細(xì)胞瘤,進(jìn)行了系統(tǒng)比較。體外實(shí)驗(yàn)表明:T細(xì)胞的抗癌殺傷能力依賴于CAR,而NK細(xì)胞的固有細(xì)胞毒性則超越了CAR依賴性;在共培養(yǎng)實(shí)驗(yàn)中,CAR巨噬細(xì)胞可減少膠質(zhì)瘤細(xì)胞。在原位免疫功能正常膠質(zhì)瘤小鼠模型中,全身給藥的CAR T細(xì)胞在腫瘤組織中呈現(xiàn)顯著富集,且每種免疫細(xì)胞類(lèi)型均誘導(dǎo)腫瘤微環(huán)境發(fā)生獨(dú)特改變。通過(guò)在所有CAR免疫效應(yīng)細(xì)胞中共表達(dá)促炎性細(xì)胞因子,顯著提升了原本較低的治療效果,這強(qiáng)調(diào)了采用多維細(xì)胞工程策略克服免疫抑制性實(shí)體瘤微環(huán)境的必要性。
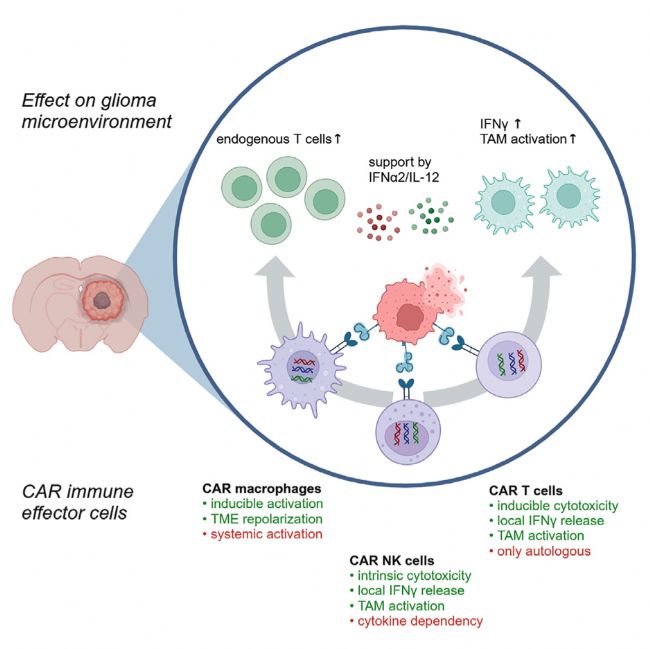
實(shí)驗(yàn)結(jié)果1
利用 mRNA 轉(zhuǎn)染技術(shù)可高效生成小鼠 CAR T 細(xì)胞、CAR NK 細(xì)胞和 CAR 巨噬細(xì)胞,并在體外顯示出不同的抗腫瘤活性
為了對(duì)小鼠 NKG2DCAR免疫效應(yīng)細(xì)胞在同種異體正位免疫功能設(shè)置中的功能進(jìn)行比較,關(guān)鍵是要生成足夠數(shù)量的小鼠免疫細(xì)胞,并確定一種可在每種細(xì)胞類(lèi)型中進(jìn)行可比CAR表達(dá)的系統(tǒng)。為了擴(kuò)增原代免疫細(xì)胞亞群,作者采用了最近建立的小鼠 T 細(xì)胞、NK 細(xì)胞和骨髓來(lái)源巨噬細(xì)胞擴(kuò)增方案,產(chǎn)生了足夠的細(xì)胞用于體內(nèi)收養(yǎng)性細(xì)胞轉(zhuǎn)移(圖 1A)。作者設(shè)計(jì)了表達(dá) NKG2DCAR和報(bào)告蛋白 RQR8 的 mRNA、逆轉(zhuǎn)錄病毒載體和睡美人(SB)系統(tǒng),它們通過(guò) Furin/T2A 裂解位點(diǎn)分離。在Naive NKG2D 陽(yáng)性的 T 細(xì)胞和NK 細(xì)胞中共同表達(dá) RQR8 以量化轉(zhuǎn)染和轉(zhuǎn)導(dǎo)效率。在所有細(xì)胞類(lèi)型中,只有 mRNA電穿孔顯示出高效和可比的轉(zhuǎn)染效率,且不妨礙細(xì)胞增殖。即使是慢病毒轉(zhuǎn)導(dǎo)也沒(méi)有提高 NK 細(xì)胞的轉(zhuǎn)染效率。
因此,mRNA轉(zhuǎn)染被證明是交叉比較不同CAR效應(yīng)細(xì)胞的最佳系統(tǒng)。為了確定 mRNA 的表達(dá)動(dòng)力學(xué),作者生成了編碼熒光蛋白 ZsGreen 的 mRNA。流式細(xì)胞術(shù)顯示,用 ZsGreen mRNA電穿孔對(duì)所有免疫細(xì)胞類(lèi)型的轉(zhuǎn)染效率幾乎達(dá)到 100%,而且在長(zhǎng)達(dá) 5 天的時(shí)間里,80% 以上的細(xì)胞都能檢測(cè)到 ZsGreen(圖 1B-1D)。ZsGreen 的表達(dá)用顯微鏡進(jìn)行了確認(rèn),從轉(zhuǎn)染后 2 小時(shí)開(kāi)始,根據(jù)細(xì)胞類(lèi)型的不同,在 7-12 小時(shí)后達(dá)到高峰(圖 1E)。除了編碼NKG2D-Furin/T2A-RQR8(CAR)的mRNA外,作者還設(shè)計(jì)了一個(gè)只編碼NKG2D腫瘤結(jié)合結(jié)構(gòu)域而不編碼細(xì)胞內(nèi)CD3ζ結(jié)構(gòu)域的功能對(duì)照(CARΔ(CD3ζ))(圖1F)。
為了在體外評(píng)估不同CAR 免疫效應(yīng)細(xì)胞的抗腫瘤潛力,作者用編碼 ZsGreen 的 mRNA 和編碼 CAR 或?qū)φ?CARΔ(CD3ζ) 的 mRNA 共同轉(zhuǎn)染它們,將它們與表達(dá) tdTomato- 的 GL-261 細(xì)胞共同培養(yǎng),并隨時(shí)間推移量化腫瘤匯合度。只有CAR T細(xì)胞能降低腫瘤細(xì)胞的匯合度,而與僅腫瘤細(xì)胞相比,CARΔ(CD3ζ) T細(xì)胞或模擬轉(zhuǎn)染的T細(xì)胞則沒(méi)有任何影響(圖1G)。NK 細(xì)胞介導(dǎo)的殺傷與CAR 表達(dá)無(wú)關(guān),并顯示出快速動(dòng)力學(xué),共培養(yǎng) 8 小時(shí)后膠質(zhì)瘤細(xì)胞幾乎被完全消滅(圖 1H )。表達(dá) CAR 后,NK 細(xì)胞的殺傷力沒(méi)有提高,這讓作者不禁要問(wèn),這是 CAR 設(shè)計(jì)的原因,還是體外培養(yǎng)條件過(guò)度激活了 NK 細(xì)胞。作者用靶向淋巴瘤細(xì)胞CD19的第二代CD28-CD3ζ CAR 轉(zhuǎn)染 NK 細(xì)胞,對(duì)這一問(wèn)題進(jìn)行了研究。CD19CAR 的表達(dá)對(duì)靶細(xì)胞殺傷力的改善不大,而對(duì) T 細(xì)胞的殺傷力則大幅提高。
這表明,其他 CAR 設(shè)計(jì)可能會(huì)增加 NK 細(xì)胞對(duì)膠質(zhì)瘤細(xì)胞的殺傷力。然而,在免疫抑制條件下,NKG2D表面表達(dá)下調(diào),模擬轉(zhuǎn)染的 NK 細(xì)胞抗腫瘤活性降低,但 NKG2D CAR 表達(dá)保留了 NK 細(xì)胞的功能,證明了其功能益處。這促使作者在研究中繼續(xù)使用 NKG2D CAR。當(dāng)表達(dá) CAR 或 CARΔ(CD3ζ)時(shí),巨噬細(xì)胞會(huì)隨著時(shí)間的推移降低腫瘤細(xì)胞的匯合度,但不會(huì)控制腫瘤生長(zhǎng)(圖 1I)。巨噬細(xì)胞上 CAR 的表達(dá)有利于CD86的表達(dá),CD86是一種已知的促炎巨噬細(xì)胞表型標(biāo)記。與三種不同的膠質(zhì)瘤細(xì)胞系和兩種腦轉(zhuǎn)移細(xì)胞系共培養(yǎng)的流式細(xì)胞術(shù)證實(shí)了這些發(fā)現(xiàn),并表明巨噬細(xì)胞減少了腫瘤細(xì)胞數(shù)量,但沒(méi)有使腫瘤細(xì)胞溶解(圖 1J、1 K)。主要組織相容性復(fù)合體I 類(lèi)(MHC I 類(lèi))分子而非 NKG2D 配體 Rae-1 的表面表達(dá)與 NK 細(xì)胞介導(dǎo)的細(xì)胞系殺傷成反比。
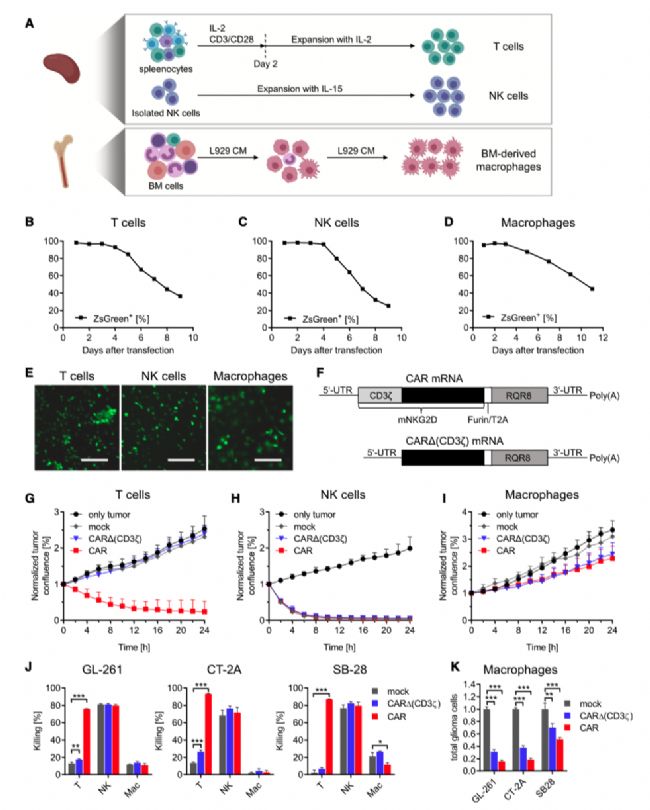
實(shí)驗(yàn)結(jié)果2
CAR T 細(xì)胞在體內(nèi)腫瘤中的蓄積能力更強(qiáng)
為了評(píng)估全身給藥的 CAR T 細(xì)胞、CAR NK 細(xì)胞和 CAR 巨噬細(xì)胞在正位、合成實(shí)體瘤環(huán)境中的腫瘤歸巢特性,作者使用體外三維顯微鏡觀察了 GL-261 膠質(zhì)瘤小鼠腦內(nèi)靜脈給藥熒光標(biāo)記的 NKG2DCAR 免疫效應(yīng)細(xì)胞的數(shù)量和空間分布。所有類(lèi)型的被收養(yǎng)轉(zhuǎn)移的CAR免疫效應(yīng)細(xì)胞主要位于高度血管化的腫瘤腫塊內(nèi),而不是周?chē)哪X實(shí)質(zhì)內(nèi)(圖2A)。
與隨機(jī)模擬相比,對(duì)累積的 CAR 免疫效應(yīng)細(xì)胞分布進(jìn)行的詳細(xì)空間分析表明,CAR T 細(xì)胞(而非 CAR NK 細(xì)胞和 CAR 巨噬細(xì)胞)傾向于靠近血管結(jié)構(gòu)(圖 2B-2D)。每種處理后,每個(gè)腫瘤的相對(duì)血管體積相當(dāng)。值得注意的是,CAR T 細(xì)胞和 NK 細(xì)胞均勻地分布在腫瘤的所有區(qū)域,而 CAR 巨噬細(xì)胞則聚集成團(tuán),腫瘤外圍區(qū)域幾乎沒(méi)有(圖 2E)。在不同的效應(yīng)細(xì)胞中,CAR T 細(xì)胞的數(shù)量比 CAR NK 細(xì)胞或 CAR 巨噬細(xì)胞多(圖 2F)。為了證實(shí)三維顯微鏡分析,作者將轉(zhuǎn)染了 NKG2D CAR mRNA 的 CD45.1+ 免疫細(xì)胞靜脈注射到 CD45.2+患膠質(zhì)瘤的小鼠體內(nèi),并使用體外流式細(xì)胞儀量化了腫瘤浸潤(rùn)細(xì)胞的數(shù)量。
結(jié)果證實(shí),CAR T 細(xì)胞比 CAR NK 細(xì)胞或 CAR 巨噬細(xì)胞數(shù)量更多(圖 2G)。由于細(xì)胞數(shù)量較少,作者還研究了局部瘤內(nèi)注射作為一種替代給藥途徑。與全身注射相比,這大大增加了所有 CAR 免疫效應(yīng)細(xì)胞的瘤內(nèi)數(shù)量。瘤內(nèi)注射兩天后,CAR T 細(xì)胞和 CAR 巨噬細(xì)胞在腫瘤內(nèi)的存活率很高,而 CAR NK 細(xì)胞的存活率較低(圖 2H)。總之,這些結(jié)果表明,CAR T 細(xì)胞在靜脈給藥后具有最佳的腫瘤歸巢潛能,但一般來(lái)說(shuō),局部給藥途徑更適合將足夠的 CAR 效應(yīng)細(xì)胞送到腫瘤部位。
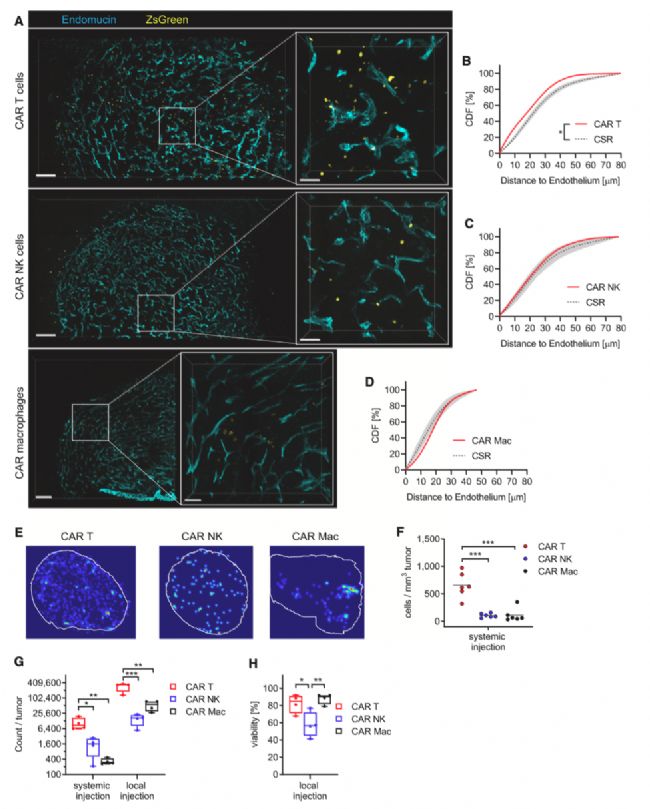
實(shí)驗(yàn)結(jié)果3
scRNA-seq鑒定腫瘤微環(huán)境中CAR T細(xì)胞、CAR NK細(xì)胞和CAR巨噬細(xì)胞療法的不同免疫特征
為了描述不同CAR效應(yīng)細(xì)胞對(duì)腫瘤微環(huán)境的影響,作者在GL-261膠質(zhì)瘤小鼠體內(nèi)注射了CD45.1+ CAR T細(xì)胞、CAR NK細(xì)胞或CAR巨噬細(xì)胞,并在治療5天后使用單細(xì)胞RNA測(cè)序(scRNA-seq)分析了CD45.2+腫瘤浸潤(rùn)免疫細(xì)胞的分布情況。作者評(píng)估了通過(guò)質(zhì)量控制的每個(gè)樣本至少n= 6,499 個(gè)白細(xì)胞的單細(xì)胞 RNA圖譜。作者使用均勻流形近似和投影(UMAP)技術(shù)對(duì)結(jié)果中的n= 33,345 個(gè)細(xì)胞進(jìn)行了可視化處理。
膠質(zhì)母細(xì)胞瘤中腫瘤浸潤(rùn)免疫細(xì)胞的分布包括不同的髓系細(xì)胞群,包括單核細(xì)胞、一大群腫瘤相關(guān)巨噬細(xì)胞(TAMs)和小膠質(zhì)細(xì)胞(圖 3A)。此外,作者還檢測(cè)到粒細(xì)胞、樹(shù)突狀細(xì)胞、NK 細(xì)胞、T 細(xì)胞和 B 細(xì)胞。不同的 CAR 免疫效應(yīng)細(xì)胞導(dǎo)致了腫瘤免疫微環(huán)境的個(gè)體極化。CAR T細(xì)胞治療與更多的TAMs和粒細(xì)胞明顯相關(guān)。CAR NK細(xì)胞和CAR巨噬細(xì)胞的處理分別與更多的過(guò)渡性單核細(xì)胞或TAMs和NK細(xì)胞有關(guān)(圖3B和3C)。
T 細(xì)胞集群以及由單核細(xì)胞和 TAMs 組成的髓系細(xì)胞集群的基因本體富集分析進(jìn)一步證實(shí)了這些不同的效應(yīng)(圖 3D 和 3E)。CAR T細(xì)胞處理導(dǎo)致T細(xì)胞集群向細(xì)胞毒性狀態(tài)轉(zhuǎn)變,而對(duì)髓系細(xì)胞群的影響主要體現(xiàn)在代謝方面,并以糖酵解轉(zhuǎn)錄程序的變化為特征。CAR NK細(xì)胞和CAR巨噬細(xì)胞誘導(dǎo)了與抗病毒免疫防御相關(guān)的本體術(shù)語(yǔ)(圖3D)。CAR NK細(xì)胞和CAR巨噬細(xì)胞處理后,髓系細(xì)胞也出現(xiàn)了向抗病毒免疫反應(yīng)的轉(zhuǎn)變(圖3E)。然而,對(duì)于 CAR 巨噬細(xì)胞來(lái)說(shuō),它似乎不是細(xì)胞自主的,而是通過(guò) NK 細(xì)胞驅(qū)動(dòng)的。
接下來(lái),作者進(jìn)一步分析了CAR免疫效應(yīng)細(xì)胞處理對(duì)髓系細(xì)胞的不同影響,髓系細(xì)胞是膠質(zhì)瘤腫瘤微環(huán)境中最大的免疫細(xì)胞亞群。為此,作者以經(jīng)典的Ly6chi單核細(xì)胞群作為最早的時(shí)間點(diǎn)進(jìn)行了偽時(shí)間分析(圖 3F)。在已確定的轉(zhuǎn)錄連續(xù)體中,過(guò)渡性單核細(xì)胞之后是小膠質(zhì)細(xì)胞相關(guān)轉(zhuǎn)錄程序表達(dá)量不斷增加的 TAMs。對(duì)六個(gè)新興基因模塊中明顯富集基因的分析表明,早期 “偽 ”時(shí)間點(diǎn)與傷口愈合和抗病毒反應(yīng)術(shù)語(yǔ)相關(guān)。中期時(shí)間點(diǎn)的特征是抗原處理相關(guān)基因和向巨噬細(xì)胞遷移過(guò)渡;晚期時(shí)間點(diǎn)則顯示脂質(zhì)代謝狀態(tài)(圖 3G)。各階段的豐度分析表明,對(duì)照組富集了中期和晚期階段相關(guān)基因表達(dá)模塊(圖 3H)。
同樣,CAR T 細(xì)胞治療與中期和晚期相關(guān)模塊 2 和 4 相關(guān),而 CAR NK 細(xì)胞治療與早期和中期相關(guān)模塊 1、3 和 6 顯著相關(guān)。CAR 巨噬細(xì)胞治療顯示出模糊的特征,富集于早期階段模塊 3(與 CAR NK 細(xì)胞一起)和晚期階段模塊 4(與 CAR T 細(xì)胞一起)。總之,CAR T 細(xì)胞處理與髓系細(xì)胞的代謝重編程和晚期 TAMs 的出現(xiàn)有關(guān),而 CAR NK 細(xì)胞處理則增加了過(guò)渡性單核細(xì)胞的豐度以及 T 細(xì)胞和髓系細(xì)胞的抗病毒反應(yīng)。CAR 巨噬細(xì)胞處理顯示了兩者的特征。
實(shí)驗(yàn)結(jié)果4
通過(guò)同時(shí)表達(dá)促炎細(xì)胞因子,可將 CAR 免疫效應(yīng)細(xì)胞治療的有限生存益處轉(zhuǎn)化為治療效果
接下來(lái),作者比較了不同 CAR 免疫效應(yīng)細(xì)胞在體內(nèi)的治療潛力。為此,作者使用了完全免疫功能健全的合成膠質(zhì)瘤小鼠模型,并在腫瘤內(nèi)給予 CAR T 細(xì)胞、CAR NK 細(xì)胞或 CAR 巨噬細(xì)胞(圖 4A)。用模擬轉(zhuǎn)染的T細(xì)胞、NK細(xì)胞或巨噬細(xì)胞治療對(duì)小鼠的總體存活率影響有限,但沒(méi)有長(zhǎng)期存活的小鼠(圖4B和4 C)。在所有 CAR 免疫效應(yīng)細(xì)胞中,CAR T 細(xì)胞的表現(xiàn)最好。
然而,總體抗腫瘤活性仍然有限,GL-261 腫瘤小鼠只有一只長(zhǎng)期存活,SB-28 腫瘤小鼠的中位存活率也只有提高,沒(méi)有長(zhǎng)期存活(圖 4D 和 4E)。CAR T 細(xì)胞治療還伴隨著治療后兩天腫瘤內(nèi)最強(qiáng)的干擾素(IFN)γ 釋放,而血漿中的 IFNγ 濃度仍低于檢測(cè)限(圖 4F)。邊際存活效應(yīng)與治療過(guò)程中 CAR細(xì)胞存活率的下降無(wú)關(guān)。術(shù)后存活的 CAR 免疫效應(yīng)細(xì)胞保持了很高的存活率,并保留了體外抗腫瘤活性。每種 CAR 免疫效應(yīng)細(xì)胞的各自優(yōu)勢(shì)促使人們探索它們的聯(lián)合用藥是否能在體內(nèi)產(chǎn)生協(xié)同效應(yīng)。然而,事實(shí)并非如此,CAR T細(xì)胞、CAR NK細(xì)胞和CAR巨噬細(xì)胞的聯(lián)合應(yīng)用提高了小鼠的中位總存活率,但并沒(méi)有提高長(zhǎng)期存活小鼠的數(shù)量(圖4G)。為了克服腫瘤微環(huán)境的免疫抑制作用,作者最近研究并證明,多功能 CAR T 細(xì)胞在轉(zhuǎn)染了編碼細(xì)胞因子 IL-12 和 IFNα2 的 mRNA 后,也能治愈神經(jīng)膠質(zhì)瘤小鼠。
事實(shí)上,用每種多功能 CAR 免疫效應(yīng)細(xì)胞治療都能提高小鼠的總體存活率,其中多功能 CAR NK 細(xì)胞表現(xiàn)最佳,能治愈 6 只神經(jīng)膠質(zhì)瘤小鼠中的 4 只(圖 5A)。即使用只轉(zhuǎn)染了編碼細(xì)胞因子而沒(méi)有轉(zhuǎn)染 CAR 的 mRNA 的 T 細(xì)胞和 NK 細(xì)胞進(jìn)行治療,也能提高患膠質(zhì)瘤小鼠的總體存活率。在攜帶侵襲性乳腺癌轉(zhuǎn)移細(xì)胞株 E0771-BrM 的小鼠中,CAR 免疫效應(yīng)細(xì)胞中共同表達(dá)的細(xì)胞因子也能提高生存率(圖 5B)。在神經(jīng)膠質(zhì)瘤小鼠中,細(xì)胞因子共表達(dá)顯示注射五天后 CAR T 細(xì)胞和 CAR NK 細(xì)胞數(shù)量增加。這與瘤內(nèi) IFNγ 的長(zhǎng)期釋放和腫瘤相關(guān)髓系細(xì)胞的CD86上調(diào)有關(guān)(圖 5C、5 D)。同樣,CAR 巨噬細(xì)胞上的 CD86 表達(dá)也因細(xì)胞因子共表達(dá)和招募到腫瘤的 CD8α T 細(xì)胞數(shù)量增加而增加。
總體而言,治療耐受性良好,作為毒性間接指標(biāo)的體重在多功能 CAR 和細(xì)胞因子表達(dá)免疫細(xì)胞治療過(guò)程中保持穩(wěn)定。血值評(píng)估顯示肌酐值不變,但天門(mén)冬氨酸氨基轉(zhuǎn)移酶(AST)、丙氨酸轉(zhuǎn)氨酶(ALT)和多功能 CAR 巨噬細(xì)胞的 IFNγ 值升高(圖 5F)。然而,組織學(xué)評(píng)估顯示,安樂(lè)死小鼠的肝臟和脾臟內(nèi)未出現(xiàn)與多功能 CAR 細(xì)胞給藥相關(guān)的明顯形態(tài)學(xué)變化。
實(shí)驗(yàn)結(jié)果5
只有 CAR 淋巴細(xì)胞在體外和體內(nèi)對(duì)人類(lèi)膠質(zhì)母細(xì)胞瘤具有活性
最后,作者的目標(biāo)是確定在小鼠 CAR 效應(yīng)細(xì)胞上觀察到的發(fā)現(xiàn)是否可以轉(zhuǎn)化為人類(lèi) CAR 免疫效應(yīng)細(xì)胞。為此,作者制定了原代人 T 細(xì)胞、NK 細(xì)胞和巨噬細(xì)胞的擴(kuò)增方案。在確認(rèn)所有細(xì)胞類(lèi)型的 mRNA 轉(zhuǎn)染效率高達(dá) 94% 以上后,作者使用粘附的人膠質(zhì)瘤細(xì)胞系 LN-229 和球形膠質(zhì)瘤啟動(dòng)細(xì)胞系 ZH-161 進(jìn)行了 24 小時(shí)殺傷試驗(yàn)。與小鼠類(lèi)似,表達(dá) CARΔ(CD3ζ)的人 CAR T 細(xì)胞(而非對(duì)照組)能有效地裂解這兩種細(xì)胞系。
與此相反,只有在免疫抑制條件下表達(dá) CAR 才能提高 NK 細(xì)胞的殺傷力,而免疫抑制條件會(huì)像小鼠一樣下調(diào) NKG2D 的表面表達(dá)(圖 6A)。與小鼠細(xì)胞相反,人類(lèi) NK 細(xì)胞介導(dǎo)的殺傷力與腫瘤細(xì)胞表面 MHC I 類(lèi)分子的表達(dá)無(wú)關(guān),但與 NKG2D 配體 MHC I 類(lèi)多肽相關(guān)序列 A/B(MICA/B)相關(guān)。使用巨噬細(xì)胞集落刺激因子(M-CSF)從CD14+單核細(xì)胞分化出巨噬細(xì)胞,或使用促炎細(xì)胞因子粒細(xì)胞-巨噬細(xì)胞集落刺激因子(GM-CSF)和 IFNγ 極化巨噬細(xì)胞。M-CSF和GM-CSF/IFNγ都分化了CAR巨噬細(xì)胞,使膠質(zhì)瘤細(xì)胞減少達(dá)30%,而對(duì)照組表達(dá)CARΔ(CD3ζ)的巨噬細(xì)胞減少膠質(zhì)瘤細(xì)胞數(shù)量的程度較小(圖6B)。
接下來(lái),作者用編碼 ZsGreen 的 mRNA 和編碼人 NKG2D CAR、人細(xì)胞因子(IL-12 和 IFNα2)或 CAR 和細(xì)胞因子的 mRNA 共同轉(zhuǎn)染人免疫細(xì)胞,并將它們與膠質(zhì)母細(xì)胞瘤患者樣本進(jìn)行體外共同培養(yǎng)。24 小時(shí)后,作者使用基于圖像的單細(xì)胞平臺(tái)--藥理學(xué)鏡分析了膠質(zhì)母細(xì)胞瘤細(xì)胞的數(shù)量。總體而言,與 PBS 對(duì)照組相比,與人類(lèi)淋巴細(xì)胞共同培養(yǎng)的腫瘤細(xì)胞數(shù)量明顯減少(圖 6C)。此外,作者還觀察到 CAR T 細(xì)胞和共表達(dá)細(xì)胞因子的 CAR T 細(xì)胞的抗膠質(zhì)母細(xì)胞瘤活性有所提高,這表現(xiàn)在腫瘤細(xì)胞分?jǐn)?shù)降低和 T 細(xì)胞出現(xiàn)集群(圖 6C 和 6D)。此外,共同表達(dá) CAR 和細(xì)胞因子還能顯著提高 NK 細(xì)胞對(duì)腫瘤細(xì)胞的殺傷力。這些結(jié)果表明,在殺死膠質(zhì)母細(xì)胞瘤細(xì)胞方面,人 CAR 淋巴細(xì)胞優(yōu)于人 CAR 巨噬細(xì)胞,而且如果 CAR 淋巴細(xì)胞轉(zhuǎn)染后同時(shí)表達(dá) IL-12 和 IFNα2,還能帶來(lái)抗腫瘤益處。
摘要
Chimeric antigen receptor (CAR) T cell therapy is a promising immunotherapy against cancer. Although there is a growing interest in other cell types, a comparison of CAR immune effector cells in challenging solid tumor contexts is lacking. Here, we compare mouse and human NKG2D-CAR-expressing T cells, natural killer (NK) cells, and macrophages against glioblastoma, the most aggressive primary brain tumor. In vitro we show that T cell cancer killing is CAR dependent, whereas intrinsic cytotoxicity overrules CAR dependence for NK cells, and CAR macrophages reduce glioma cells in co-culture assays. In orthotopic immunocompetent glioma mouse models, systemically administered CAR T cells demonstrate superior accumulation in the tumor, and each immune cell type induces distinct changes in the tumor microenvironment. An otherwise low therapeutic efficacy is significantly enhanced by co-expression of pro-inflammatory cytokines in all CAR immune effector cells, underscoring the necessity for multifaceted cell engineering strategies to overcome the immunosuppressive solid tumor microenvironment.
嵌合抗原受體(CAR)T細(xì)胞療法是治療癌癥極具前景的免疫療法。盡管其他細(xì)胞類(lèi)型的研究日益受到關(guān)注,但在復(fù)雜實(shí)體瘤環(huán)境中對(duì)CAR免疫效應(yīng)細(xì)胞的比較研究仍顯不足。本研究通過(guò)小鼠與人類(lèi)NKG2D-CAR表達(dá)T細(xì)胞、自然殺傷(NK)細(xì)胞及巨噬細(xì)胞對(duì)抗最具侵襲性的原發(fā)性腦腫瘤——膠質(zhì)母細(xì)胞瘤,進(jìn)行了系統(tǒng)比較。體外實(shí)驗(yàn)表明:T細(xì)胞的抗癌殺傷能力依賴于CAR,而NK細(xì)胞的固有細(xì)胞毒性則超越了CAR依賴性;在共培養(yǎng)實(shí)驗(yàn)中,CAR巨噬細(xì)胞可減少膠質(zhì)瘤細(xì)胞。在原位免疫功能正常膠質(zhì)瘤小鼠模型中,全身給藥的CAR T細(xì)胞在腫瘤組織中呈現(xiàn)顯著富集,且每種免疫細(xì)胞類(lèi)型均誘導(dǎo)腫瘤微環(huán)境發(fā)生獨(dú)特改變。通過(guò)在所有CAR免疫效應(yīng)細(xì)胞中共表達(dá)促炎性細(xì)胞因子,顯著提升了原本較低的治療效果,這強(qiáng)調(diào)了采用多維細(xì)胞工程策略克服免疫抑制性實(shí)體瘤微環(huán)境的必要性。

實(shí)驗(yàn)結(jié)果1
利用 mRNA 轉(zhuǎn)染技術(shù)可高效生成小鼠 CAR T 細(xì)胞、CAR NK 細(xì)胞和 CAR 巨噬細(xì)胞,并在體外顯示出不同的抗腫瘤活性
為了對(duì)小鼠 NKG2DCAR免疫效應(yīng)細(xì)胞在同種異體正位免疫功能設(shè)置中的功能進(jìn)行比較,關(guān)鍵是要生成足夠數(shù)量的小鼠免疫細(xì)胞,并確定一種可在每種細(xì)胞類(lèi)型中進(jìn)行可比CAR表達(dá)的系統(tǒng)。為了擴(kuò)增原代免疫細(xì)胞亞群,作者采用了最近建立的小鼠 T 細(xì)胞、NK 細(xì)胞和骨髓來(lái)源巨噬細(xì)胞擴(kuò)增方案,產(chǎn)生了足夠的細(xì)胞用于體內(nèi)收養(yǎng)性細(xì)胞轉(zhuǎn)移(圖 1A)。作者設(shè)計(jì)了表達(dá) NKG2DCAR和報(bào)告蛋白 RQR8 的 mRNA、逆轉(zhuǎn)錄病毒載體和睡美人(SB)系統(tǒng),它們通過(guò) Furin/T2A 裂解位點(diǎn)分離。在Naive NKG2D 陽(yáng)性的 T 細(xì)胞和NK 細(xì)胞中共同表達(dá) RQR8 以量化轉(zhuǎn)染和轉(zhuǎn)導(dǎo)效率。在所有細(xì)胞類(lèi)型中,只有 mRNA電穿孔顯示出高效和可比的轉(zhuǎn)染效率,且不妨礙細(xì)胞增殖。即使是慢病毒轉(zhuǎn)導(dǎo)也沒(méi)有提高 NK 細(xì)胞的轉(zhuǎn)染效率。
因此,mRNA轉(zhuǎn)染被證明是交叉比較不同CAR效應(yīng)細(xì)胞的最佳系統(tǒng)。為了確定 mRNA 的表達(dá)動(dòng)力學(xué),作者生成了編碼熒光蛋白 ZsGreen 的 mRNA。流式細(xì)胞術(shù)顯示,用 ZsGreen mRNA電穿孔對(duì)所有免疫細(xì)胞類(lèi)型的轉(zhuǎn)染效率幾乎達(dá)到 100%,而且在長(zhǎng)達(dá) 5 天的時(shí)間里,80% 以上的細(xì)胞都能檢測(cè)到 ZsGreen(圖 1B-1D)。ZsGreen 的表達(dá)用顯微鏡進(jìn)行了確認(rèn),從轉(zhuǎn)染后 2 小時(shí)開(kāi)始,根據(jù)細(xì)胞類(lèi)型的不同,在 7-12 小時(shí)后達(dá)到高峰(圖 1E)。除了編碼NKG2D-Furin/T2A-RQR8(CAR)的mRNA外,作者還設(shè)計(jì)了一個(gè)只編碼NKG2D腫瘤結(jié)合結(jié)構(gòu)域而不編碼細(xì)胞內(nèi)CD3ζ結(jié)構(gòu)域的功能對(duì)照(CARΔ(CD3ζ))(圖1F)。
為了在體外評(píng)估不同CAR 免疫效應(yīng)細(xì)胞的抗腫瘤潛力,作者用編碼 ZsGreen 的 mRNA 和編碼 CAR 或?qū)φ?CARΔ(CD3ζ) 的 mRNA 共同轉(zhuǎn)染它們,將它們與表達(dá) tdTomato- 的 GL-261 細(xì)胞共同培養(yǎng),并隨時(shí)間推移量化腫瘤匯合度。只有CAR T細(xì)胞能降低腫瘤細(xì)胞的匯合度,而與僅腫瘤細(xì)胞相比,CARΔ(CD3ζ) T細(xì)胞或模擬轉(zhuǎn)染的T細(xì)胞則沒(méi)有任何影響(圖1G)。NK 細(xì)胞介導(dǎo)的殺傷與CAR 表達(dá)無(wú)關(guān),并顯示出快速動(dòng)力學(xué),共培養(yǎng) 8 小時(shí)后膠質(zhì)瘤細(xì)胞幾乎被完全消滅(圖 1H )。表達(dá) CAR 后,NK 細(xì)胞的殺傷力沒(méi)有提高,這讓作者不禁要問(wèn),這是 CAR 設(shè)計(jì)的原因,還是體外培養(yǎng)條件過(guò)度激活了 NK 細(xì)胞。作者用靶向淋巴瘤細(xì)胞CD19的第二代CD28-CD3ζ CAR 轉(zhuǎn)染 NK 細(xì)胞,對(duì)這一問(wèn)題進(jìn)行了研究。CD19CAR 的表達(dá)對(duì)靶細(xì)胞殺傷力的改善不大,而對(duì) T 細(xì)胞的殺傷力則大幅提高。
這表明,其他 CAR 設(shè)計(jì)可能會(huì)增加 NK 細(xì)胞對(duì)膠質(zhì)瘤細(xì)胞的殺傷力。然而,在免疫抑制條件下,NKG2D表面表達(dá)下調(diào),模擬轉(zhuǎn)染的 NK 細(xì)胞抗腫瘤活性降低,但 NKG2D CAR 表達(dá)保留了 NK 細(xì)胞的功能,證明了其功能益處。這促使作者在研究中繼續(xù)使用 NKG2D CAR。當(dāng)表達(dá) CAR 或 CARΔ(CD3ζ)時(shí),巨噬細(xì)胞會(huì)隨著時(shí)間的推移降低腫瘤細(xì)胞的匯合度,但不會(huì)控制腫瘤生長(zhǎng)(圖 1I)。巨噬細(xì)胞上 CAR 的表達(dá)有利于CD86的表達(dá),CD86是一種已知的促炎巨噬細(xì)胞表型標(biāo)記。與三種不同的膠質(zhì)瘤細(xì)胞系和兩種腦轉(zhuǎn)移細(xì)胞系共培養(yǎng)的流式細(xì)胞術(shù)證實(shí)了這些發(fā)現(xiàn),并表明巨噬細(xì)胞減少了腫瘤細(xì)胞數(shù)量,但沒(méi)有使腫瘤細(xì)胞溶解(圖 1J、1 K)。主要組織相容性復(fù)合體I 類(lèi)(MHC I 類(lèi))分子而非 NKG2D 配體 Rae-1 的表面表達(dá)與 NK 細(xì)胞介導(dǎo)的細(xì)胞系殺傷成反比。

實(shí)驗(yàn)結(jié)果2
CAR T 細(xì)胞在體內(nèi)腫瘤中的蓄積能力更強(qiáng)
為了評(píng)估全身給藥的 CAR T 細(xì)胞、CAR NK 細(xì)胞和 CAR 巨噬細(xì)胞在正位、合成實(shí)體瘤環(huán)境中的腫瘤歸巢特性,作者使用體外三維顯微鏡觀察了 GL-261 膠質(zhì)瘤小鼠腦內(nèi)靜脈給藥熒光標(biāo)記的 NKG2DCAR 免疫效應(yīng)細(xì)胞的數(shù)量和空間分布。所有類(lèi)型的被收養(yǎng)轉(zhuǎn)移的CAR免疫效應(yīng)細(xì)胞主要位于高度血管化的腫瘤腫塊內(nèi),而不是周?chē)哪X實(shí)質(zhì)內(nèi)(圖2A)。
與隨機(jī)模擬相比,對(duì)累積的 CAR 免疫效應(yīng)細(xì)胞分布進(jìn)行的詳細(xì)空間分析表明,CAR T 細(xì)胞(而非 CAR NK 細(xì)胞和 CAR 巨噬細(xì)胞)傾向于靠近血管結(jié)構(gòu)(圖 2B-2D)。每種處理后,每個(gè)腫瘤的相對(duì)血管體積相當(dāng)。值得注意的是,CAR T 細(xì)胞和 NK 細(xì)胞均勻地分布在腫瘤的所有區(qū)域,而 CAR 巨噬細(xì)胞則聚集成團(tuán),腫瘤外圍區(qū)域幾乎沒(méi)有(圖 2E)。在不同的效應(yīng)細(xì)胞中,CAR T 細(xì)胞的數(shù)量比 CAR NK 細(xì)胞或 CAR 巨噬細(xì)胞多(圖 2F)。為了證實(shí)三維顯微鏡分析,作者將轉(zhuǎn)染了 NKG2D CAR mRNA 的 CD45.1+ 免疫細(xì)胞靜脈注射到 CD45.2+患膠質(zhì)瘤的小鼠體內(nèi),并使用體外流式細(xì)胞儀量化了腫瘤浸潤(rùn)細(xì)胞的數(shù)量。
結(jié)果證實(shí),CAR T 細(xì)胞比 CAR NK 細(xì)胞或 CAR 巨噬細(xì)胞數(shù)量更多(圖 2G)。由于細(xì)胞數(shù)量較少,作者還研究了局部瘤內(nèi)注射作為一種替代給藥途徑。與全身注射相比,這大大增加了所有 CAR 免疫效應(yīng)細(xì)胞的瘤內(nèi)數(shù)量。瘤內(nèi)注射兩天后,CAR T 細(xì)胞和 CAR 巨噬細(xì)胞在腫瘤內(nèi)的存活率很高,而 CAR NK 細(xì)胞的存活率較低(圖 2H)。總之,這些結(jié)果表明,CAR T 細(xì)胞在靜脈給藥后具有最佳的腫瘤歸巢潛能,但一般來(lái)說(shuō),局部給藥途徑更適合將足夠的 CAR 效應(yīng)細(xì)胞送到腫瘤部位。

實(shí)驗(yàn)結(jié)果3
scRNA-seq鑒定腫瘤微環(huán)境中CAR T細(xì)胞、CAR NK細(xì)胞和CAR巨噬細(xì)胞療法的不同免疫特征
為了描述不同CAR效應(yīng)細(xì)胞對(duì)腫瘤微環(huán)境的影響,作者在GL-261膠質(zhì)瘤小鼠體內(nèi)注射了CD45.1+ CAR T細(xì)胞、CAR NK細(xì)胞或CAR巨噬細(xì)胞,并在治療5天后使用單細(xì)胞RNA測(cè)序(scRNA-seq)分析了CD45.2+腫瘤浸潤(rùn)免疫細(xì)胞的分布情況。作者評(píng)估了通過(guò)質(zhì)量控制的每個(gè)樣本至少n= 6,499 個(gè)白細(xì)胞的單細(xì)胞 RNA圖譜。作者使用均勻流形近似和投影(UMAP)技術(shù)對(duì)結(jié)果中的n= 33,345 個(gè)細(xì)胞進(jìn)行了可視化處理。
膠質(zhì)母細(xì)胞瘤中腫瘤浸潤(rùn)免疫細(xì)胞的分布包括不同的髓系細(xì)胞群,包括單核細(xì)胞、一大群腫瘤相關(guān)巨噬細(xì)胞(TAMs)和小膠質(zhì)細(xì)胞(圖 3A)。此外,作者還檢測(cè)到粒細(xì)胞、樹(shù)突狀細(xì)胞、NK 細(xì)胞、T 細(xì)胞和 B 細(xì)胞。不同的 CAR 免疫效應(yīng)細(xì)胞導(dǎo)致了腫瘤免疫微環(huán)境的個(gè)體極化。CAR T細(xì)胞治療與更多的TAMs和粒細(xì)胞明顯相關(guān)。CAR NK細(xì)胞和CAR巨噬細(xì)胞的處理分別與更多的過(guò)渡性單核細(xì)胞或TAMs和NK細(xì)胞有關(guān)(圖3B和3C)。
T 細(xì)胞集群以及由單核細(xì)胞和 TAMs 組成的髓系細(xì)胞集群的基因本體富集分析進(jìn)一步證實(shí)了這些不同的效應(yīng)(圖 3D 和 3E)。CAR T細(xì)胞處理導(dǎo)致T細(xì)胞集群向細(xì)胞毒性狀態(tài)轉(zhuǎn)變,而對(duì)髓系細(xì)胞群的影響主要體現(xiàn)在代謝方面,并以糖酵解轉(zhuǎn)錄程序的變化為特征。CAR NK細(xì)胞和CAR巨噬細(xì)胞誘導(dǎo)了與抗病毒免疫防御相關(guān)的本體術(shù)語(yǔ)(圖3D)。CAR NK細(xì)胞和CAR巨噬細(xì)胞處理后,髓系細(xì)胞也出現(xiàn)了向抗病毒免疫反應(yīng)的轉(zhuǎn)變(圖3E)。然而,對(duì)于 CAR 巨噬細(xì)胞來(lái)說(shuō),它似乎不是細(xì)胞自主的,而是通過(guò) NK 細(xì)胞驅(qū)動(dòng)的。
接下來(lái),作者進(jìn)一步分析了CAR免疫效應(yīng)細(xì)胞處理對(duì)髓系細(xì)胞的不同影響,髓系細(xì)胞是膠質(zhì)瘤腫瘤微環(huán)境中最大的免疫細(xì)胞亞群。為此,作者以經(jīng)典的Ly6chi單核細(xì)胞群作為最早的時(shí)間點(diǎn)進(jìn)行了偽時(shí)間分析(圖 3F)。在已確定的轉(zhuǎn)錄連續(xù)體中,過(guò)渡性單核細(xì)胞之后是小膠質(zhì)細(xì)胞相關(guān)轉(zhuǎn)錄程序表達(dá)量不斷增加的 TAMs。對(duì)六個(gè)新興基因模塊中明顯富集基因的分析表明,早期 “偽 ”時(shí)間點(diǎn)與傷口愈合和抗病毒反應(yīng)術(shù)語(yǔ)相關(guān)。中期時(shí)間點(diǎn)的特征是抗原處理相關(guān)基因和向巨噬細(xì)胞遷移過(guò)渡;晚期時(shí)間點(diǎn)則顯示脂質(zhì)代謝狀態(tài)(圖 3G)。各階段的豐度分析表明,對(duì)照組富集了中期和晚期階段相關(guān)基因表達(dá)模塊(圖 3H)。
同樣,CAR T 細(xì)胞治療與中期和晚期相關(guān)模塊 2 和 4 相關(guān),而 CAR NK 細(xì)胞治療與早期和中期相關(guān)模塊 1、3 和 6 顯著相關(guān)。CAR 巨噬細(xì)胞治療顯示出模糊的特征,富集于早期階段模塊 3(與 CAR NK 細(xì)胞一起)和晚期階段模塊 4(與 CAR T 細(xì)胞一起)。總之,CAR T 細(xì)胞處理與髓系細(xì)胞的代謝重編程和晚期 TAMs 的出現(xiàn)有關(guān),而 CAR NK 細(xì)胞處理則增加了過(guò)渡性單核細(xì)胞的豐度以及 T 細(xì)胞和髓系細(xì)胞的抗病毒反應(yīng)。CAR 巨噬細(xì)胞處理顯示了兩者的特征。

實(shí)驗(yàn)結(jié)果4
通過(guò)同時(shí)表達(dá)促炎細(xì)胞因子,可將 CAR 免疫效應(yīng)細(xì)胞治療的有限生存益處轉(zhuǎn)化為治療效果
接下來(lái),作者比較了不同 CAR 免疫效應(yīng)細(xì)胞在體內(nèi)的治療潛力。為此,作者使用了完全免疫功能健全的合成膠質(zhì)瘤小鼠模型,并在腫瘤內(nèi)給予 CAR T 細(xì)胞、CAR NK 細(xì)胞或 CAR 巨噬細(xì)胞(圖 4A)。用模擬轉(zhuǎn)染的T細(xì)胞、NK細(xì)胞或巨噬細(xì)胞治療對(duì)小鼠的總體存活率影響有限,但沒(méi)有長(zhǎng)期存活的小鼠(圖4B和4 C)。在所有 CAR 免疫效應(yīng)細(xì)胞中,CAR T 細(xì)胞的表現(xiàn)最好。
然而,總體抗腫瘤活性仍然有限,GL-261 腫瘤小鼠只有一只長(zhǎng)期存活,SB-28 腫瘤小鼠的中位存活率也只有提高,沒(méi)有長(zhǎng)期存活(圖 4D 和 4E)。CAR T 細(xì)胞治療還伴隨著治療后兩天腫瘤內(nèi)最強(qiáng)的干擾素(IFN)γ 釋放,而血漿中的 IFNγ 濃度仍低于檢測(cè)限(圖 4F)。邊際存活效應(yīng)與治療過(guò)程中 CAR細(xì)胞存活率的下降無(wú)關(guān)。術(shù)后存活的 CAR 免疫效應(yīng)細(xì)胞保持了很高的存活率,并保留了體外抗腫瘤活性。每種 CAR 免疫效應(yīng)細(xì)胞的各自優(yōu)勢(shì)促使人們探索它們的聯(lián)合用藥是否能在體內(nèi)產(chǎn)生協(xié)同效應(yīng)。然而,事實(shí)并非如此,CAR T細(xì)胞、CAR NK細(xì)胞和CAR巨噬細(xì)胞的聯(lián)合應(yīng)用提高了小鼠的中位總存活率,但并沒(méi)有提高長(zhǎng)期存活小鼠的數(shù)量(圖4G)。為了克服腫瘤微環(huán)境的免疫抑制作用,作者最近研究并證明,多功能 CAR T 細(xì)胞在轉(zhuǎn)染了編碼細(xì)胞因子 IL-12 和 IFNα2 的 mRNA 后,也能治愈神經(jīng)膠質(zhì)瘤小鼠。
事實(shí)上,用每種多功能 CAR 免疫效應(yīng)細(xì)胞治療都能提高小鼠的總體存活率,其中多功能 CAR NK 細(xì)胞表現(xiàn)最佳,能治愈 6 只神經(jīng)膠質(zhì)瘤小鼠中的 4 只(圖 5A)。即使用只轉(zhuǎn)染了編碼細(xì)胞因子而沒(méi)有轉(zhuǎn)染 CAR 的 mRNA 的 T 細(xì)胞和 NK 細(xì)胞進(jìn)行治療,也能提高患膠質(zhì)瘤小鼠的總體存活率。在攜帶侵襲性乳腺癌轉(zhuǎn)移細(xì)胞株 E0771-BrM 的小鼠中,CAR 免疫效應(yīng)細(xì)胞中共同表達(dá)的細(xì)胞因子也能提高生存率(圖 5B)。在神經(jīng)膠質(zhì)瘤小鼠中,細(xì)胞因子共表達(dá)顯示注射五天后 CAR T 細(xì)胞和 CAR NK 細(xì)胞數(shù)量增加。這與瘤內(nèi) IFNγ 的長(zhǎng)期釋放和腫瘤相關(guān)髓系細(xì)胞的CD86上調(diào)有關(guān)(圖 5C、5 D)。同樣,CAR 巨噬細(xì)胞上的 CD86 表達(dá)也因細(xì)胞因子共表達(dá)和招募到腫瘤的 CD8α T 細(xì)胞數(shù)量增加而增加。
總體而言,治療耐受性良好,作為毒性間接指標(biāo)的體重在多功能 CAR 和細(xì)胞因子表達(dá)免疫細(xì)胞治療過(guò)程中保持穩(wěn)定。血值評(píng)估顯示肌酐值不變,但天門(mén)冬氨酸氨基轉(zhuǎn)移酶(AST)、丙氨酸轉(zhuǎn)氨酶(ALT)和多功能 CAR 巨噬細(xì)胞的 IFNγ 值升高(圖 5F)。然而,組織學(xué)評(píng)估顯示,安樂(lè)死小鼠的肝臟和脾臟內(nèi)未出現(xiàn)與多功能 CAR 細(xì)胞給藥相關(guān)的明顯形態(tài)學(xué)變化。
實(shí)驗(yàn)結(jié)果5
只有 CAR 淋巴細(xì)胞在體外和體內(nèi)對(duì)人類(lèi)膠質(zhì)母細(xì)胞瘤具有活性
最后,作者的目標(biāo)是確定在小鼠 CAR 效應(yīng)細(xì)胞上觀察到的發(fā)現(xiàn)是否可以轉(zhuǎn)化為人類(lèi) CAR 免疫效應(yīng)細(xì)胞。為此,作者制定了原代人 T 細(xì)胞、NK 細(xì)胞和巨噬細(xì)胞的擴(kuò)增方案。在確認(rèn)所有細(xì)胞類(lèi)型的 mRNA 轉(zhuǎn)染效率高達(dá) 94% 以上后,作者使用粘附的人膠質(zhì)瘤細(xì)胞系 LN-229 和球形膠質(zhì)瘤啟動(dòng)細(xì)胞系 ZH-161 進(jìn)行了 24 小時(shí)殺傷試驗(yàn)。與小鼠類(lèi)似,表達(dá) CARΔ(CD3ζ)的人 CAR T 細(xì)胞(而非對(duì)照組)能有效地裂解這兩種細(xì)胞系。
與此相反,只有在免疫抑制條件下表達(dá) CAR 才能提高 NK 細(xì)胞的殺傷力,而免疫抑制條件會(huì)像小鼠一樣下調(diào) NKG2D 的表面表達(dá)(圖 6A)。與小鼠細(xì)胞相反,人類(lèi) NK 細(xì)胞介導(dǎo)的殺傷力與腫瘤細(xì)胞表面 MHC I 類(lèi)分子的表達(dá)無(wú)關(guān),但與 NKG2D 配體 MHC I 類(lèi)多肽相關(guān)序列 A/B(MICA/B)相關(guān)。使用巨噬細(xì)胞集落刺激因子(M-CSF)從CD14+單核細(xì)胞分化出巨噬細(xì)胞,或使用促炎細(xì)胞因子粒細(xì)胞-巨噬細(xì)胞集落刺激因子(GM-CSF)和 IFNγ 極化巨噬細(xì)胞。M-CSF和GM-CSF/IFNγ都分化了CAR巨噬細(xì)胞,使膠質(zhì)瘤細(xì)胞減少達(dá)30%,而對(duì)照組表達(dá)CARΔ(CD3ζ)的巨噬細(xì)胞減少膠質(zhì)瘤細(xì)胞數(shù)量的程度較小(圖6B)。
接下來(lái),作者用編碼 ZsGreen 的 mRNA 和編碼人 NKG2D CAR、人細(xì)胞因子(IL-12 和 IFNα2)或 CAR 和細(xì)胞因子的 mRNA 共同轉(zhuǎn)染人免疫細(xì)胞,并將它們與膠質(zhì)母細(xì)胞瘤患者樣本進(jìn)行體外共同培養(yǎng)。24 小時(shí)后,作者使用基于圖像的單細(xì)胞平臺(tái)--藥理學(xué)鏡分析了膠質(zhì)母細(xì)胞瘤細(xì)胞的數(shù)量。總體而言,與 PBS 對(duì)照組相比,與人類(lèi)淋巴細(xì)胞共同培養(yǎng)的腫瘤細(xì)胞數(shù)量明顯減少(圖 6C)。此外,作者還觀察到 CAR T 細(xì)胞和共表達(dá)細(xì)胞因子的 CAR T 細(xì)胞的抗膠質(zhì)母細(xì)胞瘤活性有所提高,這表現(xiàn)在腫瘤細(xì)胞分?jǐn)?shù)降低和 T 細(xì)胞出現(xiàn)集群(圖 6C 和 6D)。此外,共同表達(dá) CAR 和細(xì)胞因子還能顯著提高 NK 細(xì)胞對(duì)腫瘤細(xì)胞的殺傷力。這些結(jié)果表明,在殺死膠質(zhì)母細(xì)胞瘤細(xì)胞方面,人 CAR 淋巴細(xì)胞優(yōu)于人 CAR 巨噬細(xì)胞,而且如果 CAR 淋巴細(xì)胞轉(zhuǎn)染后同時(shí)表達(dá) IL-12 和 IFNα2,還能帶來(lái)抗腫瘤益處。
標(biāo)簽:
膠質(zhì)母細(xì)胞瘤
CAR-T
- Hepcidin-25的作用機(jī)制及在炎癥、心血管與腫瘤等動(dòng)物模型中的應(yīng)用
- Klotho蛋白的分子形式、功能及其在疾病與衰老進(jìn)程中的核心作用
- 二甲雙胍(Metformin)在代謝、腫瘤、衰老與神經(jīng)疾病動(dòng)物模型中的作用
- Romidepsin作為HDAC1/2抑制劑在細(xì)胞分化與損傷修復(fù)中的作用
- 白細(xì)胞介素-2(IL-2)的功能、信號(hào)調(diào)控機(jī)制及對(duì)免疫穩(wěn)態(tài)調(diào)控的雙面性
- 腫瘤/纖維化EMT研究中mIHC染色指標(biāo)的組合及選擇方法
- Hepcidin-25(鐵調(diào)素)在鐵代謝與免疫反應(yīng)中的調(diào)節(jié)機(jī)制
- Vadimezan作為多功能STING激動(dòng)劑與血管破壞劑的作用機(jī)制
- 上海天能RapGel系列彩色凝膠快速制備試劑盒新品上市
- 博鷺騰試劑年終大促來(lái)襲,買(mǎi)三免一、爆款特價(jià)等你來(lái)
- 睿杰生物與宇優(yōu)生物聯(lián)袂推出年終狂歡購(gòu)活動(dòng)
- 尚睿生物邀您試用基因編輯利器—Cas12a核酸酶
- 默瑞(上海)生物科技有限公司誠(chéng)聘技術(shù)支持,銷(xiāo)售經(jīng)理
- 尚睿生物基因編輯工具酶(CAS蛋白)誠(chéng)招經(jīng)銷(xiāo)商
- SBC新品高效動(dòng)物組織細(xì)胞核分離試劑盒重磅上線
- 杭州沃森受邀參展第六屆BCM-CUHK-ZJU臨床遺傳學(xué)大會(huì)
Copyright(C) 1998-2025 生物器材網(wǎng) 電話:021-64166852;13621656896 E-mail:info@bio-equip.com






