Nature分享:BindCraft開源工具破解蛋白質(zhì)結(jié)合劑設(shè)計(jì)難題
文章來源公眾號(hào):Drug AI 作者:Drug AI
未來,或許只需輸入靶標(biāo)結(jié)構(gòu),就能在幾天內(nèi)獲得具備臨床潛力的功能分子
在生物醫(yī)學(xué)與生物技術(shù)領(lǐng)域,蛋白質(zhì)-蛋白質(zhì)相互作用(PPIs)是調(diào)控生命活動(dòng)的核心機(jī)制,而設(shè)計(jì)能特異性靶向并調(diào)控PPIs的蛋白質(zhì)結(jié)合劑,一直是開發(fā)治療藥物、診斷工具與分子生物學(xué)試劑的關(guān)鍵方向。傳統(tǒng)方法如免疫接種、抗體庫(kù)篩選或定向進(jìn)化,不僅耗時(shí)費(fèi)力,還難以精準(zhǔn)控制結(jié)合位點(diǎn),且實(shí)驗(yàn)成功率常低于0.1%。即便近年來興起的計(jì)算設(shè)計(jì)方法,如基于Rosetta的物理模擬或結(jié)合RFdiffusion與ProteinMPNN的深度學(xué)習(xí)策略,仍存在 backbone生成與功能界面設(shè)計(jì)脫節(jié)、依賴高通量篩選等局限。
近期,EPFL×MIT團(tuán)隊(duì)在《Nature》發(fā)表的題為“One-shot design of functional protein binders with BindCraft”的研究,提出了一款名為BindCraft的開源自動(dòng)化設(shè)計(jì)流程,徹底改變了這一局面。該工具以AlphaFold2(AF2)為核心驅(qū)動(dòng),無需高通量篩選或?qū)嶒?yàn)優(yōu)化,就能從頭設(shè)計(jì)出納米摩爾級(jí)親和力的蛋白質(zhì)結(jié)合劑,實(shí)驗(yàn)成功率高達(dá)10%~100%,即便在未知結(jié)合位點(diǎn)的情況下仍能高效工作。

傳統(tǒng)計(jì)算設(shè)計(jì)方法的核心痛點(diǎn),在于難以兼顧“結(jié)構(gòu)準(zhǔn)確性”與“功能有效性”——要么依賴固定靶標(biāo)結(jié)構(gòu)進(jìn)行預(yù)定義支架對(duì)接,導(dǎo)致界面兼容性差;要么在backbone生成后難以精準(zhǔn)優(yōu)化功能界面。BindCraft的創(chuàng)新之處,在于直接將AF2的結(jié)構(gòu)預(yù)測(cè)能力融入設(shè)計(jì)全過程,通過反向傳播(backpropagation)實(shí)現(xiàn)結(jié)合劑的結(jié)構(gòu)、序列與界面協(xié)同優(yōu)化,而非僅將AF2作為后續(xù)篩選工具。
其設(shè)計(jì)流程可概括為三大核心步驟:首先,基于AF2多聚體模型(AF2 multimer)初始化結(jié)合劑設(shè)計(jì)。由于AF2 multimer經(jīng)蛋白質(zhì)復(fù)合物數(shù)據(jù)訓(xùn)練,能更精準(zhǔn)模擬PPIs,相比單體模型可生成更大(平均大20%)、環(huán)結(jié)構(gòu)占比更高且置信度更強(qiáng)的結(jié)合界面。設(shè)計(jì)初始階段,BindCraft會(huì)以隨機(jī)序列啟動(dòng)結(jié)合劑“幻覺生成”(hallucination),通過AF2網(wǎng)絡(luò)計(jì)算設(shè)計(jì)損失(design loss),該損失函數(shù)整合了結(jié)合劑置信度(pLDDT)、界面置信度(i_pTM)、預(yù)測(cè)對(duì)齊誤差(pAE)、殘基接觸等9項(xiàng)關(guān)鍵指標(biāo),確保設(shè)計(jì)既符合結(jié)構(gòu)合理性,又滿足功能需求。
其次,通過多階段序列優(yōu)化提升結(jié)合劑的可溶性與穩(wěn)定性。AF2幻覺生成的序列雖能保證界面結(jié)合活性,但常存在表達(dá)量低的問題。為此,BindCraft引入MPNNsol(一種消息傳遞神經(jīng)網(wǎng)絡(luò)),在保持結(jié)合界面完整的前提下,對(duì)結(jié)合劑的核心與表面序列進(jìn)行優(yōu)化——這一步既能保留關(guān)鍵結(jié)合位點(diǎn),又能改善蛋白質(zhì)的可溶性與表達(dá)效率,解決了此前AF2幻覺蛋白“難表達(dá)”的共性問題。
最后,通過嚴(yán)格的多維度篩選確保設(shè)計(jì)質(zhì)量。優(yōu)化后的序列會(huì)經(jīng)AF2單體模型重新預(yù)測(cè)(避免多聚體模型對(duì)PPIs的預(yù)測(cè)偏倚),再結(jié)合Rosetta的物理基于評(píng)分(如界面形狀互補(bǔ)性、氫鍵數(shù)量等),最終篩選出pLDDT>0.8、i_pTM>0.5、界面氫鍵>3等滿足嚴(yán)格標(biāo)準(zhǔn)的設(shè)計(jì)。整個(gè)流程完全自動(dòng)化,用戶僅需提供靶標(biāo)PDB結(jié)構(gòu)與基本設(shè)計(jì)參數(shù)(如結(jié)合劑長(zhǎng)度范圍),無需專業(yè)計(jì)算背景即可操作,真正實(shí)現(xiàn)了蛋白質(zhì)結(jié)合劑設(shè)計(jì)的“民主化”。
值得注意的是,BindCraft還解決了傳統(tǒng)設(shè)計(jì)的另一大局限——靶標(biāo)結(jié)構(gòu)的“剛性依賴”。此前如RFdiffusion等方法需固定靶標(biāo)backbone,而BindCraft在每輪設(shè)計(jì)迭代中都會(huì)重新預(yù)測(cè)結(jié)合劑-靶標(biāo)復(fù)合物結(jié)構(gòu),允許靶標(biāo)與結(jié)合劑的側(cè)鏈和backbone存在一定靈活性(靶標(biāo)backbone的Cα RMSD可在0.5~5.5 Å范圍內(nèi)調(diào)整),最終形成的結(jié)合界面能更精準(zhǔn)地“貼合”靶標(biāo)結(jié)合位點(diǎn),這也是其能在未知結(jié)合位點(diǎn)場(chǎng)景下工作的關(guān)鍵。
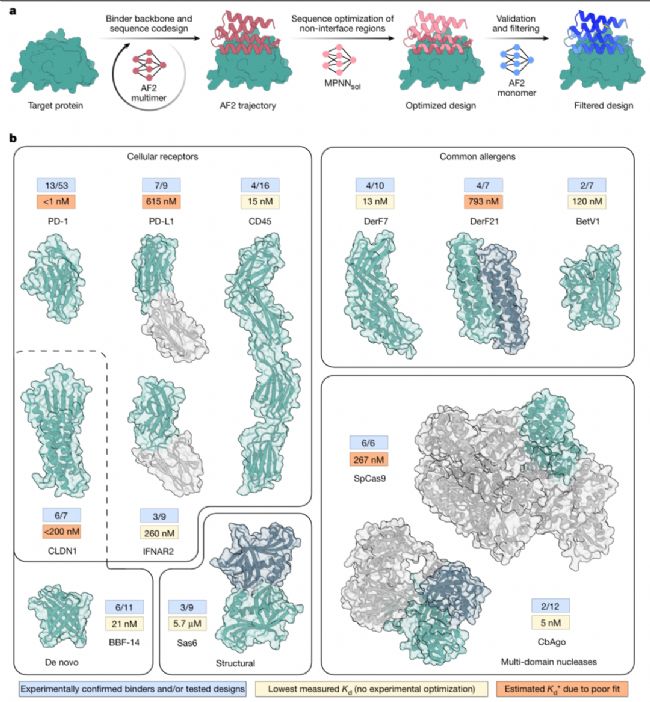
二、12類挑戰(zhàn)性靶標(biāo)驗(yàn)證:從細(xì)胞表面受體到核酸結(jié)合蛋白
一款蛋白質(zhì)設(shè)計(jì)工具的價(jià)值,最終需通過實(shí)驗(yàn)驗(yàn)證其普適性與功能性。BindCraft團(tuán)隊(duì)選擇了12類具有重要生物學(xué)與治療意義的靶標(biāo)進(jìn)行測(cè)試,涵蓋細(xì)胞表面受體、常見過敏原、從頭設(shè)計(jì)蛋白及多結(jié)構(gòu)域核酸酶(如CRISPR-Cas9),每類靶標(biāo)的設(shè)計(jì)結(jié)果都令人驚喜。
1. 細(xì)胞表面受體:精準(zhǔn)靶向免疫檢查點(diǎn)與未知位點(diǎn)細(xì)胞表面受體是免疫治療的核心靶標(biāo),但傳統(tǒng)抗體設(shè)計(jì)常受限于已知結(jié)合位點(diǎn)。BindCraft針對(duì)PD-1(免疫檢查點(diǎn)受體)設(shè)計(jì)的53個(gè)結(jié)合劑中,13個(gè)表現(xiàn)出結(jié)合活性,最優(yōu)結(jié)合劑以雙價(jià)Fc融合形式存在時(shí),表觀解離常數(shù)(Kd*)<1 nM,且與臨床藥物 pembrolizumab(帕博利珠單抗)競(jìng)爭(zhēng)相同結(jié)合位點(diǎn)——這意味著其有望成為PD-1抑制劑的替代候選分子,且分子量更小(60~240個(gè)氨基酸),可能具備更好的組織穿透性。
更值得關(guān)注的是,BindCraft對(duì)“無已知結(jié)合位點(diǎn)”靶標(biāo)的設(shè)計(jì)能力。以CD45為例,其胞外域含4個(gè)免疫球蛋白樣結(jié)構(gòu)域且高度糖基化,傳統(tǒng)方法難以定位結(jié)合位點(diǎn)。BindCraft設(shè)計(jì)的16個(gè)結(jié)合劑中,4個(gè)通過SPR驗(yàn)證,最優(yōu)結(jié)合劑(binder1)親和力達(dá)14.7 nM,且精準(zhǔn)靶向d3與d4結(jié)構(gòu)域的連接區(qū)域——這一結(jié)果證明,BindCraft無需依賴已知結(jié)合位點(diǎn)信息,僅通過靶標(biāo)結(jié)構(gòu)即可“自主”發(fā)現(xiàn)功能性結(jié)合區(qū)域,為難成藥受體的靶向提供了新策略。
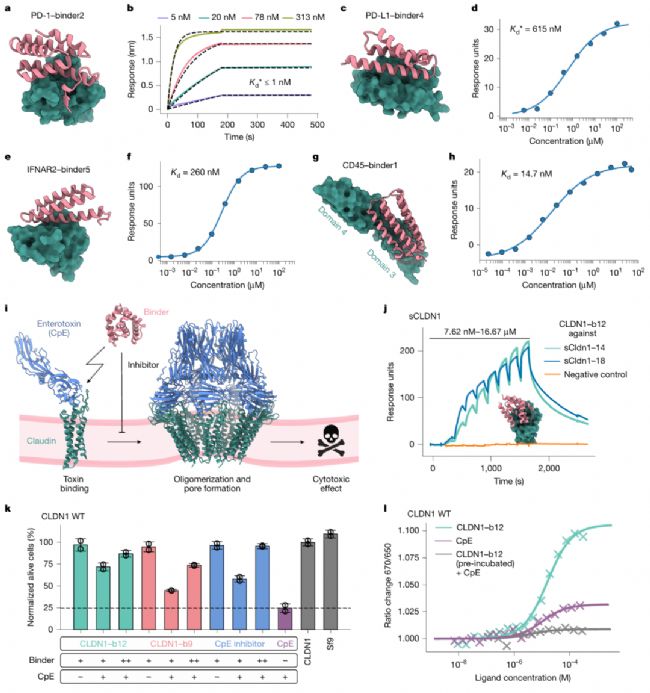
2. 過敏原:從結(jié)構(gòu)設(shè)計(jì)到臨床樣本驗(yàn)證的“抗過敏”潛力
過敏原是一類極具挑戰(zhàn)性的設(shè)計(jì)靶標(biāo)——其表面多帶高電荷,且傳統(tǒng)認(rèn)為疏水性結(jié)合位點(diǎn)更易設(shè)計(jì),而過敏原的親水性表面常導(dǎo)致設(shè)計(jì)失敗。BindCraft針對(duì)塵螨過敏原Der f7、Der f21及樺樹主要過敏原Bet v1(引發(fā)95%樺樹相關(guān)過敏)的設(shè)計(jì),打破了這一認(rèn)知。
針對(duì)Bet v1,BindCraft設(shè)計(jì)的7個(gè)結(jié)合劑中2個(gè)有效,最優(yōu)結(jié)合劑(binder2)親和力達(dá)120 nM,且能與臨床候選抗體混合物(REGN5713/5714/5715)競(jìng)爭(zhēng)相同表位。更關(guān)鍵的是,在患者血清樣本中,該結(jié)合劑能阻斷Bet v1與IgE的結(jié)合,最高阻斷率達(dá)50%——這一結(jié)果與單克隆抗體的阻斷效果相當(dāng),且結(jié)合劑穩(wěn)定性更高,為過敏性疾病的“精準(zhǔn)中和”提供了新方案。此外,針對(duì)Der f7的結(jié)合劑(binder2)還通過晶體結(jié)構(gòu)驗(yàn)證,其backbone與設(shè)計(jì)模型的RMSD僅1.7 Å,證明了BindCraft設(shè)計(jì)的結(jié)構(gòu)準(zhǔn)確性。
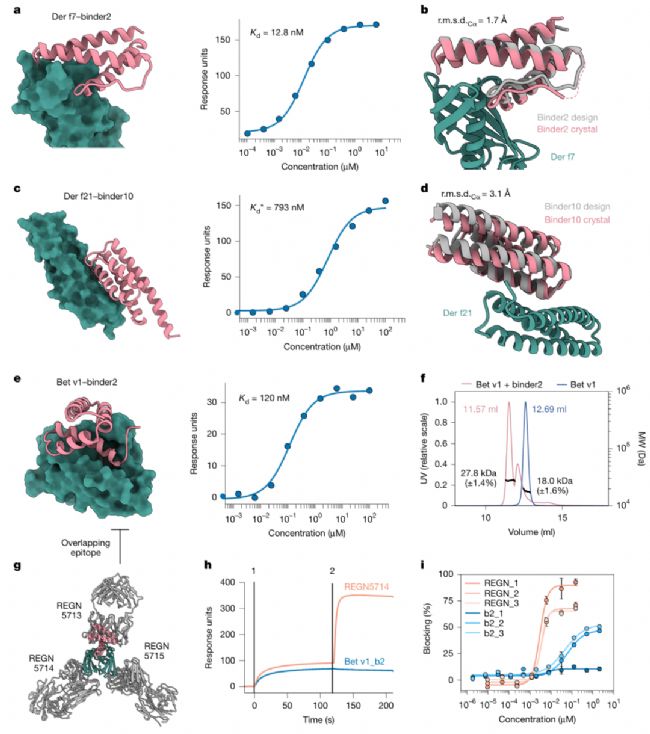
3. 多結(jié)構(gòu)域核酸酶:攻克“不可成藥”的核酸結(jié)合界面
核酸結(jié)合蛋白(如CRISPR-Cas9、Argonaute)的界面因大尺寸、高電荷、凸面結(jié)構(gòu),一直被認(rèn)為是“不可成藥”靶點(diǎn)——小分子難以結(jié)合,傳統(tǒng)抗體又難以穿透核酸結(jié)合通道。BindCraft針對(duì)這類靶標(biāo)的設(shè)計(jì),首次證明了蛋白質(zhì)結(jié)合劑可有效調(diào)控核酸酶活性。
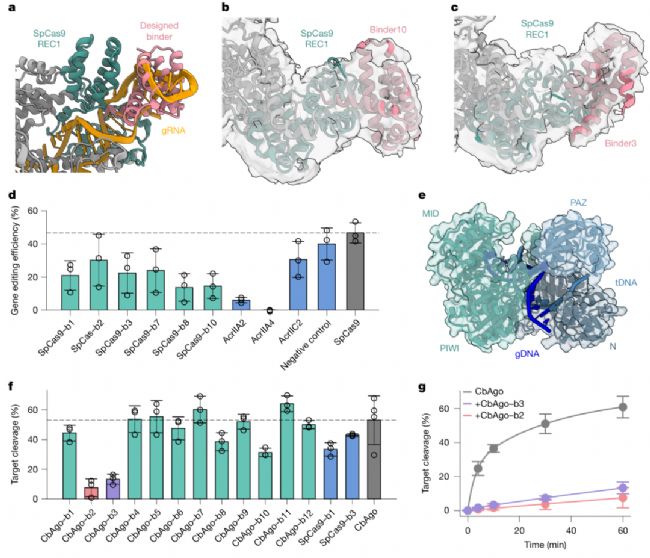
在SpCas9(CRISPR基因編輯核心工具)的設(shè)計(jì)中,BindCraft靶向其REC1結(jié)構(gòu)域(向?qū)NA結(jié)合口袋),6個(gè)測(cè)試結(jié)合劑全部能結(jié)合全長(zhǎng)apo SpCas9,最優(yōu)結(jié)合劑(binder3/10)親和力達(dá)300 nM級(jí)。功能實(shí)驗(yàn)顯示,這些結(jié)合劑能顯著降低HEK293T細(xì)胞中的Cas9基因編輯效率,且抑制效果優(yōu)于天然抗CRISPR蛋白AcrIIC2——這為基因編輯的“精準(zhǔn)調(diào)控”提供了新工具,可有效降低脫靶效應(yīng)。
更令人振奮的是對(duì)Argonaute核酸酶(CbAgo)的設(shè)計(jì)。CbAgo作為細(xì)菌免疫系統(tǒng)的關(guān)鍵分子,通過小核酸向?qū)懈钔庠碊NA,但目前尚無天然抑制劑報(bào)道。BindCraft針對(duì)其N-PIWI通道或PAZ結(jié)構(gòu)域設(shè)計(jì)的12個(gè)結(jié)合劑中,2個(gè)能強(qiáng)效抑制CbAgo的DNA切割活性:加入2 μM binder2后,CbAgo的催化常數(shù)(kcat)從0.004 s⁻¹降至5×10⁻⁵ s⁻¹(降低80倍),且該結(jié)合劑能與CbAgo形成穩(wěn)定復(fù)合物,通過競(jìng)爭(zhēng)向?qū)NA(gDNA)結(jié)合位點(diǎn)發(fā)揮作用。這一結(jié)果不僅證明BindCraft可設(shè)計(jì)核酸結(jié)合界面的結(jié)合劑,更為開發(fā)新型核酸酶抑制劑提供了范式。
三、從“設(shè)計(jì)”到“應(yīng)用”:BindCraft的轉(zhuǎn)化潛力
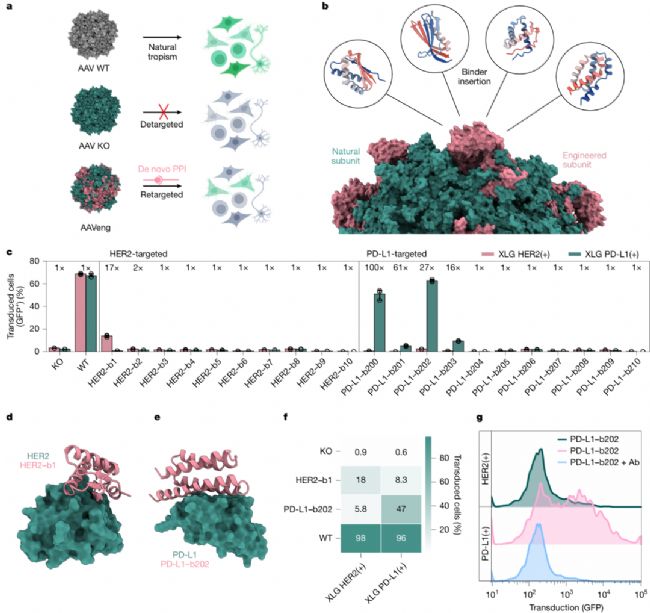
優(yōu)秀的技術(shù)不僅要解決科學(xué)問題,更要具備實(shí)際應(yīng)用價(jià)值。BindCraft團(tuán)隊(duì)在論文中展示了其在基因治療、毒素中和等領(lǐng)域的轉(zhuǎn)化潛力,其中最具代表性的是腺相關(guān)病毒(AAV)的靶向重定向。
AAV是基因治療的常用載體,但天然AAV靶向性差,常需高劑量給藥,導(dǎo)致脫靶效應(yīng)與免疫原性風(fēng)險(xiǎn)。傳統(tǒng)AAV重定向方法依賴肽段插入或抗體片段融合,需大量篩選且難以控制結(jié)合位點(diǎn)。BindCraft的解決方案是:設(shè)計(jì)針對(duì)特定細(xì)胞表面受體(如HER2、PD-L1)的迷你蛋白結(jié)合劑,將其插入AAV衣殼的VR-V區(qū)域(經(jīng)突變研究驗(yàn)證的最優(yōu)插入位點(diǎn)),同時(shí)通過突變敲除AAV對(duì)肝素與唾液酸的天然結(jié)合能力,實(shí)現(xiàn)“脫靶-重定向”雙重調(diào)控。
實(shí)驗(yàn)結(jié)果顯示,針對(duì)HER2設(shè)計(jì)的結(jié)合劑(binder1)與PD-L1設(shè)計(jì)的結(jié)合劑(binder202),能使AAV特異性靶向表達(dá)HER2或PD-L1的HEK293細(xì)胞, transduction效率最高提升61倍,且當(dāng)加入靶向PD-L1的抗體后,transduction被顯著阻斷——證明結(jié)合劑確實(shí)介導(dǎo)了AAV與靶標(biāo)受體的特異性結(jié)合。這一成果為基因治療的“精準(zhǔn)遞送”提供了新策略,可實(shí)現(xiàn)對(duì)疾病相關(guān)細(xì)胞的定向基因?qū)耄档拖到y(tǒng)毒性。
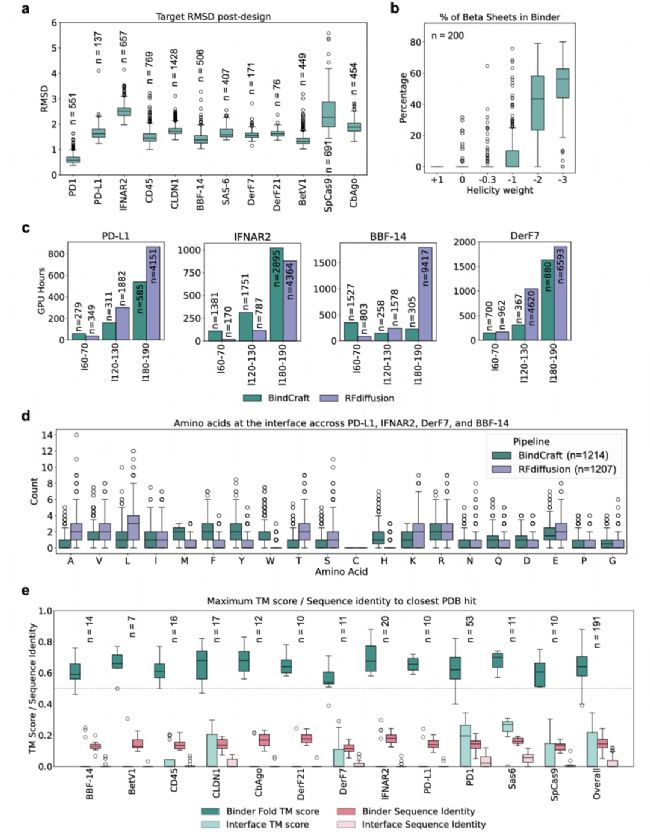
BindCraft 設(shè)計(jì)的計(jì)算機(jī)模擬分析。該圖通過多維度數(shù)據(jù)對(duì) BindCraft 的設(shè)計(jì)過程與結(jié)果進(jìn)行計(jì)算機(jī)模擬驗(yàn)證:a 為不同設(shè)計(jì)靶標(biāo)在 AF2 結(jié)合劑幻覺生成后,靶標(biāo)結(jié)構(gòu)相對(duì)于輸入靶標(biāo)結(jié)構(gòu)的 Cα RMSD 值分布圖,體現(xiàn)了靶標(biāo)結(jié)構(gòu)的靈活性范圍;b 為螺旋度損失對(duì) PD-L1 結(jié)合劑二級(jí)結(jié)構(gòu)含量的影響,負(fù)權(quán)重值(抑制 α- 螺旋形成)可產(chǎn)生純 β- 折疊結(jié)合劑;c 為不同靶標(biāo)和結(jié)合劑長(zhǎng)度下,生成 100 個(gè)通過計(jì)算篩選的結(jié)合劑所需的 GPU 小時(shí)數(shù),標(biāo)注了需采樣的設(shè)計(jì)數(shù)量,對(duì)比了 BindCraft 與 RFdiffusion 的計(jì)算效率;d 為 BindCraft 與 RFdiffusion 在 PD-L1、IFNAR2、DerF7 和 BBF-14 四個(gè)靶標(biāo)上,結(jié)合劑界面的氨基酸類型分布對(duì)比圖;e 為設(shè)計(jì)的結(jié)合劑折疊結(jié)構(gòu)(綠色)及結(jié)合劑 - 靶標(biāo)界面(粉色)與 PDB 中最相似結(jié)構(gòu)的最大 TM 分?jǐn)?shù)和序列同一性對(duì)比箱線圖,箱線圖中心線為中位數(shù),箱體為 25%~75% 分位數(shù),須為最小值和最大值,異常值為超出 1.5 倍四分位距的數(shù)據(jù)點(diǎn),證實(shí)設(shè)計(jì)結(jié)合劑的結(jié)構(gòu)與界面新穎性。
四、展望與局限:蛋白質(zhì)設(shè)計(jì)邁入“按需定制”時(shí)代
BindCraft的出現(xiàn),標(biāo)志著計(jì)算蛋白質(zhì)設(shè)計(jì)從“高通量篩選依賴”向“一次設(shè)計(jì)即獲功能分子”邁進(jìn)。其平均46.3%的實(shí)驗(yàn)成功率,遠(yuǎn)超當(dāng)前主流方法(如RFdiffusion約10%~20%),且無需依賴高通量篩選平臺(tái),使普通實(shí)驗(yàn)室也能開展高質(zhì)量蛋白質(zhì)結(jié)合劑設(shè)計(jì)。但作為研究者,我們也需客觀看待其局限:一是GPU計(jì)算成本較高,反向傳播過程對(duì)硬件要求較高;二是AF2單體模型篩選可能排除部分高親和力結(jié)合劑,且AF2對(duì)單點(diǎn)突變不敏感,需結(jié)合Rosetta等工具進(jìn)一步驗(yàn)證;三是結(jié)合劑的免疫原性與體內(nèi)遞送問題仍需解決——盡管其分子量小于抗體,但合成蛋白的免疫原性仍需在動(dòng)物模型中評(píng)估。
不過,這些局限并非不可克服。隨著AlphaFold3等新一代模型的出現(xiàn),結(jié)合劑的設(shè)計(jì)精度有望進(jìn)一步提升;而遞送技術(shù)(如納米顆粒、細(xì)胞穿透肽)的發(fā)展,也將助力結(jié)合劑的體內(nèi)應(yīng)用。更重要的是,BindCraft已開源,這意味著研究者可在此基礎(chǔ)上進(jìn)行二次開發(fā),推動(dòng)技術(shù)快速迭代。
回顧蛋白質(zhì)設(shè)計(jì)領(lǐng)域的發(fā)展,從早期Rosetta的“腳手架設(shè)計(jì)”到如今BindCraft的“協(xié)同優(yōu)化”,我們見證了計(jì)算方法從“輔助篩選”到“主導(dǎo)設(shè)計(jì)”的轉(zhuǎn)變。BindCraft的成果不僅為治療(如抗過敏、基因編輯調(diào)控)、診斷(如特異性探針)與生物技術(shù)(如AAV靶向遞送)提供了新工具,更讓我們看到了“按需定制蛋白質(zhì)結(jié)合劑”的可能性——未來,或許只需輸入靶標(biāo)結(jié)構(gòu),就能在幾天內(nèi)獲得具備臨床潛力的功能分子。
建議相關(guān)領(lǐng)域的研究者重點(diǎn)關(guān)注這一工具,無論是開發(fā)新型治療藥物,還是探索蛋白質(zhì)相互作用的基本機(jī)制,BindCraft都將成為極具價(jià)值的研究助手。也期待未來能看到更多基于BindCraft的轉(zhuǎn)化研究,讓計(jì)算蛋白質(zhì)設(shè)計(jì)真正從實(shí)驗(yàn)室走向臨床。
- Hepcidin-25的作用機(jī)制及在炎癥、心血管與腫瘤等動(dòng)物模型中的應(yīng)用
- Klotho蛋白的分子形式、功能及其在疾病與衰老進(jìn)程中的核心作用
- 二甲雙胍(Metformin)在代謝、腫瘤、衰老與神經(jīng)疾病動(dòng)物模型中的作用
- Romidepsin作為HDAC1/2抑制劑在細(xì)胞分化與損傷修復(fù)中的作用
- 白細(xì)胞介素-2(IL-2)的功能、信號(hào)調(diào)控機(jī)制及對(duì)免疫穩(wěn)態(tài)調(diào)控的雙面性
- 腫瘤/纖維化EMT研究中mIHC染色指標(biāo)的組合及選擇方法
- Hepcidin-25(鐵調(diào)素)在鐵代謝與免疫反應(yīng)中的調(diào)節(jié)機(jī)制
- Vadimezan作為多功能STING激動(dòng)劑與血管破壞劑的作用機(jī)制






