mRNA-LNP在新一代CAR-T細(xì)胞療法中的作用

基因編輯技術(shù)的發(fā)展為科研人員提供了直接靶向和修改活體生物基因序列的方法。該技術(shù)通過(guò)創(chuàng)建更精確的細(xì)胞和動(dòng)物模型,擴(kuò)展了我們對(duì)人類疾病背后遺傳學(xué)的理解。從基礎(chǔ)研究到應(yīng)用生物技術(shù)和生物醫(yī)學(xué)研究的各個(gè)領(lǐng)域,該技術(shù)都極具潛力1。然而一直以來(lái),將基因編輯工具遞送到靶細(xì)胞都是一項(xiàng)極具挑戰(zhàn)的工作。如果有一種安全高效的基因遞送新技術(shù)不受內(nèi)載基因的限制,研究人員將能夠?qū)崿F(xiàn)基因編輯策略的全部潛力,從而探索癌癥治療的新途徑。
基因編輯的基礎(chǔ)依賴于在感興趣的染色體位點(diǎn)啟動(dòng)雙鏈斷裂 (DSB),以觸發(fā)兩種內(nèi)源性細(xì)胞 DNA 修復(fù)途徑之一:非同源末端連接 (NHEJ) 或同源定向修復(fù) (HDR),它們分別導(dǎo)致基因破壞或靶向整合。一直到 2013 年之前,工程核酸酶,如鋅指核酸酶 (ZFN) 和轉(zhuǎn)錄激活因子樣效應(yīng)核酸酶 (TALEN) 是用于基因編輯的主導(dǎo)技術(shù)。然而,漫長(zhǎng)的開(kāi)發(fā)時(shí)間加上相對(duì)較低的編輯效率,限制了該領(lǐng)域的發(fā)展速度。
2013 年,來(lái)自細(xì)菌適應(yīng)性免疫防御系統(tǒng)的成簇規(guī)律間隔短回文重復(fù)序列 (CRISPR)/Cas 相關(guān)核酸酶的發(fā)現(xiàn)給基因編輯領(lǐng)域帶來(lái)了顛覆性改變。CRISPR/Cas9 系統(tǒng)使用短鏈向?qū)?RNA (sgRNA) 來(lái)引導(dǎo) Cas9 介導(dǎo)的切割和供體 HDR 模板的插入。相比 ZFN 和 TALEN,重新定位Cas9的RNA設(shè)計(jì)具有簡(jiǎn)單、應(yīng)用廣泛、易調(diào)整等顯著優(yōu)勢(shì),從而開(kāi)創(chuàng)了基因工程的新時(shí)代。隨著基因編輯領(lǐng)域繼續(xù)創(chuàng)新和快速發(fā)展,業(yè)界正在研究替代性或工程化的 CRISPR 核酸酶(即 Cas12 和 dead Cas9)和其他模式,如堿基和引物編輯,以提高效率并減少脫靶效應(yīng)。
T 細(xì)胞的基因工程催生了新的癌癥免疫療法,如嵌合抗原受體 (CAR)-T 細(xì)胞療法,徹底顛覆了癌癥治療方法。目前的自體 CAR-T 免疫療法已展現(xiàn)較高的臨床成功率,但該療法的安全性和有效性仍有待提高。下一代 CAR-T 免疫療法的重點(diǎn)是增強(qiáng) CAR-T 細(xì)胞的效力,限制脫靶效應(yīng),將治療目標(biāo)擴(kuò)展至液體癌以外的癌癥,并從同種異體供體中制造通用 CAR-T 細(xì)胞1。這些新策略需要更復(fù)雜的、基于CRISPR/Cas9的基因工程策略,其中所選的基因遞送方法決定著基因編輯的效率、安全性和可擴(kuò)展性。
★基因編輯工具的遞送機(jī)制★
基于 T 細(xì)胞基因編輯的療法可分為體內(nèi)和離體療法(圖 1)。在體內(nèi)療法中,基因編輯機(jī)器被直接輸入體內(nèi)。另一方面,在離體療法中,靶細(xì)胞被分離、基因工程改造并重新輸回患者體內(nèi)。雖然病毒載體已在臨床上高效地用于 T 細(xì)胞工程,但是該方法存在幾個(gè)缺點(diǎn),例如成本較高、具有潛在的插入突變風(fēng)險(xiǎn)和脫靶效應(yīng),這給患者帶來(lái)了安全隱患2。就其安全性、簡(jiǎn)單性和靈活性而言,非病毒遞送模式已成為病毒載體的優(yōu)質(zhì)替代方案。
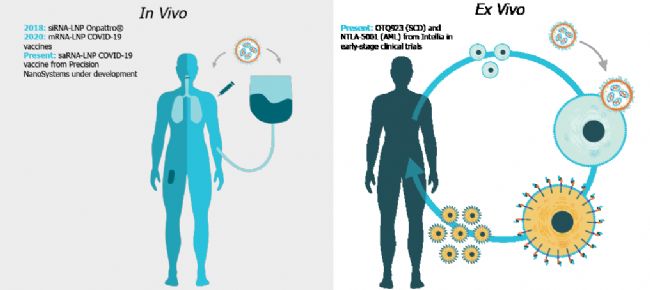
圖 1. 體內(nèi)和離體基因編輯的示意圖。對(duì)于體內(nèi)基因編輯,基因編輯機(jī)器直接輸入體內(nèi)。對(duì)于離體基因編輯,分離靶細(xì)胞后,進(jìn)行基因改造,再重新輸回患者體內(nèi)。
被長(zhǎng)期用于離體遞送的非病毒方法之一就是電穿孔。這種技術(shù)利用脈沖高壓電流瞬時(shí)打開(kāi)細(xì)胞膜中的納米級(jí)通道,將核酸遞送到細(xì)胞中。對(duì)于 CRISPR/Cas9,需要連續(xù)的電脈沖來(lái)分別遞送 Cas9 mRNA 和 sgRNA。這導(dǎo)致需要在效率和細(xì)胞存活率之間做出巨大的權(quán)衡取舍,使得用電穿孔方法進(jìn)行一系列或多重基因操作十分困難。
脂質(zhì)納米粒 (LNP) 則不需要這樣的權(quán)衡,這使其成為相比電穿孔更加有效的 RNA 遞送替代方法。LNP 是完全合成的脂質(zhì)制劑,用于在將 RNA 遞送到靶細(xì)胞之前包封和保護(hù) RNA 免受核酸酶降解。RNA-LNP 復(fù)合物在結(jié)構(gòu)上與低密度脂蛋白 (LDL) 類似,可以利用 LDL 的內(nèi)源性攝取途徑,通過(guò)受體介導(dǎo)的內(nèi)吞作用進(jìn)入靶細(xì)胞。這種溫和的攝取機(jī)制能夠成功和高效地進(jìn)行 T 細(xì)胞基因工程,與電穿孔方法相比具有一致的高水平基因表達(dá)、高轉(zhuǎn)染效率和高活細(xì)胞產(chǎn)量。事實(shí)上,臨床階段基因編輯技術(shù)領(lǐng)先的企業(yè) Intellia Therapeutics 發(fā)布的數(shù)據(jù)顯示,在他們的同種異體 TCR-T 和 CAR-T 項(xiàng)目中,LNP 有效地取代了電穿孔向 T 細(xì)胞遞送 CRISPR/Cas9 基因編輯物。LNP 避免了多重編輯帶來(lái)的染色體易位風(fēng)險(xiǎn),以及電穿孔對(duì) T 細(xì)胞活性的負(fù)面影響。
Precision NanoSystems 利用其對(duì) LNP 化學(xué)和細(xì)胞生物學(xué)的深厚知識(shí),設(shè)計(jì)了一款專用于T細(xì)胞基因編輯的LNP 組合物。因?yàn)?LNP 特性對(duì)生產(chǎn)條件敏感,所以需要對(duì)生產(chǎn)過(guò)程進(jìn)行精確且可重復(fù)的控制,以確保顆粒生產(chǎn)的一致性。
NanoAssemblr 儀器與GenVoy-ILM™ T Cell Kit for mRNA(可用于 NanoAssemblr Spark™ 和 Ignite™ 儀器)等專用試劑盒配套使用,為研究人員提供所需的工具,幫助他們?cè)僮约旱膶?shí)驗(yàn)室內(nèi)建立可靠、可擴(kuò)展的離體基因遞送方法。mRNA-LNP 可以輕松無(wú)縫地整合到標(biāo)準(zhǔn)的原代 T 細(xì)胞培養(yǎng)工作流程中,以促進(jìn)從概念到臨床實(shí)踐的下一代 CAR-T 細(xì)胞療法的生產(chǎn)。
★L(fēng)NP助力下一代基因編輯CAR-T 細(xì)胞療法★
多個(gè)概念驗(yàn)證實(shí)驗(yàn)強(qiáng)調(diào)了使用 GenVoy-ILM T Cell Kit for mRNA制備的LNP,在進(jìn)行自體和異體 CAR-T 細(xì)胞治療開(kāi)發(fā)時(shí)的有效性和通用性(圖 2)3。
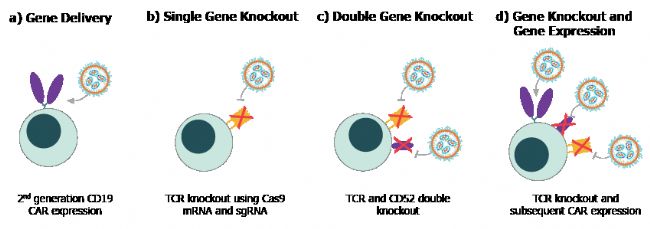
圖 2. LNP 易于整合到離體 CAR-T 細(xì)胞基因工程策略中,包括基因表達(dá) (a)、單基因敲除 (b)、雙基因敲除 (c) 和多步驟基因敲除和表達(dá) (d)。
自體細(xì)胞療法
在通過(guò) LNP 和電穿孔兩種方法將抗CD19 CAR mRNA 遞送至 T 細(xì)胞的對(duì)比實(shí)驗(yàn)中,發(fā)現(xiàn)LNP方法的轉(zhuǎn)染效率 (TE) 顯著高于電穿孔。并且觀察到更高的細(xì)胞存活率和同質(zhì)程度更高的 CAR 表達(dá),這是對(duì) CAR-T 產(chǎn)品的最終細(xì)胞產(chǎn)量產(chǎn)生積極影響的重要參數(shù)3。研究還表明,與電穿孔和/或慢病毒轉(zhuǎn)染相比,LNP 介導(dǎo)的 CD19 CAR-T 細(xì)胞表現(xiàn)出同等的腫瘤殺傷能力4,5。
同種異體細(xì)胞療法
從健康供體細(xì)胞產(chǎn)生的同種異體 CAR-T 細(xì)胞產(chǎn)物有潛力克服與自體療法相關(guān)的、已論證的缺點(diǎn),但必須解決宿主同種異體排斥和移植物抗宿主病 (GVHD) 風(fēng)險(xiǎn)等挑戰(zhàn)。使用 LNP 作為遞送載體的 CRISPR/Cas9 基因編輯 支持天然 αβ TCR 的單基因敲除 (KO) 以及 TCR 和 T 細(xì)胞標(biāo)志物 CD52 的雙基因敲除,以允許抗體介導(dǎo)性(抗 CD52)淋巴細(xì)胞清除。T 細(xì)胞標(biāo)志物 CD52 的敲除,允許對(duì)患者(抗 CD52)進(jìn)行抗體治療以增強(qiáng)淋巴細(xì)胞清除,同時(shí)不影響輸入的同種異體 CAR T 細(xì)胞,以降低同種異體反應(yīng)性和 GVHD。此外,使用LNP介導(dǎo)的CRISPR/Cas9進(jìn)行基因KO的多步驟工程,再進(jìn)行CAR轉(zhuǎn)基因表達(dá),成功產(chǎn)生了功能性強(qiáng)的 TCR–CD19 CAR-T 細(xì)胞,證明其在體外可以有效殺傷腫瘤細(xì)胞3。
在各種基因改造場(chǎng)景中,LNP 介導(dǎo)的基因遞送表現(xiàn)出的簡(jiǎn)易性為研究人員提供了相較于病毒載體和電穿孔的顯著優(yōu)勢(shì),以加速下一代 CAR-T 細(xì)胞療法的發(fā)展。
★總結(jié)★
基因遞送平臺(tái)需要支持多種多樣的基因策略來(lái)開(kāi)發(fā)新的基因藥物。隨著該領(lǐng)域將重點(diǎn)轉(zhuǎn)向解決新的疾病靶點(diǎn),并致力于同種異體方法以開(kāi)發(fā)“現(xiàn)成”的產(chǎn)品來(lái)服務(wù)更多的患者群體,需要多重或順序基因操作的工作流程變得越來(lái)越普遍。LNP 正在多個(gè)基因編輯項(xiàng)目中用于臨床評(píng)估。Intellia Therapeutics 公司正在臨床管線中加速推進(jìn)基于LNP CRISPR系統(tǒng)的體內(nèi)和離體產(chǎn)品。OTQ923/HIX763 專注于造血干細(xì)胞的離體基因編輯以治療鐮狀細(xì)胞疾病,而公司領(lǐng)先的、用于治療甲狀腺素運(yùn)載蛋白 (ATTR) 淀粉樣變性的體內(nèi)基因編輯候選物NTLA-2001,已報(bào)道初步臨床結(jié)果頗具前景。
病毒載體和電穿孔有諸多缺點(diǎn),例如內(nèi)載基因長(zhǎng)度受限、細(xì)胞活性低和轉(zhuǎn)染效率欠佳。LNP 是一種經(jīng)過(guò)臨床驗(yàn)證的可擴(kuò)展技術(shù),已用于制備FDA 批準(zhǔn)的COVID-19 mRNA 疫苗,和第一種基于小干擾 RNA 的藥物 ONPATTRO® (patisiran)。這種遞送技術(shù)已被證明在基因遞送和編輯應(yīng)用上,具有有效性、溫和性和可擴(kuò)展性,有助于在快速發(fā)展的臨床環(huán)境中加速 T 細(xì)胞療法研究和藥物開(kāi)發(fā)。
掃描以下二維碼,即可觀看Fraunhofer IZI 先進(jìn)療法產(chǎn)品 (ATMP) 工程部負(fù)責(zé)人Sandy Tretbar 博士為我們帶來(lái)的前沿分享:基于 mRNA-LNP的嵌合抗原受體的瞬時(shí)表達(dá),可用于安全免疫治療


參考文獻(xiàn)
1) Li H, Yang Y, Hong W, Huang M, Wu M, Zhao X. Applications of genome editing technology in the targeted therapy of human diseases: mechanisms, advances and prospects. Signal Transduct Target Ther. 2020;5(1):1. Published 2020 Jan 3. doi:10.1038/s41392-019-0089-y
2) Xu X, Wan T, Xin H, et al. Delivery of CRISPR/Cas9 for therapeutic genome editing. J Gene Med. 2019;21(7):e3107. doi:10.1002/jgm.3107
3) Precision Nanosystems. Genome Editing of Human Primary T Cells with Lipid Nanoparticles. Application Note: CRISPR-AN-0322
4) Billingsley MM, Hamilton AG, Mai D, et al. Orthogonal Design of Experiments for Optimization of Lipid Nanoparticles for mRNA Engineering of CAR T Cells. Nano Lett. 2022;22(1):533-542. doi:10.1021/acs.nanolett.1c02503
5) Billingsley MM, Singh N, Ravikumar P, Zhang R, June CH, Mitchell MJ. Ionizable Lipid Nanoparticle-Mediated mRNA Delivery for Human CAR T Cell Engineering. Nano Lett. 2020;20(3):1578-1589. doi:10.1021/acs.nanolett.9b04246
- 脂質(zhì)納米顆粒制劑中的mRNA-free LNPs(空殼LNPs)的結(jié)構(gòu)特征及其影響
- 綜述文章解讀:調(diào)節(jié)脂質(zhì)納米顆粒(LNP)將RNA靶向遞送至肝外器官
- 解析GMP的發(fā)展歷程、藥品質(zhì)量保障的重要性及落實(shí)方法
- PAT為生物藥CMC提供原位、實(shí)時(shí)的解決方案
- 微流控壓力驅(qū)動(dòng)流動(dòng)控制系統(tǒng)的工作原理及優(yōu)勢(shì)
- 人骨髓間充質(zhì)基質(zhì)細(xì)胞MSC微流體高通量單細(xì)胞封裝技術(shù)的介紹
- 一文讀懂Parylene派瑞林鍍膜技術(shù)
- 接觸角數(shù)據(jù)重復(fù)性不好的原因、影響清潔度的因素及解決方法
- 2026生物農(nóng)藥研發(fā)創(chuàng)制與農(nóng)藥制劑加工研討會(huì)通知
- BPI2026第11屆新分子抗體藥研發(fā)論壇嘉賓陣容公布
- 2026第94屆API醫(yī)藥原料及中間體設(shè)備交易會(huì)通知
- BIOME2026第四屆國(guó)際生物醫(yī)藥產(chǎn)業(yè)博覽會(huì)通知
- 2025BPD成都生物藥工藝發(fā)展大會(huì)完美落幕
- 2026第十屆(上海)生物藥創(chuàng)新開(kāi)發(fā)峰會(huì)通知
- BIFT2025第六屆生物醫(yī)藥創(chuàng)新與前沿技術(shù)峰會(huì)議程表
- BIO-FORUM 2025上海生物技術(shù)與醫(yī)藥研討會(huì)即將開(kāi)幕
Copyright(C) 1998-2025 生物器材網(wǎng) 電話:021-64166852;13621656896 E-mail:info@bio-equip.com