綜述文章解讀:調節脂質納米顆粒(LNP)將RNA靶向遞送至肝外器官

2024年9月5日,美國塔夫茨大學 許巧兵 教授團隊在《Advanced Materials》發表了一篇題為"Tuning Lipid Nanoparticles for RNA Delivery to Extrahepatic Organs"的綜述文章,詳細探討了 LNPs 在 RNA 遞送至肝外器官方面的研究進展。
RNA-LNP 遞送至肝外器官
肺部遞送
基因療法在肺部疾病(如囊性纖維化、纖毛運動障礙和α-1抗胰蛋白酶缺乏癥)治療中備受關注。肺部藥物遞送通常采用吸入或全身給藥方法,雖然RNA-LNP在全身給藥后能到達肺內皮,但脫靶轉染可能增加不良副作用的風險。
近期,選擇性器官靶向 SORT-LNP 通過在四組分配方中添加陽離子脂質(如DOTAP、DDAB或EPC)實現了肺部靶向(圖1a)。這種LNP能夠轉染約40%的上皮細胞、65%的內皮細胞和20%的免疫細胞。專門針對肺部的SORT-LNP,如50% DOTAP組成的LNP,能誘導PTEN編輯;而9A1P9-DDAB iPLNP則轉染34%的內皮細胞、20%的上皮細胞和13%的免疫細胞,并顯示高mRNA表達。通過用陽離子替代物代替輔助脂質,可以將藥物靶向從肝臟轉移至肺部。例如,將DOTAP替代DOPE后,肝臟與肺部的蛋白質表達比從36:1變為1:56。
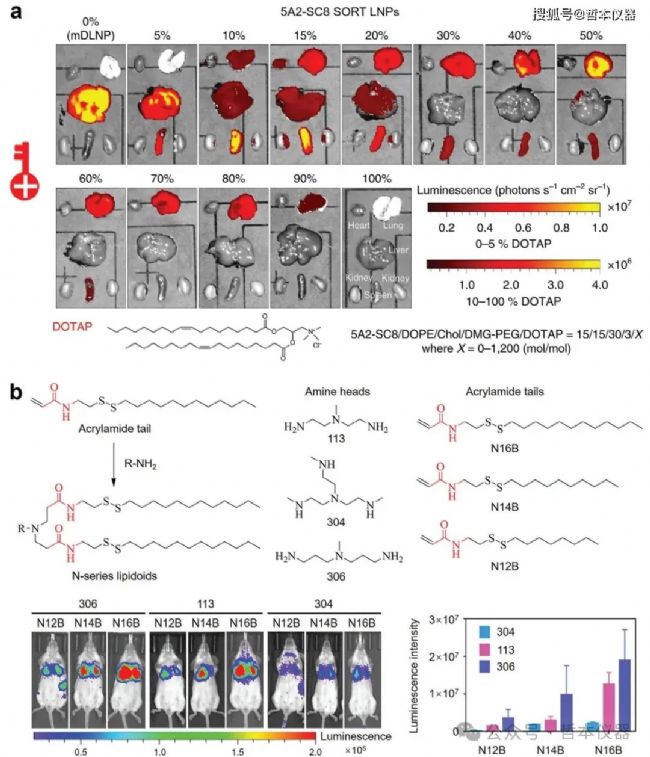
圖1 肺部LNP遞送設計策略
另一種方法是將含酯連接基的可電離脂質替換為含酰胺連接基的類脂質,實現肺靶向。例如,306-N16B LNP專門將mRNA遞送至肺部。改變N系列LNP的胺頭化學結構也會影響其亞細胞轉染效率,當與Cre mRNA復合時,306-N16B LNP能轉染33.6%的肺內皮細胞,而113-N16B LNP則能影響約69.6%的內皮細胞(圖1b)。
淋巴器官
二級淋巴器官(SLO),如脾臟和淋巴結,對啟動適應性免疫至關重要。將RNA遞送至SLO中的免疫細胞,可以用于癌癥和自身免疫疾病的免疫治療。SORT LNP通過添加陰離子脂質(如14PA、18BMP、18PA)到四組分LNP配方中,實現脾靶向(圖2a)。30% 18PA的SORT LNP能夠專門針對脾臟轉導約12%的B細胞、10%的T細胞和20%的巨噬細胞。此外,利用18PA SORT LNP共同傳遞Cas9 mRNA和sgPTEN,實現了在小鼠脾臟中進行PTEN編輯,但這也在肝臟和腎臟誘導了tdTomato表達。
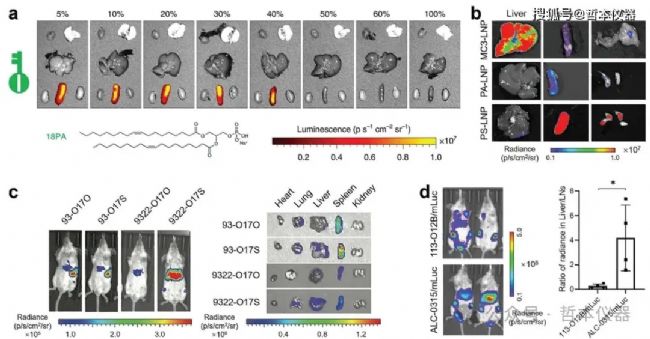
圖2 用于淋巴器官遞送的 LNP 設計策略
對比9A1P9和10A1P16制劑,后者顯示出更佳的遞送效率,能夠轉染約30%的巨噬細胞和6%的B細胞。用磷脂酰絲氨酸(PS)替代DOPE,可以將肝臟靶向轉移至脾臟,蛋白表達比例由8:1變為1:3。此外,將PS添加到基于MC3的Onpattro LNP中,可使其靶向淋巴結和脾臟(圖2b)。
通過仿生策略,向LNP中添加PS,促進單核細胞和巨噬細胞的內吞,提高了遞送至SLO的效率。由于脾臟內有豐富的免疫細胞,它是工程免疫細胞治療的關鍵靶點。目前的策略多依賴于體外工程的免疫細胞,直接遞送RNA至原代T淋巴細胞仍具挑戰。
此外,還有人報道了一種含咪唑類脂質的LNP,能夠在靜脈注射后特異性遞送mRNA至CD8+ T淋巴細胞,實現了8.2%的基因重組。采取靶向脾臟的SORT LNP還可轉染脾T細胞,原位生成CAR-T細胞,從而提高小鼠的存活率,減少腫瘤轉移(圖2c)。
將RNA遞送至淋巴結同樣關鍵。最近的一項研究顯示,通過皮下注射將癌癥抗原mRNA遞送至淋巴結,能夠強烈刺激免疫反應以消除癌癥,同時最大限度地減少其他脫靶組織的積累,降低免疫介導的肝損傷風險(圖2d)。
骨遞送
骨骼被視為多種疾病基因療法的關鍵靶點。骨髓中的異常造血干細胞(HSC)會導致血液和免疫疾病,目前的治療方法主要是通過基因工程或健康HSC替代病態HSC,但這一策略存在嚴重副作用且進入難度大。盡管骨骼血管化程度高,但由于血流量低、血液-骨髓界面的物理屏障以及藥物對骨礦物質親和力低,使得全身給藥的生物利用度有限。
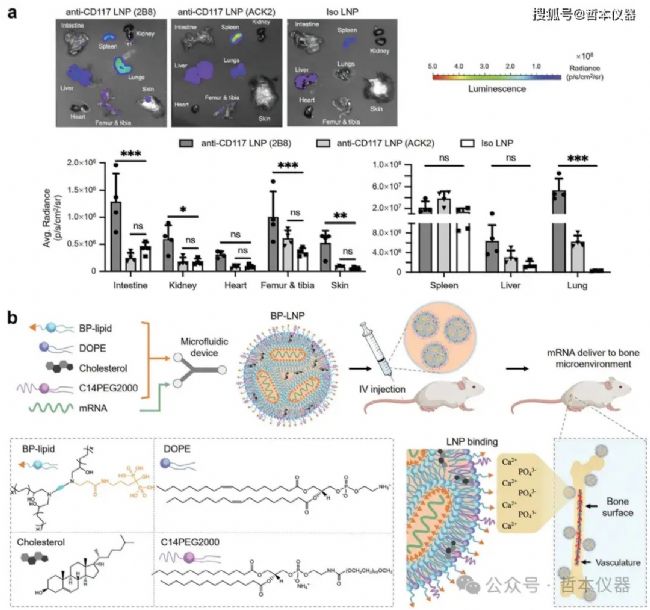
圖3 骨遞送LNP的設計策略
近年來,通過將CD117抗體綴合到LNP表面,實現了主動骨靶向。例如,CD117 LNP可以有效遞送siRNA和mRNA至小鼠HSC,使約90%的HSC和祖細胞實現基因重組(圖3a)。此外,CD117 LNP促進了堿基編輯系統在骨髓中的傳遞,實現對造血鐮狀細胞的幾乎完全校正。
為了解決骨靶向的生物障礙,Xue等人設計了一系列對骨礦物質具有高親和力的二磷酸脂材料。研究發現,二磷酸鹽LNP增強了mRNA向骨骼的遞送(圖3b)。經過高通量篩選,含低聚物脂質7C1、PEG-脂質、膽固醇和輔助脂質的BM1 LNP被鑒定為具備骨髓向性。值得注意的是,BM1的骨髓向性受PEG脂質的烷基長度、分子量和膽固醇的化學性質影響,而LNP的大小影響不大。BM1能夠特異性遞送ICAM-2 siRNA和sgRNA至骨髓內皮細胞(BMEC),分別導致37%的沉默和15%的插入缺失。
腦靶向遞送
血腦屏障(BBB)對全身給藥后的高分子量、親水性大分子的輸送至中樞神經系統(CNS)提出了重大挑戰。盡管遞送技術不斷進步,跨越血腦屏障仍然是納米療法面臨的主要難題。雖然一些利用BBB頂膜內皮細胞受體的策略正在取得進展,但基于LNP的腦靶向RNA遞送的實例仍然有限。
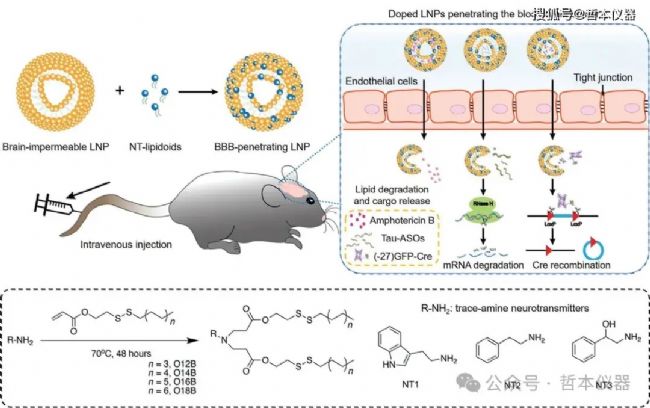
圖4 大腦靶向LNP設計
在一項研究中,研究人員將神經遞質衍生的類脂質摻雜到LNP中,從而成功將反義寡核苷酸遞送到大腦(圖4)。此外,在另一項研究中,糖基化聚合物納米顆粒能夠穿越BBB,并通過葡萄糖轉運蛋白1(Glut1)在禁食條件下將siRNA遞送至大腦。
胰腺遞送
向胰腺提供治療藥物以應對癌癥和糖尿病等難治性胰腺疾病具有重要意義。盡管已有研究利用病毒遞送系統成功將基因遞送至胰腺,但將RNA-LNP有效遞送至胰腺細胞仍然面臨挑戰。
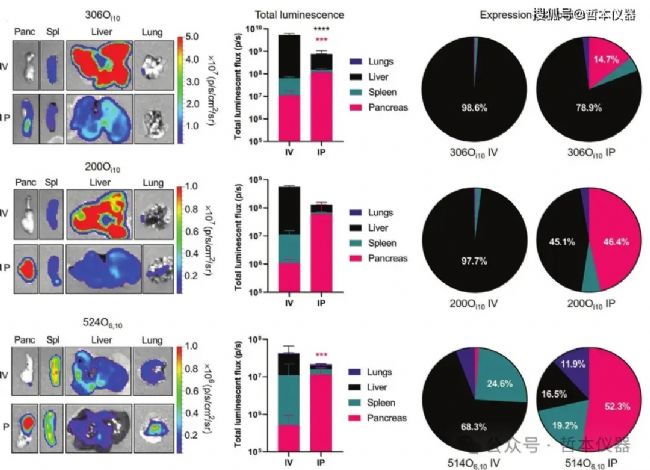
圖5 與靜脈注射相比,腹腔給藥 mRNA-LNP 有助于遞送至胰腺
最近,有研究發現,含有陽離子輔助脂質的LNP在腹膜內給藥后能夠有效遞送mRNA至胰腺,并產生穩定且特異性的蛋白質表達(圖5)。這一研究顯示,主要的蛋白質表達發生在產生胰島素的細胞內。此外,研究還表明,腹膜巨噬細胞外泌體的分泌水平在基因轉移的過程中對向胰腺的遞送起著決定性作用。
RNA-LNP 遞送至肝外器官的機制
納米粒子進入體循環后,會吸附血清蛋白和生物分子,形成生物分子冠,從而降低其表面張力。這一生物分子冠被認為決定了器官選擇性靶向。最近研究表明,LNP的表面特性會影響生物分子冠的組成及LNP的去向。例如,SORT-LNP的表觀pKa決定其生物分子冠的特征:當pKa < 6時,𝛽2-糖蛋白I有利于脾臟靶向;pKa 6-7時,ApoE促進肝臟靶向;而pKa > 9.25時,玻連蛋白則促進肺靶向(圖6b)。
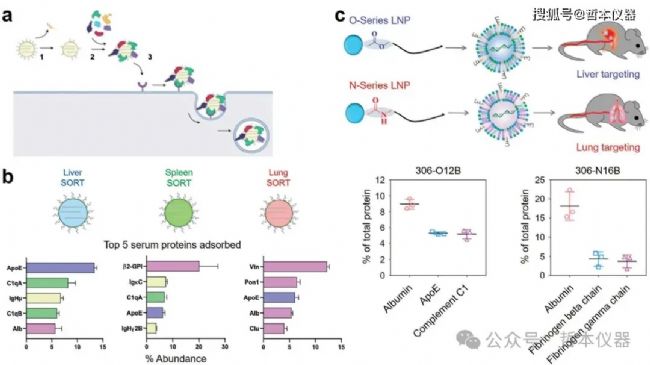
圖6 生物分子冠介導的肝外器官選擇性 RNA-LNP 遞送
此外,脂質賦形劑的化學性質也會影響生物分子冠。例如,酰胺連接體替代可電離脂質中的酯連接體可改變靶器官,從肝臟轉移到肺部。盡管在LNP上,白蛋白往往是主要成分,但其他成分如ApoE和纖維蛋白原的豐度可能因LNP的類型而異(圖6c)。改變SORT脂質的化學結構可能會稍微改變每種成分的比例,從而影響LNP的靶向能力。
盡管生物分子冠在選擇性靶向中扮演重要角色,但其機制仍不明確。現有的正向機制表明,冠中某些成分控制器官靶向,但新研究質疑這種簡化的理解。未來需要深入研究,包括生物分子冠是否僅由蛋白質驅動,以及其成分和構象如何影響靶向。此外,探索體內動態形成的生物冠成分和開發能量或結構上可變的合成冠的策略也是未來研究的重點。






