上皮細胞在類器官中的功能及在類器官構建中的作用
上皮細胞:類器官構建的核心驅動力
上皮細胞作為人體組織的重要組成部分,廣泛分布于皮膚、消化道、呼吸道等部位,承擔著屏障保護、物質吸收、分泌和信號傳遞等多種生理功能。近年來,隨著類器官技術的快速發展,上皮細胞在類器官構建中的核心作用日益凸顯,成為這一領域研究的焦點。
類器官(Organoids)是一種在體外培養的三維微型器官模型,能夠高度模擬真實器官的結構和功能。而上皮細胞正是類器官構建的“基石”。例如,腸道類器官的構建依賴于腸道上皮干細胞(Lgr5+細胞),這些細胞具有強大的自我更新和分化能力,能夠在體外形成包含隱窩-絨毛結構的迷你腸道。類似地,肺部類器官、肝臟類器官和腎臟類器官的構建也離不開相應部位的上皮細胞。
上皮細胞在類器官中的重要性不僅體現在其結構構建上,還在于其功能性表達。
上皮細胞在類器官中的功能
上皮細胞在類器官中不僅提供了結構支持,還承擔了器官的特定功能。例如:
腸上皮細胞在類器官中的功能
哺乳動物胃腸道中存在著大量先天性免疫細胞和適應性免疫細胞,以及數以萬億計的有益共生微生物,這些細胞需要屏障和調節機制來保護宿主與微生物之間的相互作用以及組織的平衡。這種平衡依賴于腸上皮細胞(IECs)的多種功能,其中包括共生細菌的物理隔離和微生物信號的整合。因此,腸上皮細胞是腸道平衡的關鍵介質,它能建立一個有利于共生細菌定植的免疫環境。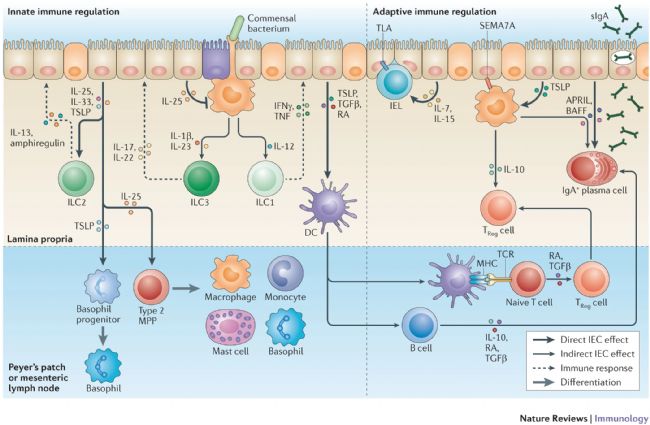
圖1.IECs 可調節先天性免疫和適應性免疫
2009 年 Sato 等人成功分離了單個 Lgr5+ 腸道干細胞 , 并將其與基質膠混合,同時添加幾種必需生長因子 EGF,Noggin,Wnt和 R-spondin1等,發現 Lgr5+ 干細胞能夠長成球狀 3D結構,這便是最早的類器官。
研究表明腸道類器官內部具有完整的腸道上皮結構,而且含有所有種類的腸上皮功能細胞,包括腸上皮各類細胞。腸道類器官含有多個隱窩結構,并相互連接形成中間有腸腔的迷你腸。每個類器官的隱窩含有與體內隱窩相似的 Lgr5+ 干細胞數量。干細胞分化出所有種類的細胞,這些細胞沿隱窩底部向絨毛部分遷移,并最終脫落進入腔。類器官長大成熟后,可通過出芽的方式形成更多的類器官,并可持續傳代培養并保持基因組穩定。腸道類器官具有與體內隱窩類似的結構,底部干細胞與潘氏細胞間隔排列,其上是 TA 細胞和成熟細胞。這些隱窩結構由單層的類似絨毛細胞的結構相連接,同樣有沿隱窩底部向絨毛部分的細胞遷移,死亡細胞從絨毛部分脫落進入腔。腸道類器官可以在培養皿內連續傳代培養數月以上,而不失去原本體內隱窩的特性,始終具有正常的染色體數。表達譜分析也表明,培養的類器官和剛分離的新鮮隱窩的表達譜非常類似,且與隱窩的來源保持一致。
此外,上皮細胞與類器官技術的結合還為再生醫學帶來了新的希望。通過基因編輯技術對上皮細胞進行修飾,科學家可以構建功能增強的類器官,為器官移植和損傷修復提供潛在的解決方案。
綜上所述,上皮細胞不僅是類器官構建的核心驅動力,更是推動類器官技術在基礎研究、疾病治療和再生醫學中廣泛應用的關鍵因素。隨著技術的不斷進步,上皮細胞與類器官的結合必將為生命科學和醫學領域帶來更多突破性進展。
參考文獻:
上皮細胞作為人體組織的重要組成部分,廣泛分布于皮膚、消化道、呼吸道等部位,承擔著屏障保護、物質吸收、分泌和信號傳遞等多種生理功能。近年來,隨著類器官技術的快速發展,上皮細胞在類器官構建中的核心作用日益凸顯,成為這一領域研究的焦點。
類器官(Organoids)是一種在體外培養的三維微型器官模型,能夠高度模擬真實器官的結構和功能。而上皮細胞正是類器官構建的“基石”。例如,腸道類器官的構建依賴于腸道上皮干細胞(Lgr5+細胞),這些細胞具有強大的自我更新和分化能力,能夠在體外形成包含隱窩-絨毛結構的迷你腸道。類似地,肺部類器官、肝臟類器官和腎臟類器官的構建也離不開相應部位的上皮細胞。
上皮細胞在類器官中的重要性不僅體現在其結構構建上,還在于其功能性表達。
上皮細胞在類器官中的功能
上皮細胞在類器官中不僅提供了結構支持,還承擔了器官的特定功能。例如:
- 腸道類器官:上皮細胞負責吸收和分泌功能,類器官中的杯狀細胞分泌黏液,潘氏細胞分泌抗菌肽。
- 胃類器官:上皮細胞分泌胃酸和消化酶,模擬胃的消化功能。
- 肝臟類器官:上皮細胞(肝細胞)負責代謝和解毒功能,類器官可以模擬肝臟的代謝活動。
- 肺類器官:上皮細胞(如纖毛細胞和肺泡細胞)負責氣體交換和黏液清除功能。
腸上皮細胞在類器官中的功能
哺乳動物胃腸道中存在著大量先天性免疫細胞和適應性免疫細胞,以及數以萬億計的有益共生微生物,這些細胞需要屏障和調節機制來保護宿主與微生物之間的相互作用以及組織的平衡。這種平衡依賴于腸上皮細胞(IECs)的多種功能,其中包括共生細菌的物理隔離和微生物信號的整合。因此,腸上皮細胞是腸道平衡的關鍵介質,它能建立一個有利于共生細菌定植的免疫環境。
- 腸上皮細胞(IECs)提供了一道物理和生化屏障,隔離宿主組織和共生細菌,維持腸道平衡。分泌型 IEC 通過分泌粘蛋白和抗菌肽來支持這一功能。
- IECs 保持著專門的途徑,將管腔抗原和細菌傳遞給固有層抗原遞呈細胞。
- IECs 可識別微生物信號,促進腸道平衡。宿主與共生微生物之間的相互作用不僅支持損傷或急性炎癥情況下的組織修復,還能在慢性炎癥期間促進腸癌的發展。
- IECs 具有維持對微生物信號的反應性改變的機制,可耐受與共生細菌的持續接觸。
- IECs 向粘膜免疫細胞傳遞微生物信號,并促進針對普通細菌和腸道病原體的適當免疫反應的協調。抗原遞呈細胞和 IECs 之間的相互作用調節著作用于腸道屏障的 B 細胞和 T 細胞反應。
- 先天性和適應性效應細胞的功能和穩態都受到 IEC 衍生信號的影響。這使得 IECs 能夠局部調節腸屏障的免疫反應,并促進腸道平衡的維持。

圖1.IECs 可調節先天性免疫和適應性免疫
2009 年 Sato 等人成功分離了單個 Lgr5+ 腸道干細胞 , 并將其與基質膠混合,同時添加幾種必需生長因子 EGF,Noggin,Wnt和 R-spondin1等,發現 Lgr5+ 干細胞能夠長成球狀 3D結構,這便是最早的類器官。
研究表明腸道類器官內部具有完整的腸道上皮結構,而且含有所有種類的腸上皮功能細胞,包括腸上皮各類細胞。腸道類器官含有多個隱窩結構,并相互連接形成中間有腸腔的迷你腸。每個類器官的隱窩含有與體內隱窩相似的 Lgr5+ 干細胞數量。干細胞分化出所有種類的細胞,這些細胞沿隱窩底部向絨毛部分遷移,并最終脫落進入腔。類器官長大成熟后,可通過出芽的方式形成更多的類器官,并可持續傳代培養并保持基因組穩定。腸道類器官具有與體內隱窩類似的結構,底部干細胞與潘氏細胞間隔排列,其上是 TA 細胞和成熟細胞。這些隱窩結構由單層的類似絨毛細胞的結構相連接,同樣有沿隱窩底部向絨毛部分的細胞遷移,死亡細胞從絨毛部分脫落進入腔。腸道類器官可以在培養皿內連續傳代培養數月以上,而不失去原本體內隱窩的特性,始終具有正常的染色體數。表達譜分析也表明,培養的類器官和剛分離的新鮮隱窩的表達譜非常類似,且與隱窩的來源保持一致。
此外,上皮細胞與類器官技術的結合還為再生醫學帶來了新的希望。通過基因編輯技術對上皮細胞進行修飾,科學家可以構建功能增強的類器官,為器官移植和損傷修復提供潛在的解決方案。
綜上所述,上皮細胞不僅是類器官構建的核心驅動力,更是推動類器官技術在基礎研究、疾病治療和再生醫學中廣泛應用的關鍵因素。隨著技術的不斷進步,上皮細胞與類器官的結合必將為生命科學和醫學領域帶來更多突破性進展。
參考文獻:
- Sato, T., et al. (2009). Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature, 459(7244), 262-265.
- Clevers, H. (2016). Modeling Development and Disease with Organoids. Cell, 165(7), 1586-1597.
- Drost, J., & Clevers, H. (2018). Organoids in cancer research. Nature Reviews Cancer, 18(7), 407-418.
- Lancaster, M. A., & Knoblich, J. A. (2014). Organogenesis in a dish: Modeling development and disease using organoid technologies. Science, 345(6194), 1247125.
- Peterson, L. W., & Artis, D. (2014). Intestinal epithelial cells: regulators of barrier function and immune homeostasis. Nature Reviews Immunology, 14(3), 141-153.
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com






