基于mRNA-LNP的體內CAR-T對天然/適應性免疫的系統性調控作用研究
文章來源公眾號:大魚科學 作者:大魚科學
細胞治療領域正面臨多條技術路徑的比較——“通用型”與“體內制備”之爭,以及“病毒載體”與“LNP遞送”之選。其中,基于LNP遞送mRNA在體內生成靶向CD19 CAR-T的研究,已率先進入臨床試驗階段,并顯示出一定的B細胞清除效果。盡管該技術的作用機制看似僅是對體外CAR-T制備方式的簡單轉換,但最新研究提示,采用mRNA-LNP技術路線時,可能需要額外考量一個潛在因素——mRNA本身所具有的佐劑效應。
01 新冠mRNA疫苗:意想不到的作用
一項回顧性研究分析了接受免疫檢查點抑制劑治療的黑色素瘤或非小細胞肺癌患者。結果顯示,在ICI治療啟動后100天內接種新冠mRNA疫苗的患者,其腫瘤治療反應及生存期均顯著改善(圖1)。尤其在非小細胞肺癌患者中,接種疫苗組的中位生存期從20.6個月延長至37.3個月。
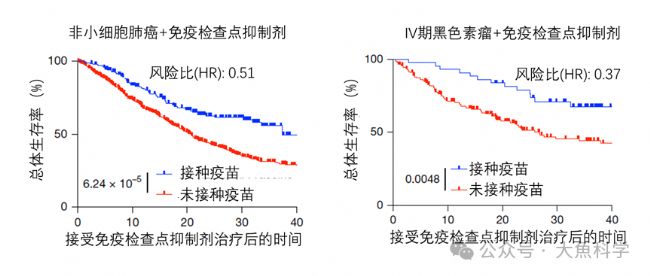
圖1. 新冠mRNA疫苗接種與腫瘤患者生存期的關聯分析。在接受免疫檢查點抑制劑(ICI)治療100天內接種新冠mRNA疫苗的患者(藍色曲線)展現出更高的總體生存率。
02 廣泛誘導的系統性抗腫瘤免疫
研究人員在小鼠模型中成功復現了這一臨床現象:新冠mRNA疫苗與ICI聯用可顯著延緩腫瘤進展。該協同效應與干擾素α水平升高(圖2A)、脾臟及淋巴結中腫瘤抗原遞呈細胞數量增加(圖2B),以及脾臟和腫瘤組織中腫瘤特異性T細胞擴增(圖2C)密切相關,且在多種腫瘤類型中均觀察到類似效果。
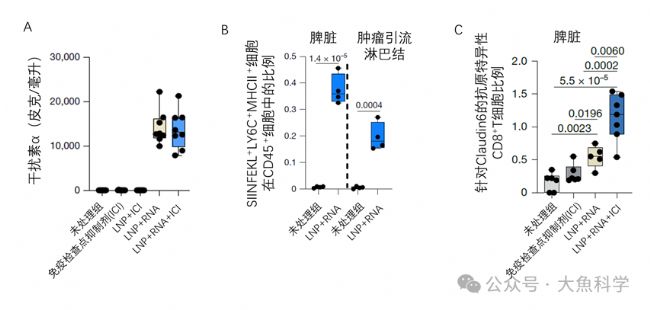
圖2. mRNA-LNP誘導的系統性抗腫瘤免疫應答(小鼠模型)。mRNA-LNP注射可顯著提升干擾素-α分泌水平(A),增加腫瘤抗原遞呈細胞數量(B),并促進腫瘤特異性T細胞的擴增(C)。
值得注意的是,新冠mRNA疫苗本身并不引發腫瘤特異性T細胞的交叉反應。因此,上述現象實際反映了mRNA疫苗對抗腫瘤免疫的系統性增強——涵蓋天然免疫與適應性免疫、涉及外周淋巴組織與腫瘤微環境。這一發現也與作者此前關于脾臟內存在抗腫瘤免疫調控的觀察相吻合。
03 對體內細胞治療的啟示
無論靶點、形式如何,當采用LNP-mRNA作為載體在體內生成CAR-T或CAR-NK細胞時,其對天然免疫和適應性免疫的系統性調控作用依然存在。
這是一把雙刃劍:對腫瘤患者而言,廣泛激活抗腫瘤免疫無疑具有積極意義;然而對于自身免疫性疾病患者,mRNA疫苗所誘導的干擾素水平升高、T細胞廣泛活化等現象,是否會導致額外的不良事件、并干擾靶向細胞的清除效果,仍有待明確。
正在進行的針對系統性紅斑狼瘡的LNP-mRNA CAR-T臨床試驗,或許將為這一問題提供更多線索。






