T細胞融合脂質體賦予過繼性T細胞免疫功能以增強實體瘤治療效果的研究
文章來源公眾號:iNature 作者:iNature
過繼性T細胞療法在部分血液系統腫瘤中已取得顯著成效,但針對實體瘤的療效仍受多重免疫學挑戰限制,如T細胞腫瘤浸潤不足、腫瘤細胞免疫耐受及免疫抑制性腫瘤微環境(TME)等問題。2025 年 10 月 7 日,中山大學李明強、陶玉和吉林大學姚浩琛共同通訊在Advanced Materials在線發表題為“Immuno-Packed T-Cell-Fusogenic Liposome Empowers Adoptive T Cell Therapy for Solid Tumor Treatment”的研究論文。該研究報道了一種一步式細胞工程策略,通過“免疫包裹型T細胞融合脂質體(IMPACTFUL)”增強實體瘤的T細胞治療效果。借助膜融合作用,IMPACTFUL可同時實現兩項功能:一是在治療性T細胞表面修飾DPPA肽,二是將載有白細胞介素-12(IL-12)mRNA的磁性納米顆粒(MNP/IL-12)遞送至T細胞胞質內。
其中,MNP/IL-12的內化使T細胞具備兩大優勢:在外部磁場作用下高效靶向腫瘤,同時通過表達IL-12逆轉腫瘤微環境;而T細胞表面呈現的DPPA肽則能通過PD-L1checkpoint阻斷(免疫檢查點阻斷),幫助T細胞突破腫瘤細胞的免疫耐受。在小鼠實體瘤模型中,經IMPACTFUL改造的T細胞展現出更優的腫瘤浸潤能力,能有效抵抗T細胞耗竭,并誘導形成更利于抗腫瘤的促炎型腫瘤微環境。與未修飾T細胞相比,其對腫瘤生長的抑制效果顯著增強。綜上,IMPACTFUL可通過一步操作賦予T細胞多種互補功能,從而強化過繼性T細胞療法的療效。該策略為提升T細胞療法對實體瘤的治療效果提供了多功能平臺,有望推動其向臨床轉化的進程。
過繼性T細胞輸注療法通過提取患者來源的T細胞、進行體外工程改造與擴增,再回輸至患者體內,已在部分血液系統腫瘤治療中展現出優勢,其中嵌合抗原受體T細胞(CAR-T)療法的效果尤為顯著。然而,該療法針對實體瘤的療效仍不盡人意,主要受T細胞向腫瘤組織浸潤不足、腫瘤細胞誘導的免疫耐受以及免疫抑制性腫瘤微環境(TME)的制約。過繼轉移的T細胞的有效浸潤受到血管內皮屏障和T細胞上缺乏粘附分子的阻礙,即便T細胞成功浸潤,腫瘤細胞通過上調免疫檢查點蛋白等逃避免疫識別的機制,也會削弱T細胞的殺傷效力。此外,腫瘤微環境中普遍存在的免疫抑制性細胞因子與調節性免疫細胞,也會抑制回輸T細胞的活化與增殖。因此,亟需一種能為T細胞賦予多重功能、同步解決上述問題的T細胞工程策略,以提升實體瘤治療效果。
近年來,研究人員已開發出多種為過繼性T細胞賦予特定功能的策略,用于實體瘤治療。如將磁性納米顆粒(MNP)導入T細胞后,可在外部磁場引導下促進T細胞向實體瘤內浸潤,或通過肽、適配體等分子對T細胞表面進行修飾,使其能靶向腫瘤相關免疫檢查點,主動識別并對抗腫瘤細胞的免疫耐受機制。此外,還可通過核酸載體改造T細胞,使其表達促炎細胞因子,通過抑制免疫抑制性細胞因子功能、招募抗腫瘤免疫細胞、減少調節性免疫細胞數量,緩解腫瘤微環境的免疫抑制狀態。然而,這些策略均聚焦于單一功能,僅能為T細胞賦予某一種能力,無法同時應對實體瘤帶來的復雜挑戰。構建兼具高效腫瘤浸潤、突破免疫耐受、逆轉免疫抑制微環境三重功能的多能T細胞,已成為重要研究目標。由于單一T細胞內不同改造靶點的亞細胞定位存在差異,現有工程改造過程耗時費力,嚴重阻礙了多能T細胞的開發。因此,迫切需要建立一個集成化T細胞工程平臺,實現對T細胞內不同亞細胞區域多個靶點的同步修飾,從而賦予其全面抗腫瘤功能。
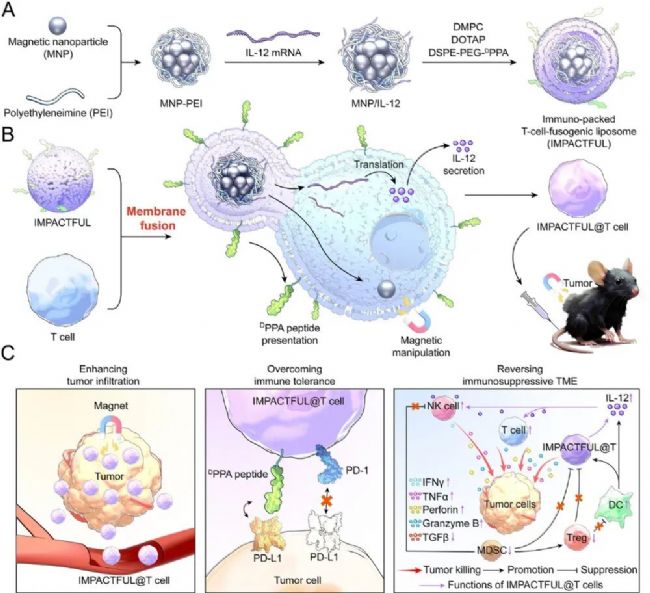
圖1 免疫包裹型T細胞融合脂質體改造過繼性T細胞的流程及作用機制示意圖(摘自Advanced Materials)
近期,該團隊報道了一種基于膜融合的一步式細胞工程策略,可用于構建多能細胞。該策略采用核-殼結構的融合性脂質體,這類脂質體能夠與細胞質膜發生融合。融合過程中,脂質體的脂質殼層會整合到細胞膜中,同時將其核心內容物遞送至細胞質內。借助脂質體核、殼組分的獨特分布特性,這種融合性脂質體可簡化對不同亞細胞定位靶點的改造流程,有望高效構建多能T細胞。
該研究開發了一種“免疫包裹型T細胞融合脂質體(IMPACTFUL)”,用于構建兼具高效腫瘤浸潤、突破腫瘤免疫耐受、調控免疫抑制微環境功能的多能T細胞。該IMPACTFUL系統由兩部分構成:一是修飾有DPPA肽的融合性脂質層,二是由聚乙烯亞胺包覆的磁性納米顆粒(MNP-PEI)與白細胞介素-12(IL-12)mRNA形成的核心(MNP/IL-12)。當IMPACTFUL與T細胞膜融合后,修飾有DPPA肽的脂質層會錨定在T細胞表面,同時MNP/IL-12核心會被釋放到T細胞胞質中,形成經IMPACTFUL改造的T細胞(IMPACTFUL@T細胞)。回輸體內后,IMPACTFUL@T細胞可借助胞內磁性納米顆粒,在外部磁場引導下向腫瘤區域富集。隨后,其表面呈現的DPPA主動靶向肽能阻斷腫瘤細胞表面的PD-L1免疫檢查點,增強T細胞的細胞毒性。同時,IMPACTFUL@T細胞表達的IL-12可逆轉免疫抑制性腫瘤微環境,激活腫瘤浸潤免疫細胞的抗腫瘤免疫功能。在B16F10荷瘤小鼠模型中,經IMPACTFUL改造的多能T細胞可使腫瘤生長顯著延緩82.3%;與抗PD-1療法聯合使用時,還能產生協同抗腫瘤效果。綜上,IMPACTFUL有望成為優化T細胞改造的集成化平臺,進而提升免疫療法對實體瘤的治療效果。
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com






