crRNA驅(qū)動級聯(lián)反應實現(xiàn)ctDNA中PIK3CA H1047R突變的超靈敏檢測
循環(huán)腫瘤DNA(ctDNA)作為癌癥早期診斷和動態(tài)監(jiān)測的關鍵生物標志物,其超靈敏檢測面臨核心挑戰(zhàn)。早期患者ctDNA突變等位基因頻率(VAF)常低于0.1%,而傳統(tǒng)組織活檢因侵入性風險、腫瘤異質(zhì)性及樣本可及性限制難以滿足實時監(jiān)測需求。現(xiàn)有高靈敏度技術如液滴數(shù)字PCR(ddPCR)和二代測序(NGS)雖可檢測低豐度突變,但前者依賴熱循環(huán)儀與復雜設備,后者需繁瑣的文庫構(gòu)建和生物信息學分析,且成本高昂,難以適配床旁檢測場景。等溫擴增技術雖規(guī)避了熱循環(huán)限制,卻易受非特異性擴增干擾,制約檢測準確性。
CRISPR/Cas系統(tǒng)憑借高特異性靶向能力為分子診斷帶來突破,其中Cas14a因其最小化結(jié)構(gòu)、單鏈DNA特異性切割及無需PAM序列的特性,展現(xiàn)出優(yōu)于Cas12a的識別穩(wěn)定性。然而,CRISPR直接檢測靈敏度通常僅達皮摩爾級,難以滿足早期癌癥ctDNA檢測需求。研究通過創(chuàng)新性整合RPA擴增與CRISPR/Cas14a系統(tǒng),利用二者最適溫度匹配的特性,構(gòu)建雙重優(yōu)化機制,RPA實現(xiàn)目標指數(shù)富集提升靈敏度,Cas14a特異性切割消除非特異背景信號,為超靈敏檢測奠定基礎。
乳腺癌全球年新發(fā)病例超230萬,PIK3CA H1047R突變通過組成性激活PI3Kα通路驅(qū)動內(nèi)分泌治療耐藥,其早期檢測對改善預后至關重要。基于此,哈爾濱醫(yī)科大學附屬腫瘤醫(yī)院乳腺外科龐達、張顯玉團隊在這項研究中,通過T7酶選擇性消化RPA擴增產(chǎn)物反義鏈,實現(xiàn)無熱循環(huán)的ssDNA轉(zhuǎn)化;進一步采用工程化crRNA設計合成單核苷酸錯配,將CRISPR/Cas14a單堿基分辨率應用于PIK3CA H1047R突變特異性識別,在32例臨床樣本中實現(xiàn)與ddPCR相當?shù)?00%敏感性與特異性,且檢測限達0.01%。該系統(tǒng)結(jié)合數(shù)字微流控芯片,可在37℃下60分鐘內(nèi)完成檢測,為精準腫瘤學提供可擴展的床旁診斷平臺。研究成果發(fā)表于“Advanced science”期刊,題為“Engineered crRNA Drives RPA-T7-CRISPR/Cas14a Cascade for Ultrasensitive Detection of ctDNA PIK3CA H1047R”。

首先,為了滿足ctDNA中SNP的超靈敏檢測,研究人員開發(fā)了TIDE-Cas14a系統(tǒng)。從血漿提取的ctDNA直接加入包含RPA擴增試劑、T7外切酶、Cas14a蛋白及工程化crRNA的預混體系。先將RPA在37℃等溫條件下對目標序列進行指數(shù)級擴增,生成雙鏈DNA(dsDNA)產(chǎn)物;隨后,T7外切酶特異性降解磷酸化修飾的反義鏈,保留PT修飾的正義鏈,完成無需熱循環(huán)的ssDNA轉(zhuǎn)化。關鍵在于crRNA的合成錯配設計,通過在非種子區(qū)引入單核苷酸取代,顯著增強Cas14a/crRNA-ssDNA復合物對靶標結(jié)合的特異性,即使野生型與突變序列同源性超99.9%,系統(tǒng)仍能精準識別PIK3CA H1047R等單堿基變異。靶標結(jié)合觸發(fā)Cas14a的側(cè)切活性,切割ssDNA熒光探針,釋放可實時檢測的熒光信號。進一步結(jié)合數(shù)字微流控芯片技術,將反應體系分割為10^5個納米級液滴進行并行檢測,通過熒光顯微鏡定量陽性信號比例,使靈敏度提升至attomolar級別,檢測全程在60分鐘內(nèi)完成,且與ddPCR相比展現(xiàn)出100%的臨床符合率。
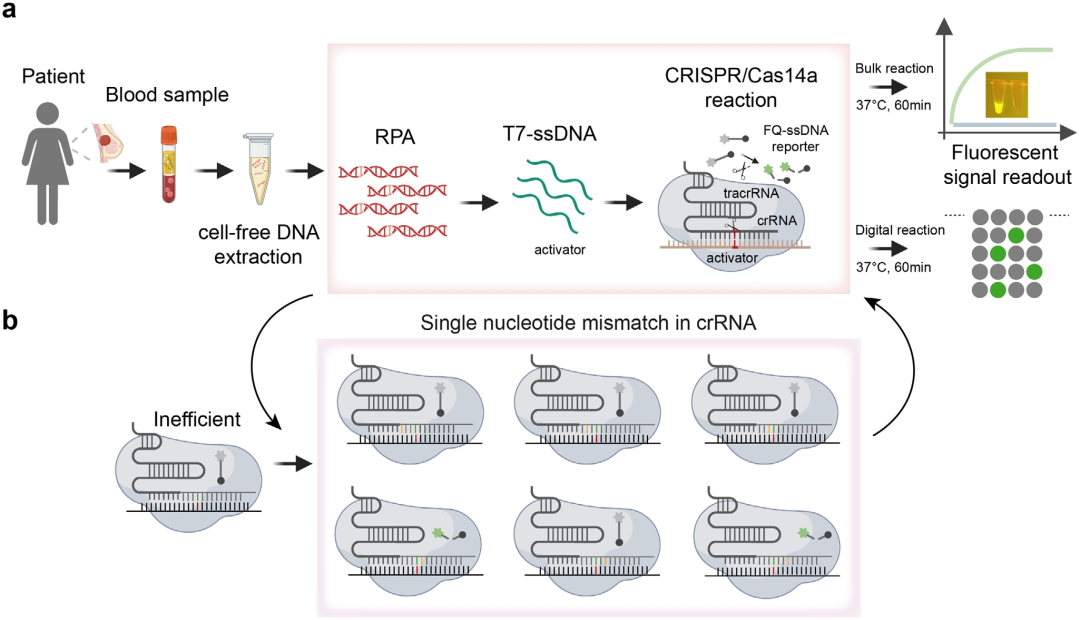
圖1 TIDE-Cas14a系統(tǒng)的工作流程
然后,為提升PIK3CA H1047R突變檢測特異性,研究人員將合成錯配策略應用于Cas14a系統(tǒng)。基于Cas14a對種子區(qū)堿基高度敏感的特性,通過系統(tǒng)引入單核苷酸錯配優(yōu)化crRNA設計(圖2B)。在SNP位點上下游7個位置構(gòu)建六種crRNA變體,實驗發(fā)現(xiàn)+1或+3位點引入錯配可顯著增強突變體/野生型區(qū)分能力(圖2D-I)。其中+1位點錯配crRNA使信噪比提升三倍,被選為PIK3CA檢測最優(yōu)方案。
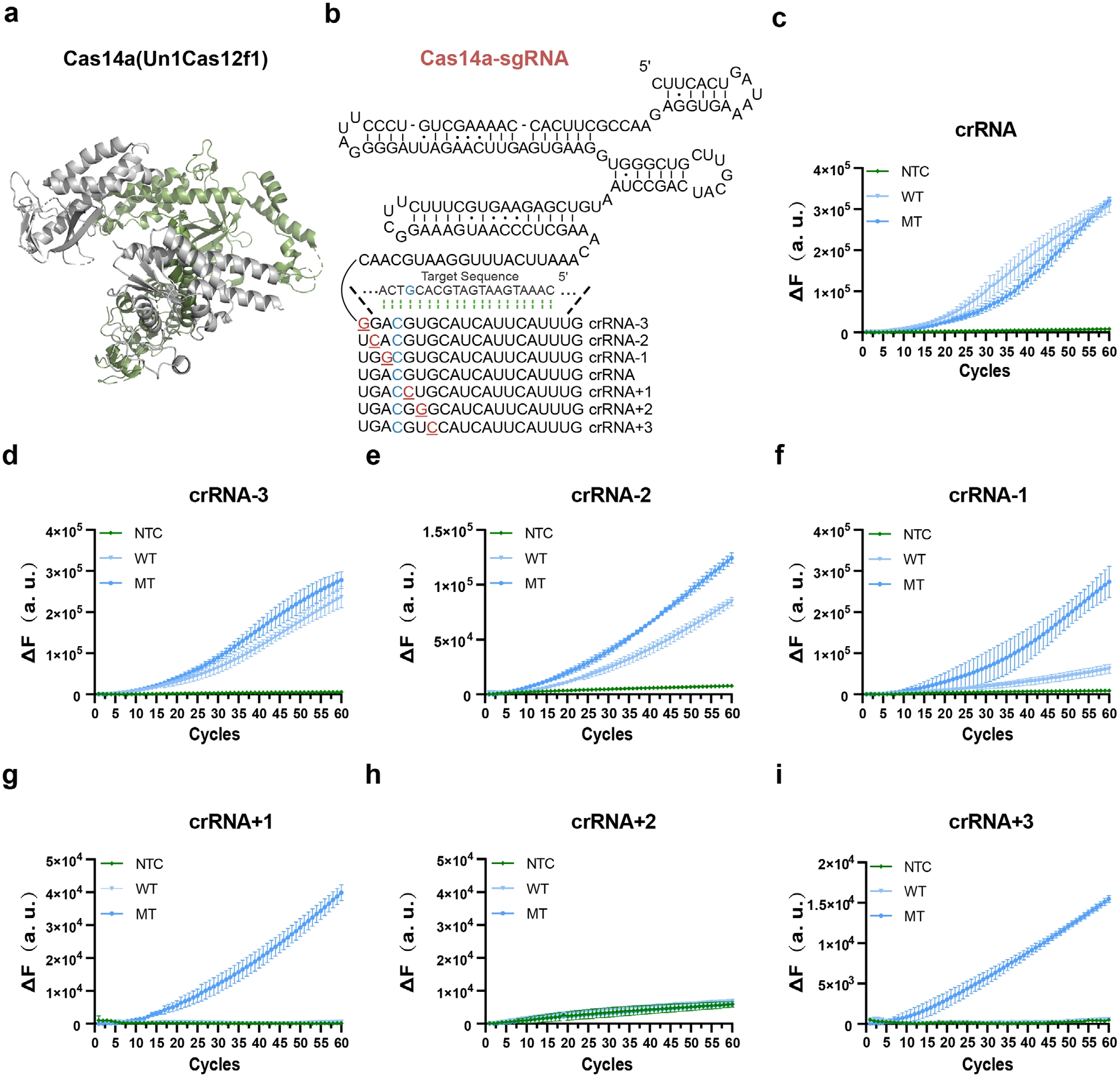
圖2 通過對crRNA進行工程化改造以提高信噪比
為了驗證該策略的實用型,進一步驗證于肺癌和結(jié)直腸癌關鍵驅(qū)動突變。研究人員采用了相同的crRNA設計原理,在肺和結(jié)直腸癌中進行關鍵的致癌突變,包括EGFR T790M、EGFR L858R、BRAF V600E及KRAS G12V,均實現(xiàn)單堿基分辨(圖3B/D/F/H)。分子對接模擬顯示含錯配crRNA的三元復合物結(jié)合野生型DNA時對接評分顯著降低,表明其結(jié)合能下降。尤其對于EGFR L858R,原始crRNA與錯配crRNA-2均能有效區(qū)分突變,與對接評分未顯著變化的現(xiàn)象一致,證實錯配設計通過破壞Cas14a與野生型序列的親和力提升特異性。
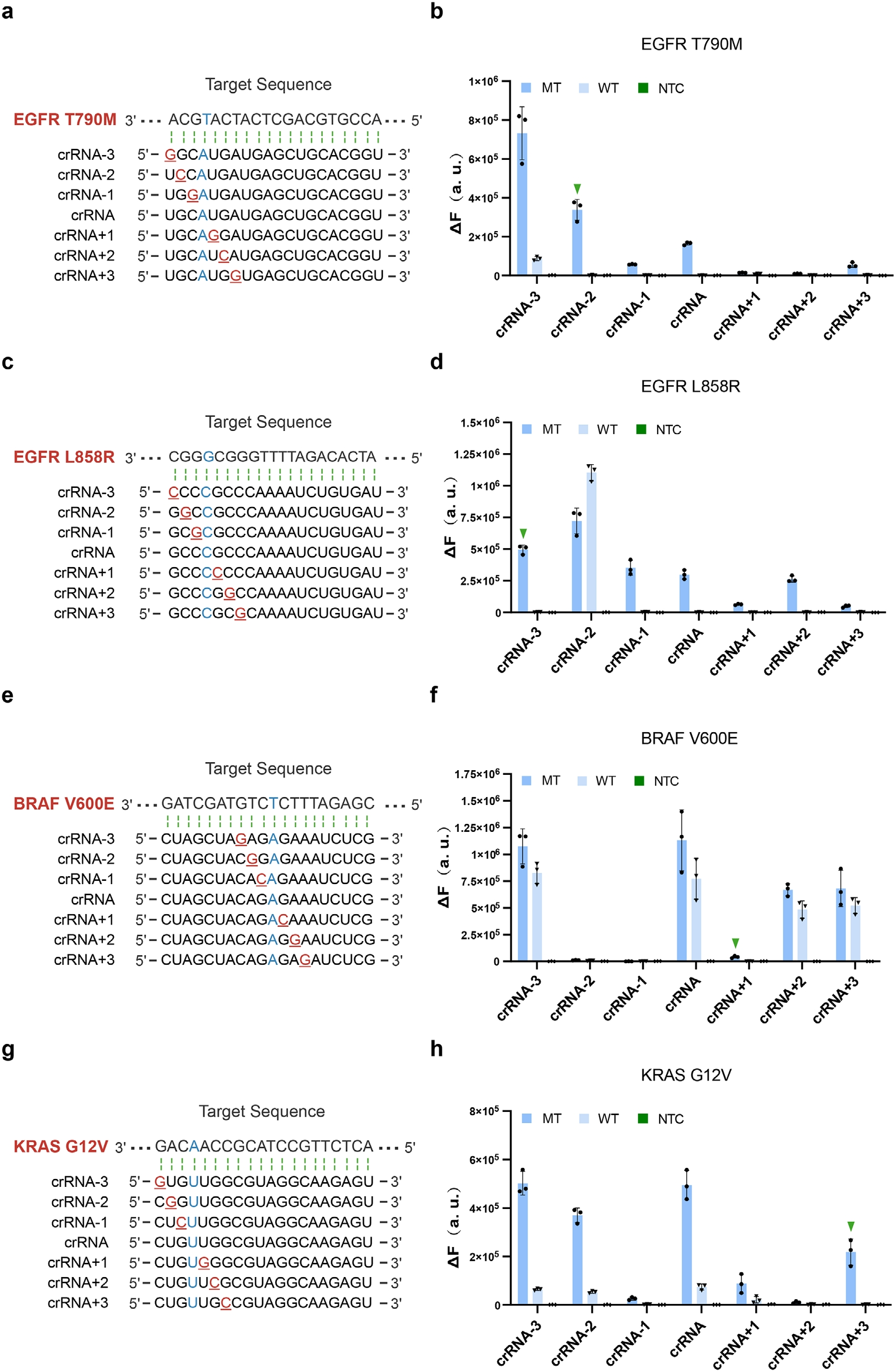
圖3 工程化crRNA實現(xiàn)了對臨床相關致癌突變的特異性檢測
接著,研究人員通過系統(tǒng)篩選PIK3CA H1047R擴增引物,確定F1R1引物對在39℃/20分鐘條件下可實現(xiàn)高效特異性擴增(圖4C-E)。將RPA擴增與T7-CRISPR/Cas14a檢測整合為單管反應體系,經(jīng)兩步法預驗證可行性后,重點優(yōu)化關鍵組分參數(shù),Cas14a與sgRNA以1:1比例協(xié)同作用時熒光信號最強,同時探針濃度優(yōu)化至625 nM以平衡信噪比(圖4G-I);T7外切酶濃度≥2.5 U/μL即可完成鏈轉(zhuǎn)換,且不產(chǎn)生背景噪聲(圖4J);37℃恒溫反應60分鐘實現(xiàn)檢測全程閉環(huán)(圖4K)。最終確立最優(yōu)體系包含480 nM RPA引物、625 nM Cas14a/sgRNA復合物、625 nM ssDNA探針及2.5 U/μL T7酶。功能驗證實驗表明,僅當目標ctDNA(1 ng/μL)激活完整反應體系時,Cas14a的側(cè)切活性可特異性切割FAM-BHQ1探針釋放熒光,證實目標依賴的信號放大機制。該優(yōu)化方案使檢測限達0.01%,為后續(xù)臨床驗證奠定技術基礎。
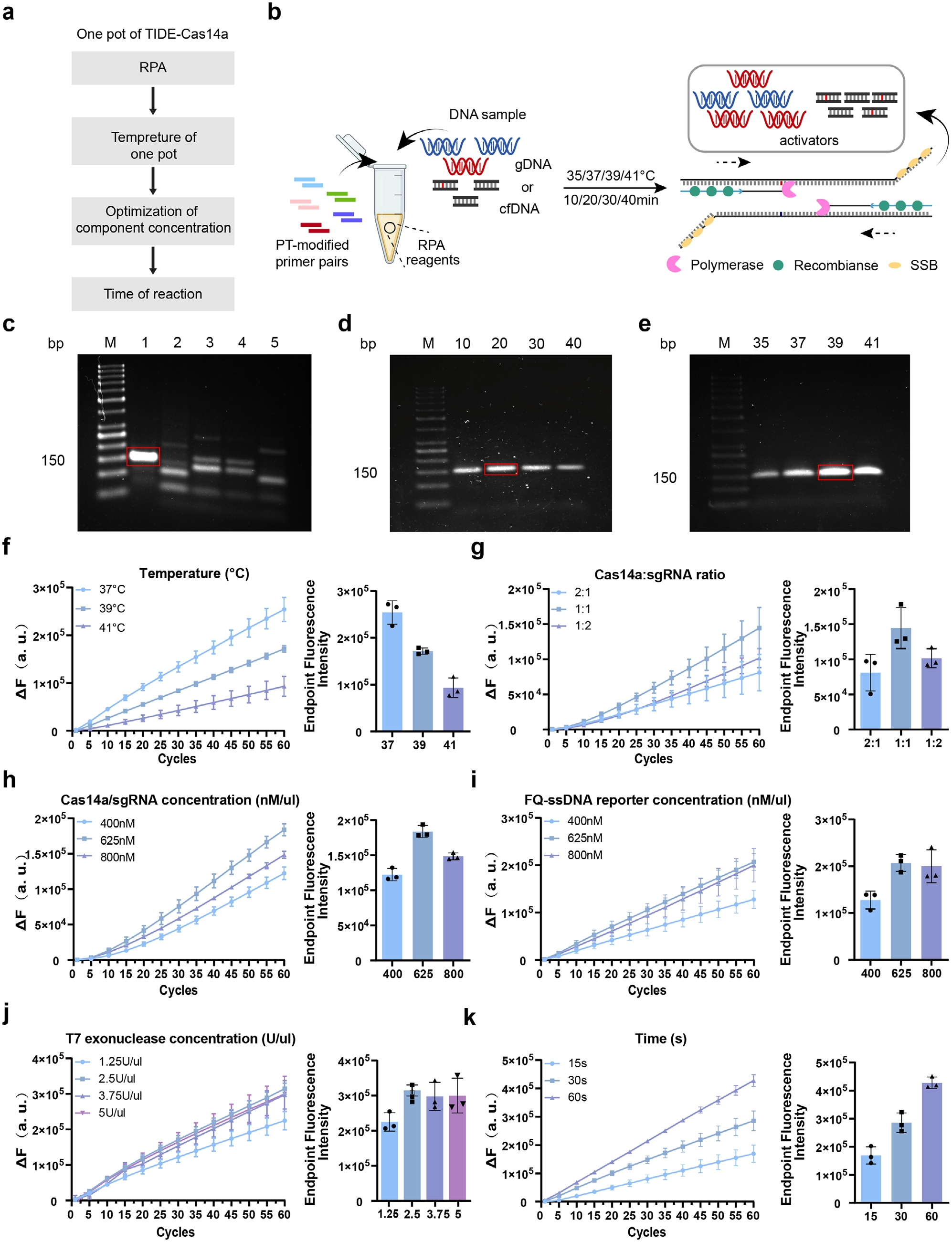
圖4 TIDE-Cas14a系統(tǒng)的建立與優(yōu)化
為了評估用于核酸分析TIDE-Cas14a系統(tǒng)的定量能力和適用性,研究人員通過細胞系gDNA梯度稀釋實驗證實其檢測限(LOD)達0.01% VAF(圖5C-E)。在模擬生理條件下,系統(tǒng)對PIK3CA H1047R突變表現(xiàn)出優(yōu)異定量能力。ΔF與VAF對數(shù)值線性相關,且微流控芯片在0.001% VAF時仍可檢測單分子信號(圖5C)。特異性驗證顯示系統(tǒng)可精準區(qū)分突變亞型,無交叉反應(圖5G),有效規(guī)避腫瘤異質(zhì)性干擾。與金標準ddPCR的對比實驗采用相同樣本。ddPCR的檢測閾值為0.1% VAF,而TIDE-Cas14a在0.01% VAF仍穩(wěn)定檢出,靈敏度提升10倍(圖5I)。重復性驗證涵蓋不同操作者、試劑批次及實驗日期,熒光信號變異系數(shù)<5%,證實系統(tǒng)具備臨床診斷級穩(wěn)定性。
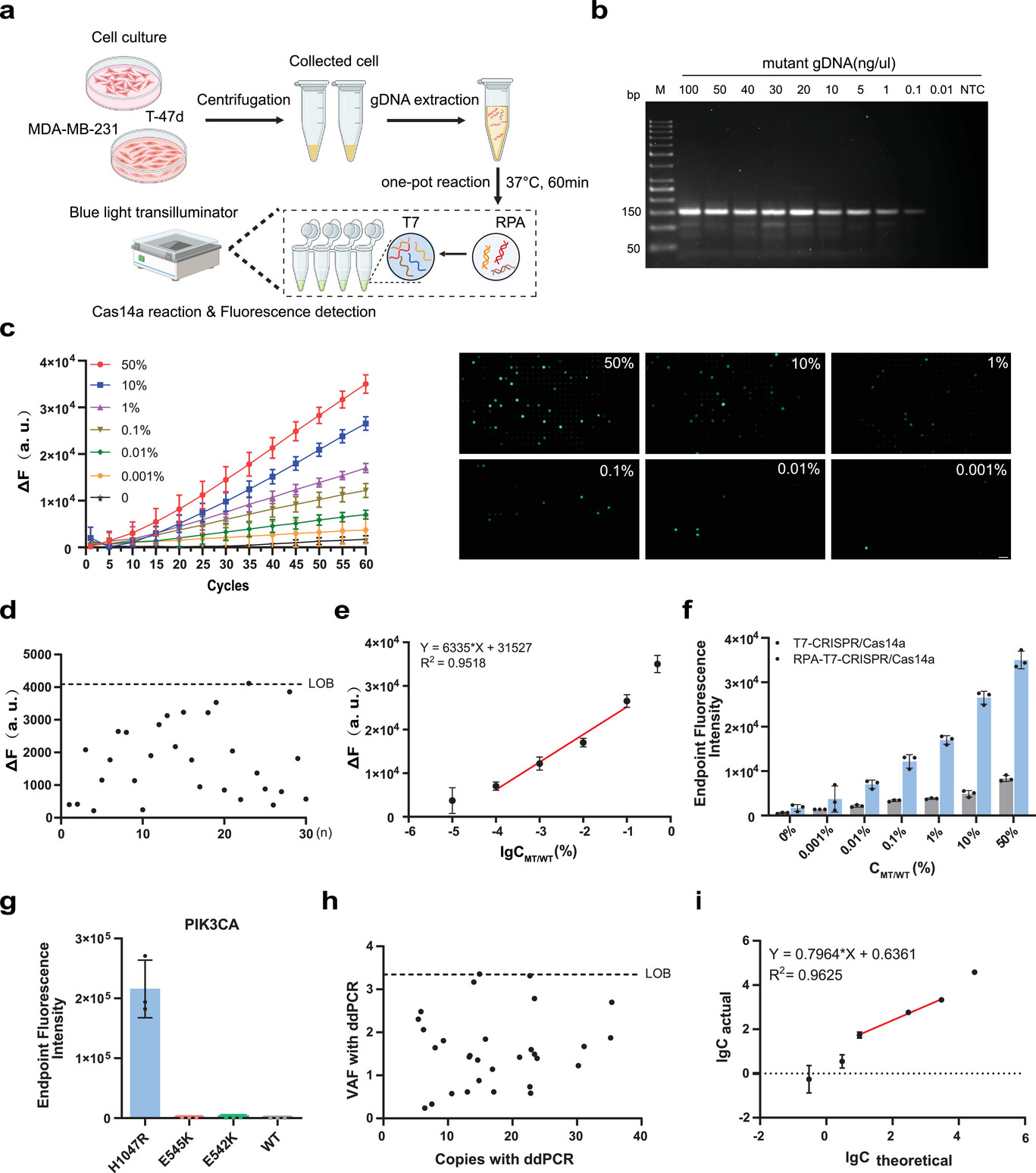
圖5 TIDE-Cas14a系統(tǒng)在檢測細胞系基因組DNA中PIK3CA H1047R突變的性能分析
接下來,為了評估TIDE-Cas14a系統(tǒng)在臨床實踐中的敏感特異性,研究人員收集了來自32例乳腺癌患者的組織與血漿樣本,TIDE-Cas14a系統(tǒng)展現(xiàn)出zhuoyue性能,與組織ddPCR結(jié)果相比,檢測敏感性與特異性均達100%(圖6C);血漿ctDNA檢測中,系統(tǒng)檢出率顯著優(yōu)于ddPCR,成功捕獲ddPCR漏診的2例IA期患者的微弱突變信號(圖6D-E);對低豐度ctDNA的檢出能力,證實其在早期腫瘤及微小殘留病灶監(jiān)測中的潛力。

圖6 使用TIDE-Cas14a系統(tǒng)和ddPCR在臨床樣本中檢測PIK3CA H1047R突變
最后,研究人員將TIDE-Cas14a系統(tǒng)與自研數(shù)字微流體芯片整合,構(gòu)建可定量檢測血漿PIK3CA H1047R突變的微流控平臺(圖7A-C)。芯片采用三層結(jié)構(gòu)設計,上下玻璃層與含10^5微腔陣列的PDMS芯片體,通過虹吸效應實現(xiàn)檢測液快速填充,避免堵塞風險。微腔密度較傳統(tǒng)數(shù)字PCR提升兩個數(shù)量級,顯著增強稀有突變信號捕獲能力。臨床驗證中,芯片基于熒光強度半定量分級策略,在32例乳腺癌樣本中與常規(guī)TIDE-Cas14a檢測結(jié)果高度一致,精準識別5例陽性樣本(圖7C)。雖暫未實現(xiàn)絕對定量,但其在>95%野生型背景下的突變識別能力已有所突破。該系統(tǒng)通過微腔并行反應將靈敏度推升至單分子級,且芯片制造采用可規(guī)模化的PDMS復制成型工藝,成本較商用數(shù)字PCR降低80%。該技術為腫瘤突變篩查提供兼具超靈敏、低成本特性的床旁診斷新方案。
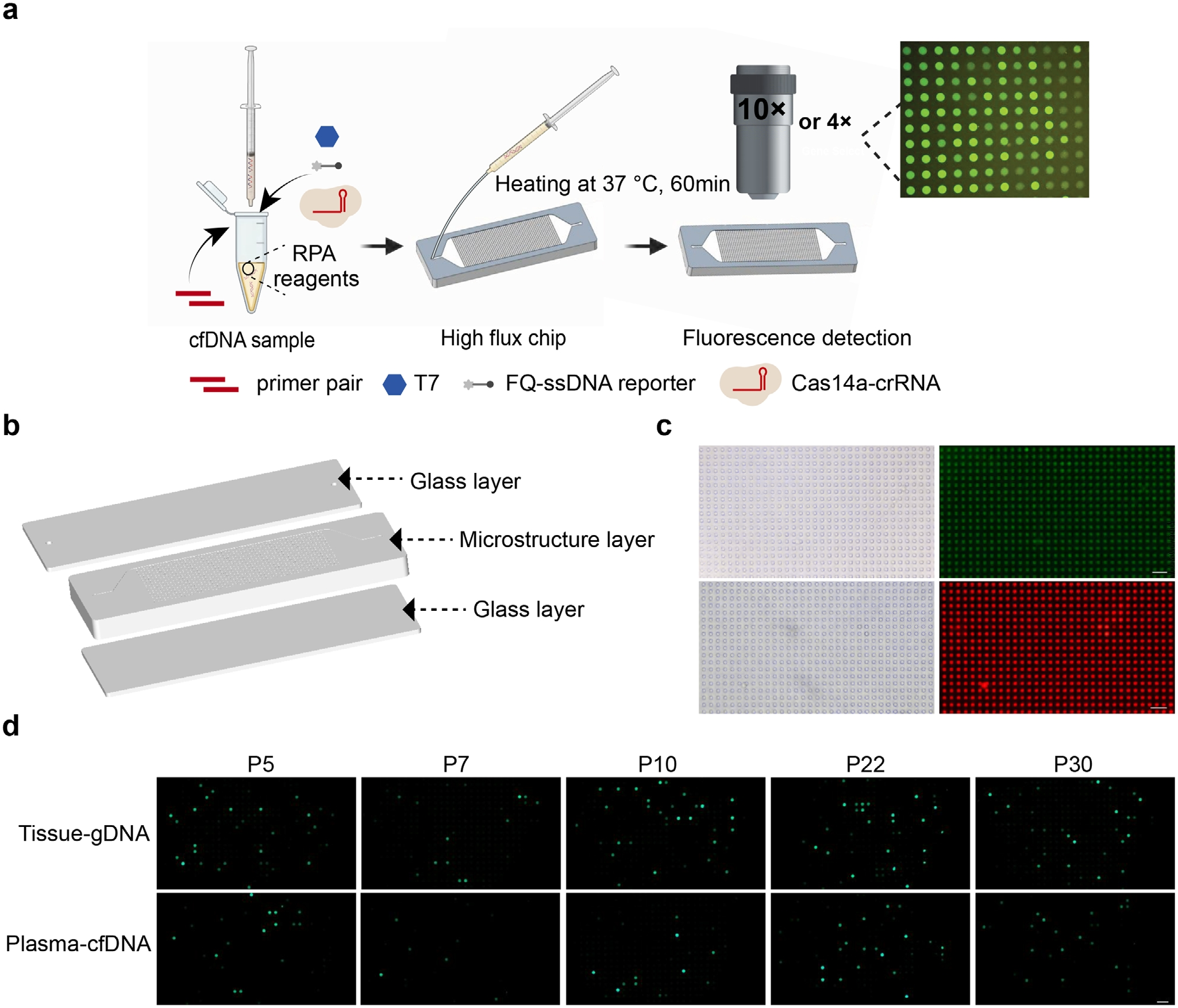
圖7 TIDE-Cas14a系統(tǒng)與數(shù)字微流控芯片的聯(lián)用
總之,研究開發(fā)的TIDE-Cas14a平臺通過三重創(chuàng)新突破液體活檢瓶頸,融合RPA等溫擴增、T7外切酶鏈轉(zhuǎn)換及CRISPR/Cas14a特異性切割,37℃恒溫1小時內(nèi)完成檢測;在crRNA特定位置引入G/C堿基錯配,實現(xiàn)單堿基分辨率,靈敏度較ddPCR提升10倍;集成10萬微腔陣列,單分子檢測能力達0.001% VAF,成本降低80%。臨床驗證顯示,32例乳腺癌樣本中與組織活檢一致性達100%,并成功檢出ddPCR遺漏的早期患者。該系統(tǒng)突破傳統(tǒng)方法在低豐度突變檢測中的局限,支持PIK3CA、EGFR等關鍵驅(qū)動基因分析,為早期癌癥診斷、MRD監(jiān)測提供床旁解決方案。
參考文獻:Y. Yu, M. Jin, W. Yuan, et al. “ Engineered crRNA Drives RPA-T7-CRISPR/Cas14a Cascade for Ultrasensitive Detection of ctDNA PIK3CA H1047R.” Adv. Sci. (2025): e07126.
原文鏈接:https://advanced.onlinelibrary.wiley.com/doi/10.1002/advs.202507126
圖片來源:所有圖片均來源于參考文獻
小編旨在分享、學習、交流生物科學等領域的研究進展。如有侵權(quán)或引文不當請聯(lián)系小編修正。如有任何的想法以及建議,歡迎聯(lián)系小編。感謝各位的瀏覽以及關注!進入官網(wǎng)www.naturethink.com或關注“Naturethink”公眾號,了解更多相關內(nèi)容。
點擊了解:仿生流體剪切應力系統(tǒng)
- 超穩(wěn)激光器與超穩(wěn)腔技術:從基礎到前沿應用
- B10通過激活PD-1促進骨髓來源巨噬細胞(BMDM)的極化和促解炎功能
- 巨噬細胞機械免疫調(diào)節(jié)血管生成和成骨作用影響骨折愈合的再生環(huán)境
- 抑制內(nèi)皮細胞 Scarb1 可減輕壓力超負荷誘導的心力衰竭進展
- 機器視覺三維成像技術簡介(二)
- 應用案例:PPLN驅(qū)動的寬帶量子合成器實現(xiàn)超快壓縮光脈沖源的關鍵突破
- 達格列凈對拉伸誘導創(chuàng)傷性腦損傷模型中胰島素信號和神經(jīng)元存活的影響
- 急性剪切力在靜脈內(nèi)皮細胞和人大隱靜脈誘導TWIST介導內(nèi)皮間充質(zhì)轉(zhuǎn)化






