重組白細(xì)胞介素IL-4在驅(qū)動(dòng)淋巴細(xì)胞和先天免疫細(xì)胞定向分化等中的應(yīng)用
白細(xì)胞介素(IL-4,Interleukin-4)是免疫系統(tǒng)中的一種重要調(diào)節(jié)因子,它參與感染、過敏、自身免疫和癌癥等多種免疫反應(yīng)。而重組IL-4(重組白介素4,AbMole,M10465)為免疫細(xì)胞的培養(yǎng)和分化誘導(dǎo),以及細(xì)胞和動(dòng)物實(shí)驗(yàn)提供了重要工具。AbMole為全球科研客戶提供高純度、高生物活性的抑制劑、細(xì)胞因子、人源單抗、天然產(chǎn)物、熒光染料、多肽、靶點(diǎn)蛋白、化合物庫(kù)、抗生素等科研試劑,全球大量文獻(xiàn)專利引用。
一、IL-4(Interleukin-4)的作用機(jī)理
白細(xì)胞介素-4(Interleukin-4, IL-4)是一種由活化的T細(xì)胞、肥大細(xì)胞、嗜堿性粒細(xì)胞等分泌的多效性細(xì)胞因子。IL-4(Recombinant Interleukin-4,重組白介素4,AbMole,M9363)通過與其特異性受體白細(xì)胞介素-4受體(interleukin-4 receptor,IL-4R)復(fù)合物結(jié)合行使功能。該受體主要有兩種類型:I型受體和II型受體。IL-4與受體結(jié)合后,受體相關(guān)的Janus激酶(JAK1和JAK3)發(fā)生磷酸化并被激活。激活的JAKs進(jìn)而磷酸化IL-4受體鏈上的酪氨酸殘基,為信號(hào)轉(zhuǎn)導(dǎo)與轉(zhuǎn)錄激活因子6(STAT6)提供錨定位點(diǎn)。STAT6被招募至受體并被JAKs磷酸化,磷酸化的STAT6形成同源二聚體,轉(zhuǎn)運(yùn)至細(xì)胞核內(nèi),與特定基因啟動(dòng)子區(qū)域的元件結(jié)合,調(diào)控下游基因(如Arg1, CD23, SOCS1)的轉(zhuǎn)錄。IL-4也可激活胰島素受體底物(IRS)/PI3K通路和MAPK通路,共同協(xié)調(diào)細(xì)胞的存活、增殖和代謝重編程[1]。
二、IL-4(白介素4)的科研應(yīng)用
1. IL-4(白介素4)用于T細(xì)胞的分化研究
在T細(xì)胞的發(fā)育和功能研究上,重組IL-4蛋白(Recombinant Interleukin-4,AbMole,M10465)發(fā)揮著至關(guān)重要的作用。大量研究表明,IL-4是Th2分化的關(guān)鍵調(diào)控因子,可直接驅(qū)動(dòng)初始CD4+ T細(xì)胞(Th0)向Th2譜系分化[2]。這一過程伴隨著Th2特征性細(xì)胞因子(如IL-4、IL-5、IL-13)的分泌,并依賴轉(zhuǎn)錄因子GATA3的上調(diào)。需要注意的是IL-4在體外誘導(dǎo)TH2譜系分化的實(shí)驗(yàn)中,一般需聯(lián)合抗CD3/CD28抗體(目的是提供TCR信號(hào))一同使用[3]。研究顯示,降低CD3抗體的濃度(弱TCR刺激)會(huì)顯著抑制Th2擴(kuò)增[3]。
2. IL-4(白介素4)用于B細(xì)胞的增殖和類別轉(zhuǎn)換
重組 IL-4 蛋白(Recombinant IL-4,AbMole,M10018)在 B 細(xì)胞的增殖和類別轉(zhuǎn)換等方面同樣展現(xiàn)出不可或缺的作用。例如單獨(dú)使用 IL-4 可明顯增加外周血單核細(xì)胞的增殖活性。并且IL-4可通過上調(diào)CD23和CD40(B細(xì)胞分化為IgG分泌性漿細(xì)胞的關(guān)鍵標(biāo)記)促進(jìn)漿細(xì)胞分化[4]。IL-4 在結(jié)合多種共刺激劑(包括抗 IgM、金黃色葡萄球菌 cowan 菌株)的情況下,可促進(jìn)B細(xì)胞產(chǎn)生IgM、IgG1 和 IgE[5]。IL-4還可驅(qū)動(dòng)B細(xì)胞向IgG1和IgE分泌型細(xì)胞的類別轉(zhuǎn)換,該實(shí)驗(yàn)一般需要同時(shí)使用IL-4與IL-21處理細(xì)胞,其中IL-4促進(jìn)上述轉(zhuǎn)換和增殖擴(kuò)增,而IL-21 則進(jìn)一步放大IgE+ B細(xì)胞的增殖[6]。2014年,AbMole的兩款抑制劑分別被西班牙國(guó)家心血管研究中心和美國(guó)哥倫比亞大學(xué)用于動(dòng)物體內(nèi)實(shí)驗(yàn),相關(guān)科研成果發(fā)表于頂刊 Nature 和 Nature Medicine。
3. IL-4(Interleukin-4)用于巨噬細(xì)胞極化的研究
巨噬細(xì)胞是免疫系統(tǒng)中的重要抗原呈遞細(xì)胞和先天免疫細(xì)胞,在免疫應(yīng)答的啟動(dòng)和調(diào)節(jié)過程中發(fā)揮著關(guān)鍵作用。巨噬細(xì)胞存在兩種亞型,即M1型(經(jīng)典激活型)和M2型(替代激活型)。其中M1型巨噬細(xì)胞是促炎表型,可分泌促炎細(xì)胞因子(如IL-1β、TNF-α)進(jìn)一步加強(qiáng)免疫反應(yīng);而M2型巨噬細(xì)胞則是抗炎/促修復(fù)表型,主要分泌IL-10等抗炎因子并抑制免疫系統(tǒng)。M1/M2表型比例的失調(diào)與多種疾病高度相關(guān)[7]。IL-4(Recombinant Interleukin-4,重組白介素4,AbMole,M9363)是誘導(dǎo)M2型巨噬細(xì)胞極化的關(guān)鍵細(xì)胞因子。研究表明,IL-4通過激活STAT6信號(hào)通路,上調(diào)M2標(biāo)志物(如Arg1、CD206、IL-10等),同時(shí)抑制M1型巨噬細(xì)胞的炎癥因子(如TNF-α、IL-6)[8, 9]。有研究表明Herpud1基因的抑制會(huì)降低IL-4誘導(dǎo)的M2極化效率,而TRAF6可通過穩(wěn)定STAT6蛋白增強(qiáng)IL-4信號(hào)傳導(dǎo)促進(jìn)M2極化[10]。此外,在體外培養(yǎng)中,IL-4與IL-13 表現(xiàn)出協(xié)同效應(yīng),二者聯(lián)合可進(jìn)一步增強(qiáng)M2細(xì)胞的極化[11, 12]。
4. IL-4(Interleukin-4)用于樹突狀細(xì)胞的分化誘導(dǎo)
樹突狀細(xì)胞(Dendritic Cells, DCs)是免疫系統(tǒng)中一類多功能抗原呈遞細(xì)胞(APCs),在連接先天免疫和適應(yīng)性免疫中發(fā)揮核心作用。重組IL-4蛋白(Recombinant Interleukin-4,AbMole,M10465)可用于樹突狀細(xì)胞的分化誘導(dǎo)。例如IL-4與粒細(xì)胞-巨噬細(xì)胞集落刺激因子(GM-CSF)聯(lián)合使用,可誘導(dǎo)單核細(xì)胞分化為未成熟樹突狀細(xì)胞(iDC)。實(shí)驗(yàn)表明,使用50 ng/mL GM-CSF和20 ng/mL的IL-4處理人外周血單個(gè)核細(xì)胞(PBMCs),3天后可觀察到顯著的樹突狀細(xì)胞分化[13]。
5. IL-4在動(dòng)物模型中的應(yīng)用
在動(dòng)物模型中,通過腹腔注射或氣道吸入重組 IL-4 蛋白(Recombinant IL-4,AbMole,M10018),可模擬Th2細(xì)胞因子高表達(dá)的環(huán)境,用于研究免疫應(yīng)答機(jī)制。這種處理方式能夠顯著提高動(dòng)物體內(nèi)IL-4的水平,從而模擬Th2細(xì)胞因子高表達(dá)的環(huán)境[14]。在這些模型中,重組IL-4蛋白能夠顯著促進(jìn)Th2細(xì)胞的分化和功能,表現(xiàn)為IL-4、IL-5和IL-13等Th2型細(xì)胞因子的高水平表達(dá)。此外,重組IL-4蛋白還能夠影響B(tài)細(xì)胞的增殖和抗體分泌,特別是IgE的產(chǎn)生。重組 IL-4 蛋白在自身免疫性疾病動(dòng)物模型同樣具有重要價(jià)值。例如有文獻(xiàn)采用膠原誘導(dǎo)關(guān)節(jié)炎(CIA)大鼠模型,在模型構(gòu)建過程中,向大鼠體內(nèi)注射重組 IL-4 蛋白,以增強(qiáng)模型的炎癥反應(yīng)[15]。
三、范例詳解
1. Eur J Med Res. 2025 Apr 11;30(1):271.
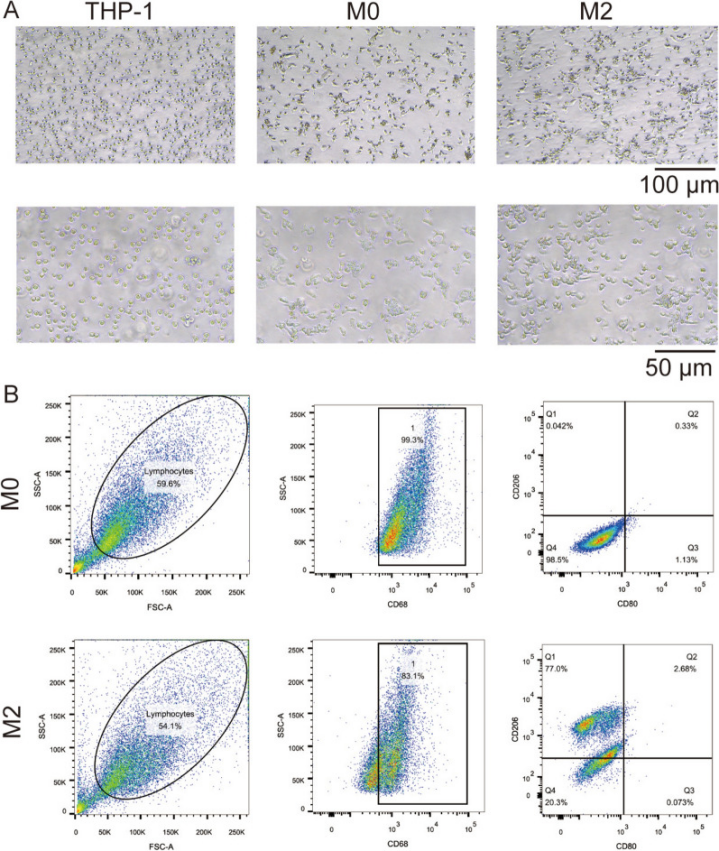
南方科技大學(xué)、中山市人民醫(yī)院的實(shí)驗(yàn)人員在上述論文中探究了M2巨噬細(xì)胞來源的外泌體(M2φ-exos)對(duì) TGF-β1 誘導(dǎo)的人支氣管上皮細(xì)胞(BEAS-2B)上皮間質(zhì)轉(zhuǎn)化(EMT)的調(diào)控作用及分子機(jī)制。研究通過誘導(dǎo) THP-1 細(xì)胞分化為 M2 巨噬細(xì)胞并分離其外泌體,發(fā)現(xiàn) M2φ-exos(M2巨噬細(xì)胞衍生的外泌體)可被 BEAS-2B 細(xì)胞攝取,通過抑制 TGF-βRI/Smad2/3 信號(hào)通路,逆轉(zhuǎn) TGF-β1 誘導(dǎo)的 EMT(表現(xiàn)為下調(diào) Snail、Vimentin、Collagen 1 的表達(dá),上調(diào) E-cadherin 的表達(dá)),而外泌體釋放抑制劑 GW4869 可阻斷這一作用,TGF-βRI 抑制劑 SB431542 與 M2φ-exos 聯(lián)合使用時(shí)效果更顯著。在上述實(shí)驗(yàn)中,科研人員使用了AbMole的IL-4(Recombinant Interleukin-4,重組白介素4,AbMole,M9363)目的是誘導(dǎo) THP-1 細(xì)胞向 M2 巨噬細(xì)胞極化。具體來說,THP-1 細(xì)胞先經(jīng)佛波酯(PMA)誘導(dǎo)為 M0 巨噬細(xì)胞,再通過 PMA 聯(lián)合 20 ng/mL IL-4 進(jìn)一步誘導(dǎo) 36 小時(shí),使其分化為具有 M2 表型的巨噬細(xì)胞(通過流式細(xì)胞術(shù)檢測(cè)到 CD206 表達(dá)顯著升高,證實(shí)極化成功)。
溫州醫(yī)科大學(xué)的科研團(tuán)隊(duì)在該文章中,探究了攜帶小鼠成纖維細(xì)胞活化蛋白 -α(FAP)和人 livin α 基因的重組腺病毒載體(rAd-FAP/hlivin α)感染樹突狀細(xì)胞(DCs)對(duì)小鼠 Lewis 肺癌(LLC)的抗腫瘤作用。研究構(gòu)建了 rAd-FAP、rAd-hlivin α 及 rAd-FAP/hlivin α,將其轉(zhuǎn)導(dǎo)至小鼠 DCs 后,免疫 LLC 荷瘤小鼠,發(fā)現(xiàn)雙基因修飾的 DCs 可顯著抑制腫瘤體積、提高生存率,并增強(qiáng)脾淋巴細(xì)胞對(duì)腫瘤相關(guān)成纖維細(xì)胞(CAFs)的細(xì)胞毒性作用。機(jī)制上,F(xiàn)AP 在 CAFs 中高表達(dá),livin α 在 LLC 中上調(diào),雙基因修飾的 DCs 通過靶向這兩個(gè)分子,改善腫瘤免疫微環(huán)境,發(fā)揮協(xié)同抗腫瘤效應(yīng)。在實(shí)驗(yàn)中,科研人員使用了來自AbMole的3款產(chǎn)品:IL‐4(Recombinant Interleukin-4,IL-4,AbMole,M10465)、Mitomycin C(絲裂霉素C,AbMole,M5791)和IL‐2(Recombinant Interleukin-2,AbMole,M19999)。其中IL-4 的作用是促進(jìn)樹突狀細(xì)胞(DCs)的體外培養(yǎng)與分化。具體來說,從小鼠骨髓中獲取的 DCs 在含 20 ng/mL 粒細(xì)胞-巨噬細(xì)胞集落刺激因子(GM-CSF)和 20 ng/mL 重組小鼠 IL-4 的完全培養(yǎng)基中培養(yǎng),以支持 DCs 的生長(zhǎng)、分化和成熟,為后續(xù)感染重組腺病毒載體奠定基礎(chǔ)[17]。IL-2(白細(xì)胞介素-2)在上述研究中主要用于增強(qiáng)脾淋巴細(xì)胞對(duì)CAFs的細(xì)胞毒性效應(yīng)。絲裂霉素 C 的作用則是作為細(xì)胞增殖抑制劑,用于處理 CAFs 以阻止其增殖,從而確保實(shí)驗(yàn)中檢測(cè)到的細(xì)胞毒性效應(yīng)僅來源于淋巴細(xì)胞對(duì) CAFs 的特異性殺傷。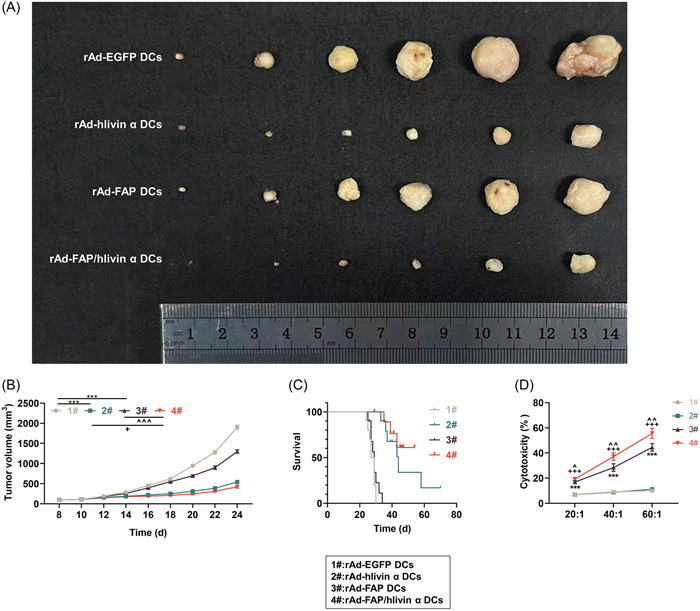

AbMole是ChemBridge中國(guó)區(qū)官方指定合作伙伴。

參考文獻(xiàn)及鳴謝
[1] S. P. Mehrbani, P. Motahari, F. P. Azar, et al., Role of interleukin-4 in pathogenesis of oral lichen planus: A systematic review, Medicina oral, patologia oral y cirugia bucal 25(3) (2020) e410-e415.
[2] M. T. Hassan, H. Tayara, K. T. Chong, Meta-IL4: An ensemble learning approach for IL-4-inducing peptide prediction, Methods (San Diego, Calif.) 217 (2023) 49-56.
[3] A. Kandel, L. Li, Y. Wang, et al., Differentiation and Regulation of Bovine Th2 Cells In Vitro, Cells 13(9) (2024).
[4] D. Dijkstra, A. Meyer-Bahlburg, Human Basophils Modulate Plasma Cell Differentiation and Maturation, Journal of immunology (Baltimore, Md. : 1950) 198(1) (2017) 229-238.
[5] D. Mark Estes, Ayumi Hirano, Volker T. Heussler, et al., Expression and Biological Activities of Bovine Interleukin 4: Effects of Recombinant Bovine Interleukin 4 on T Cell Proliferation and B Cell Differentiation and Proliferation in Vitro, Cellular Immunology 163(2) (1995) 268-279.
[6] M. J. Robinson, D. M. Tarlinton, IL-21 promotes plasmablast differentiation independently of proliferation in vitro, Immunology letters 273 (2025) 106980.
[7] A. Viola, F. Munari, R. Sanchez-Rodriguez, et al., The Metabolic Signature of Macrophage Responses, Frontiers in immunology 10 (2019) 1462.
[8] C. Shen, C. Liu, Z. Zhang, et al., PD-1 Affects the Immunosuppressive Function of Group 2 Innate Lymphoid Cells in Human Non-Small Cell Lung Cancer, Frontiers in immunology 12 (2021) 680055.
[9] C. Zhou, C. Lu, H. Pu, et al., TRAF6 promotes IL-4-induced M2 macrophage activation by stabilizing STAT6, Molecular immunology 127 (2020) 223-229.
[10] Y. Li, Y. Xie, J. Hao, et al., ER-localized protein-Herpud1 is a new mediator of IL-4-induced macrophage polarization and migration, Experimental cell research 368(2) (2018) 167-173.
[11] S. Zhou, T. Zhao, X. Chen, et al., Runx1 Deficiency Promotes M2 Macrophage Polarization Through Enhancing STAT6 Phosphorylation, Inflammation 46(6) (2023) 2241-2253.
[12] X. Wang, S. Gao, L. Song, et al., Astragaloside IV antagonizes M2 phenotype macrophage polarization-evoked ovarian cancer cell malignant progression by suppressing the HMGB1-TLR4 axis, Molecular immunology 130 (2021) 113-121.
[13] B. D. Clarkson, R. K. Johnson, C. Bingel, et al., Preservation of antigen-specific responses in cryopreserved CD4(+) and CD8(+) T cells expanded with IL-2 and IL-7, Journal of translational autoimmunity 5 (2022) 100173.
[14] A. M. Dittrich, H. C. Chen, L. Xu, et al., A new mechanism for inhalational priming: IL-4 bypasses innate immune signals, Journal of immunology (Baltimore, Md. : 1950) 181(10) (2008) 7307-15.
[15] P. Choi, H. Reiser, IL-4: role in disease and regulation of production, Clinical and experimental immunology 113(3) (1998) 317-9.
[16] C. Liu, X. Huang, S. Li, et al., M2 macrophage-derived exosomes reverse TGF-β1-induced epithelial mesenchymal transformation in BEAS-2B cells via the TGF-βRI/Smad2/3 signaling pathway, European journal of medical research 30(1) (2025) 271.
[17] Z. Ye, J. Pan, Z. Yin, et al., Dendritic cells infected with recombinant adenoviral vector encoding mouse fibroblast activation protein-α and human livin α exert an antitumor effect against Lewis lung carcinoma in mice, Immunity, inflammation and disease 11(9) (2023) e1011.
一、IL-4(Interleukin-4)的作用機(jī)理
白細(xì)胞介素-4(Interleukin-4, IL-4)是一種由活化的T細(xì)胞、肥大細(xì)胞、嗜堿性粒細(xì)胞等分泌的多效性細(xì)胞因子。IL-4(Recombinant Interleukin-4,重組白介素4,AbMole,M9363)通過與其特異性受體白細(xì)胞介素-4受體(interleukin-4 receptor,IL-4R)復(fù)合物結(jié)合行使功能。該受體主要有兩種類型:I型受體和II型受體。IL-4與受體結(jié)合后,受體相關(guān)的Janus激酶(JAK1和JAK3)發(fā)生磷酸化并被激活。激活的JAKs進(jìn)而磷酸化IL-4受體鏈上的酪氨酸殘基,為信號(hào)轉(zhuǎn)導(dǎo)與轉(zhuǎn)錄激活因子6(STAT6)提供錨定位點(diǎn)。STAT6被招募至受體并被JAKs磷酸化,磷酸化的STAT6形成同源二聚體,轉(zhuǎn)運(yùn)至細(xì)胞核內(nèi),與特定基因啟動(dòng)子區(qū)域的元件結(jié)合,調(diào)控下游基因(如Arg1, CD23, SOCS1)的轉(zhuǎn)錄。IL-4也可激活胰島素受體底物(IRS)/PI3K通路和MAPK通路,共同協(xié)調(diào)細(xì)胞的存活、增殖和代謝重編程[1]。
二、IL-4(白介素4)的科研應(yīng)用
1. IL-4(白介素4)用于T細(xì)胞的分化研究
在T細(xì)胞的發(fā)育和功能研究上,重組IL-4蛋白(Recombinant Interleukin-4,AbMole,M10465)發(fā)揮著至關(guān)重要的作用。大量研究表明,IL-4是Th2分化的關(guān)鍵調(diào)控因子,可直接驅(qū)動(dòng)初始CD4+ T細(xì)胞(Th0)向Th2譜系分化[2]。這一過程伴隨著Th2特征性細(xì)胞因子(如IL-4、IL-5、IL-13)的分泌,并依賴轉(zhuǎn)錄因子GATA3的上調(diào)。需要注意的是IL-4在體外誘導(dǎo)TH2譜系分化的實(shí)驗(yàn)中,一般需聯(lián)合抗CD3/CD28抗體(目的是提供TCR信號(hào))一同使用[3]。研究顯示,降低CD3抗體的濃度(弱TCR刺激)會(huì)顯著抑制Th2擴(kuò)增[3]。
2. IL-4(白介素4)用于B細(xì)胞的增殖和類別轉(zhuǎn)換
重組 IL-4 蛋白(Recombinant IL-4,AbMole,M10018)在 B 細(xì)胞的增殖和類別轉(zhuǎn)換等方面同樣展現(xiàn)出不可或缺的作用。例如單獨(dú)使用 IL-4 可明顯增加外周血單核細(xì)胞的增殖活性。并且IL-4可通過上調(diào)CD23和CD40(B細(xì)胞分化為IgG分泌性漿細(xì)胞的關(guān)鍵標(biāo)記)促進(jìn)漿細(xì)胞分化[4]。IL-4 在結(jié)合多種共刺激劑(包括抗 IgM、金黃色葡萄球菌 cowan 菌株)的情況下,可促進(jìn)B細(xì)胞產(chǎn)生IgM、IgG1 和 IgE[5]。IL-4還可驅(qū)動(dòng)B細(xì)胞向IgG1和IgE分泌型細(xì)胞的類別轉(zhuǎn)換,該實(shí)驗(yàn)一般需要同時(shí)使用IL-4與IL-21處理細(xì)胞,其中IL-4促進(jìn)上述轉(zhuǎn)換和增殖擴(kuò)增,而IL-21 則進(jìn)一步放大IgE+ B細(xì)胞的增殖[6]。2014年,AbMole的兩款抑制劑分別被西班牙國(guó)家心血管研究中心和美國(guó)哥倫比亞大學(xué)用于動(dòng)物體內(nèi)實(shí)驗(yàn),相關(guān)科研成果發(fā)表于頂刊 Nature 和 Nature Medicine。
3. IL-4(Interleukin-4)用于巨噬細(xì)胞極化的研究
巨噬細(xì)胞是免疫系統(tǒng)中的重要抗原呈遞細(xì)胞和先天免疫細(xì)胞,在免疫應(yīng)答的啟動(dòng)和調(diào)節(jié)過程中發(fā)揮著關(guān)鍵作用。巨噬細(xì)胞存在兩種亞型,即M1型(經(jīng)典激活型)和M2型(替代激活型)。其中M1型巨噬細(xì)胞是促炎表型,可分泌促炎細(xì)胞因子(如IL-1β、TNF-α)進(jìn)一步加強(qiáng)免疫反應(yīng);而M2型巨噬細(xì)胞則是抗炎/促修復(fù)表型,主要分泌IL-10等抗炎因子并抑制免疫系統(tǒng)。M1/M2表型比例的失調(diào)與多種疾病高度相關(guān)[7]。IL-4(Recombinant Interleukin-4,重組白介素4,AbMole,M9363)是誘導(dǎo)M2型巨噬細(xì)胞極化的關(guān)鍵細(xì)胞因子。研究表明,IL-4通過激活STAT6信號(hào)通路,上調(diào)M2標(biāo)志物(如Arg1、CD206、IL-10等),同時(shí)抑制M1型巨噬細(xì)胞的炎癥因子(如TNF-α、IL-6)[8, 9]。有研究表明Herpud1基因的抑制會(huì)降低IL-4誘導(dǎo)的M2極化效率,而TRAF6可通過穩(wěn)定STAT6蛋白增強(qiáng)IL-4信號(hào)傳導(dǎo)促進(jìn)M2極化[10]。此外,在體外培養(yǎng)中,IL-4與IL-13 表現(xiàn)出協(xié)同效應(yīng),二者聯(lián)合可進(jìn)一步增強(qiáng)M2細(xì)胞的極化[11, 12]。
4. IL-4(Interleukin-4)用于樹突狀細(xì)胞的分化誘導(dǎo)
樹突狀細(xì)胞(Dendritic Cells, DCs)是免疫系統(tǒng)中一類多功能抗原呈遞細(xì)胞(APCs),在連接先天免疫和適應(yīng)性免疫中發(fā)揮核心作用。重組IL-4蛋白(Recombinant Interleukin-4,AbMole,M10465)可用于樹突狀細(xì)胞的分化誘導(dǎo)。例如IL-4與粒細(xì)胞-巨噬細(xì)胞集落刺激因子(GM-CSF)聯(lián)合使用,可誘導(dǎo)單核細(xì)胞分化為未成熟樹突狀細(xì)胞(iDC)。實(shí)驗(yàn)表明,使用50 ng/mL GM-CSF和20 ng/mL的IL-4處理人外周血單個(gè)核細(xì)胞(PBMCs),3天后可觀察到顯著的樹突狀細(xì)胞分化[13]。
5. IL-4在動(dòng)物模型中的應(yīng)用
在動(dòng)物模型中,通過腹腔注射或氣道吸入重組 IL-4 蛋白(Recombinant IL-4,AbMole,M10018),可模擬Th2細(xì)胞因子高表達(dá)的環(huán)境,用于研究免疫應(yīng)答機(jī)制。這種處理方式能夠顯著提高動(dòng)物體內(nèi)IL-4的水平,從而模擬Th2細(xì)胞因子高表達(dá)的環(huán)境[14]。在這些模型中,重組IL-4蛋白能夠顯著促進(jìn)Th2細(xì)胞的分化和功能,表現(xiàn)為IL-4、IL-5和IL-13等Th2型細(xì)胞因子的高水平表達(dá)。此外,重組IL-4蛋白還能夠影響B(tài)細(xì)胞的增殖和抗體分泌,特別是IgE的產(chǎn)生。重組 IL-4 蛋白在自身免疫性疾病動(dòng)物模型同樣具有重要價(jià)值。例如有文獻(xiàn)采用膠原誘導(dǎo)關(guān)節(jié)炎(CIA)大鼠模型,在模型構(gòu)建過程中,向大鼠體內(nèi)注射重組 IL-4 蛋白,以增強(qiáng)模型的炎癥反應(yīng)[15]。
三、范例詳解
1. Eur J Med Res. 2025 Apr 11;30(1):271.
南方科技大學(xué)、中山市人民醫(yī)院的實(shí)驗(yàn)人員在上述論文中探究了M2巨噬細(xì)胞來源的外泌體(M2φ-exos)對(duì) TGF-β1 誘導(dǎo)的人支氣管上皮細(xì)胞(BEAS-2B)上皮間質(zhì)轉(zhuǎn)化(EMT)的調(diào)控作用及分子機(jī)制。研究通過誘導(dǎo) THP-1 細(xì)胞分化為 M2 巨噬細(xì)胞并分離其外泌體,發(fā)現(xiàn) M2φ-exos(M2巨噬細(xì)胞衍生的外泌體)可被 BEAS-2B 細(xì)胞攝取,通過抑制 TGF-βRI/Smad2/3 信號(hào)通路,逆轉(zhuǎn) TGF-β1 誘導(dǎo)的 EMT(表現(xiàn)為下調(diào) Snail、Vimentin、Collagen 1 的表達(dá),上調(diào) E-cadherin 的表達(dá)),而外泌體釋放抑制劑 GW4869 可阻斷這一作用,TGF-βRI 抑制劑 SB431542 與 M2φ-exos 聯(lián)合使用時(shí)效果更顯著。在上述實(shí)驗(yàn)中,科研人員使用了AbMole的IL-4(Recombinant Interleukin-4,重組白介素4,AbMole,M9363)目的是誘導(dǎo) THP-1 細(xì)胞向 M2 巨噬細(xì)胞極化。具體來說,THP-1 細(xì)胞先經(jīng)佛波酯(PMA)誘導(dǎo)為 M0 巨噬細(xì)胞,再通過 PMA 聯(lián)合 20 ng/mL IL-4 進(jìn)一步誘導(dǎo) 36 小時(shí),使其分化為具有 M2 表型的巨噬細(xì)胞(通過流式細(xì)胞術(shù)檢測(cè)到 CD206 表達(dá)顯著升高,證實(shí)極化成功)。


圖 1. Characterization of M2 macrophages[16].
2. Immun Inflamm Dis. 2023 Sep;11(9):e1011.溫州醫(yī)科大學(xué)的科研團(tuán)隊(duì)在該文章中,探究了攜帶小鼠成纖維細(xì)胞活化蛋白 -α(FAP)和人 livin α 基因的重組腺病毒載體(rAd-FAP/hlivin α)感染樹突狀細(xì)胞(DCs)對(duì)小鼠 Lewis 肺癌(LLC)的抗腫瘤作用。研究構(gòu)建了 rAd-FAP、rAd-hlivin α 及 rAd-FAP/hlivin α,將其轉(zhuǎn)導(dǎo)至小鼠 DCs 后,免疫 LLC 荷瘤小鼠,發(fā)現(xiàn)雙基因修飾的 DCs 可顯著抑制腫瘤體積、提高生存率,并增強(qiáng)脾淋巴細(xì)胞對(duì)腫瘤相關(guān)成纖維細(xì)胞(CAFs)的細(xì)胞毒性作用。機(jī)制上,F(xiàn)AP 在 CAFs 中高表達(dá),livin α 在 LLC 中上調(diào),雙基因修飾的 DCs 通過靶向這兩個(gè)分子,改善腫瘤免疫微環(huán)境,發(fā)揮協(xié)同抗腫瘤效應(yīng)。在實(shí)驗(yàn)中,科研人員使用了來自AbMole的3款產(chǎn)品:IL‐4(Recombinant Interleukin-4,IL-4,AbMole,M10465)、Mitomycin C(絲裂霉素C,AbMole,M5791)和IL‐2(Recombinant Interleukin-2,AbMole,M19999)。其中IL-4 的作用是促進(jìn)樹突狀細(xì)胞(DCs)的體外培養(yǎng)與分化。具體來說,從小鼠骨髓中獲取的 DCs 在含 20 ng/mL 粒細(xì)胞-巨噬細(xì)胞集落刺激因子(GM-CSF)和 20 ng/mL 重組小鼠 IL-4 的完全培養(yǎng)基中培養(yǎng),以支持 DCs 的生長(zhǎng)、分化和成熟,為后續(xù)感染重組腺病毒載體奠定基礎(chǔ)[17]。IL-2(白細(xì)胞介素-2)在上述研究中主要用于增強(qiáng)脾淋巴細(xì)胞對(duì)CAFs的細(xì)胞毒性效應(yīng)。絲裂霉素 C 的作用則是作為細(xì)胞增殖抑制劑,用于處理 CAFs 以阻止其增殖,從而確保實(shí)驗(yàn)中檢測(cè)到的細(xì)胞毒性效應(yīng)僅來源于淋巴細(xì)胞對(duì) CAFs 的特異性殺傷。


圖 2. The antitumor effect of rAd‐FAP/hlivin α‐transduced DCs on LLC in mice[17]
AbMole是ChemBridge中國(guó)區(qū)官方指定合作伙伴。


參考文獻(xiàn)及鳴謝
[1] S. P. Mehrbani, P. Motahari, F. P. Azar, et al., Role of interleukin-4 in pathogenesis of oral lichen planus: A systematic review, Medicina oral, patologia oral y cirugia bucal 25(3) (2020) e410-e415.
[2] M. T. Hassan, H. Tayara, K. T. Chong, Meta-IL4: An ensemble learning approach for IL-4-inducing peptide prediction, Methods (San Diego, Calif.) 217 (2023) 49-56.
[3] A. Kandel, L. Li, Y. Wang, et al., Differentiation and Regulation of Bovine Th2 Cells In Vitro, Cells 13(9) (2024).
[4] D. Dijkstra, A. Meyer-Bahlburg, Human Basophils Modulate Plasma Cell Differentiation and Maturation, Journal of immunology (Baltimore, Md. : 1950) 198(1) (2017) 229-238.
[5] D. Mark Estes, Ayumi Hirano, Volker T. Heussler, et al., Expression and Biological Activities of Bovine Interleukin 4: Effects of Recombinant Bovine Interleukin 4 on T Cell Proliferation and B Cell Differentiation and Proliferation in Vitro, Cellular Immunology 163(2) (1995) 268-279.
[6] M. J. Robinson, D. M. Tarlinton, IL-21 promotes plasmablast differentiation independently of proliferation in vitro, Immunology letters 273 (2025) 106980.
[7] A. Viola, F. Munari, R. Sanchez-Rodriguez, et al., The Metabolic Signature of Macrophage Responses, Frontiers in immunology 10 (2019) 1462.
[8] C. Shen, C. Liu, Z. Zhang, et al., PD-1 Affects the Immunosuppressive Function of Group 2 Innate Lymphoid Cells in Human Non-Small Cell Lung Cancer, Frontiers in immunology 12 (2021) 680055.
[9] C. Zhou, C. Lu, H. Pu, et al., TRAF6 promotes IL-4-induced M2 macrophage activation by stabilizing STAT6, Molecular immunology 127 (2020) 223-229.
[10] Y. Li, Y. Xie, J. Hao, et al., ER-localized protein-Herpud1 is a new mediator of IL-4-induced macrophage polarization and migration, Experimental cell research 368(2) (2018) 167-173.
[11] S. Zhou, T. Zhao, X. Chen, et al., Runx1 Deficiency Promotes M2 Macrophage Polarization Through Enhancing STAT6 Phosphorylation, Inflammation 46(6) (2023) 2241-2253.
[12] X. Wang, S. Gao, L. Song, et al., Astragaloside IV antagonizes M2 phenotype macrophage polarization-evoked ovarian cancer cell malignant progression by suppressing the HMGB1-TLR4 axis, Molecular immunology 130 (2021) 113-121.
[13] B. D. Clarkson, R. K. Johnson, C. Bingel, et al., Preservation of antigen-specific responses in cryopreserved CD4(+) and CD8(+) T cells expanded with IL-2 and IL-7, Journal of translational autoimmunity 5 (2022) 100173.
[14] A. M. Dittrich, H. C. Chen, L. Xu, et al., A new mechanism for inhalational priming: IL-4 bypasses innate immune signals, Journal of immunology (Baltimore, Md. : 1950) 181(10) (2008) 7307-15.
[15] P. Choi, H. Reiser, IL-4: role in disease and regulation of production, Clinical and experimental immunology 113(3) (1998) 317-9.
[16] C. Liu, X. Huang, S. Li, et al., M2 macrophage-derived exosomes reverse TGF-β1-induced epithelial mesenchymal transformation in BEAS-2B cells via the TGF-βRI/Smad2/3 signaling pathway, European journal of medical research 30(1) (2025) 271.
[17] Z. Ye, J. Pan, Z. Yin, et al., Dendritic cells infected with recombinant adenoviral vector encoding mouse fibroblast activation protein-α and human livin α exert an antitumor effect against Lewis lung carcinoma in mice, Immunity, inflammation and disease 11(9) (2023) e1011.
- Th1細(xì)胞極化因子的核心網(wǎng)絡(luò)與信號(hào)機(jī)制及在自身免疫病理中的雙重作用
- 干細(xì)胞和免疫細(xì)胞在來源、功能、臨床應(yīng)用上的區(qū)別與共同點(diǎn)
- 組織保存液的作用、特性、使用方法及在科研實(shí)驗(yàn)中的應(yīng)用
- Nature文章分享:警示PD-1療法可能以犧牲長(zhǎng)期免疫力換取短期療效
- IL-4/IL-21/IL-10/BAFF等B細(xì)胞極化因子的作用機(jī)制及在疾病中的應(yīng)用
- 大鼠小膠質(zhì)細(xì)胞提取與分選攻略
- 人/小鼠CD8+ T細(xì)胞分選試劑盒特點(diǎn)及驗(yàn)證數(shù)據(jù)
- IL-10細(xì)胞因子的信號(hào)通路、調(diào)控機(jī)制及在自身免疫性疾病治療中的應(yīng)用
- 中喬新舟推出新品自然殺傷NK細(xì)胞培養(yǎng)試劑盒
- 莼試人表皮細(xì)胞培養(yǎng)試劑盒8折優(yōu)惠,滿5盒送凍存液
- 2026廣西臨床檢驗(yàn)儀器、試劑與輸血用品展覽會(huì)通知
- 優(yōu)寧維免費(fèi)講座直播邀請(qǐng):NK細(xì)胞的亞群與功能
- 奎克泰推出全新免疫監(jiān)測(cè)方案:30 min準(zhǔn)確定量NETs
- 睿捷生物雙十一科研狂歡月活動(dòng)來襲,多重好禮相送
- 中喬新舟萬圣節(jié)&雙十一福利:細(xì)胞培養(yǎng)基類產(chǎn)品滿贈(zèng)
- 第一屆上海凈信·酶離者合作伙伴招商答謝會(huì)圓滿結(jié)束
Copyright(C) 1998-2025 生物器材網(wǎng) 電話:021-64166852;13621656896 E-mail:info@bio-equip.com






