Nature分享:發(fā)現(xiàn)腫瘤免疫新靶點(diǎn)并通過藥物篩選與合成進(jìn)行臨床轉(zhuǎn)化
文章來源公眾號:課題指南針 作者:課題指南針
目前腫瘤免疫是熱門研究方向,但是研究來研究去可能就那幾個關(guān)鍵的通路和靶點(diǎn),那么如何發(fā)現(xiàn)新靶點(diǎn)呢?一起來看下這篇最新的Nature文章是如何從0到1發(fā)現(xiàn)腫瘤免疫新靶點(diǎn),并通過藥物篩選與合成新的靶點(diǎn)小分子抑制劑進(jìn)行臨床轉(zhuǎn)化:NNMT inhibition in cancer-associated fibroblasts restores antitumour immunity,即抑制癌癥相關(guān)成纖維細(xì)胞中的NNMT可恢復(fù)抗腫瘤免疫力。

癌癥相關(guān)成纖維細(xì)胞(CAFs)在腫瘤生長和轉(zhuǎn)移中扮演關(guān)鍵角色,但針對CAFs的療法尚不明確。基于此,作者通過空間轉(zhuǎn)錄組學(xué)和單細(xì)胞RNA測序技術(shù),探討了NNMT在卵巢癌進(jìn)展中的作用。研究發(fā)現(xiàn)NNMT誘導(dǎo)的H3K27me3低甲基化促進(jìn)了CAFs分泌補(bǔ)體,吸引免疫抑制性髓源性抑制細(xì)胞(MDSCs)至腫瘤,從而影響腫瘤生長。通過基因敲除和高通量篩選,研究者開發(fā)出一種強(qiáng)效特異的NNMT抑制劑,該抑制劑能減少腫瘤負(fù)擔(dān)和轉(zhuǎn)移,并恢復(fù)免疫檢查點(diǎn)阻斷療效。
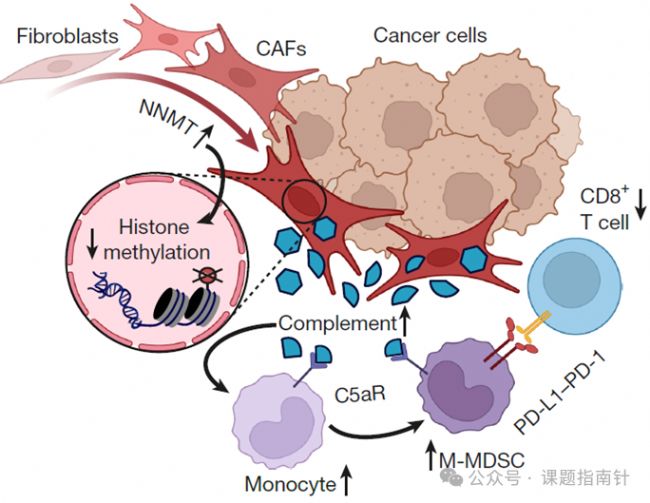
1、表型發(fā)現(xiàn):臨床樣本和數(shù)據(jù)庫發(fā)現(xiàn)NNMT在不同癌種的CAF中高表達(dá)
研究團(tuán)隊運(yùn)用多維度研究策略,首先通過對30名高級別漿液性卵巢癌(HGSOC)患者構(gòu)建的組織芯片進(jìn)行空間轉(zhuǎn)錄組學(xué)分析,同時結(jié)合7例HGSOC患者大網(wǎng)膜轉(zhuǎn)移灶的單細(xì)胞測序數(shù)據(jù),構(gòu)建了完整的CAF亞型圖譜,成功鑒定出8種不同的癌相關(guān)成纖維細(xì)胞(CAF)亞群;分析結(jié)果顯示煙酰胺N-甲基轉(zhuǎn)移酶(NNMT)的mRNA和蛋白表達(dá)水平呈現(xiàn)出從癌旁正常組織到原發(fā)腫瘤間質(zhì)再到轉(zhuǎn)移灶的逐級升高趨勢,且這種表達(dá)模式在所有8種CAF亞型中都保持一致的高表達(dá)特征;進(jìn)一步的免疫組化定量分析和免疫熒光共定位顯示,NNMT高表達(dá)區(qū)域與CD8⁺ T細(xì)胞數(shù)量減少呈顯著負(fù)相關(guān);為了驗(yàn)證這一發(fā)現(xiàn)的普適性,研究人員還深入分析了多個公共泛癌單細(xì)胞數(shù)據(jù)庫(包括肺癌、乳腺癌、結(jié)直腸癌等),發(fā)現(xiàn)NNMT在不同癌種的CAF中都存在保守的高表達(dá)模式。

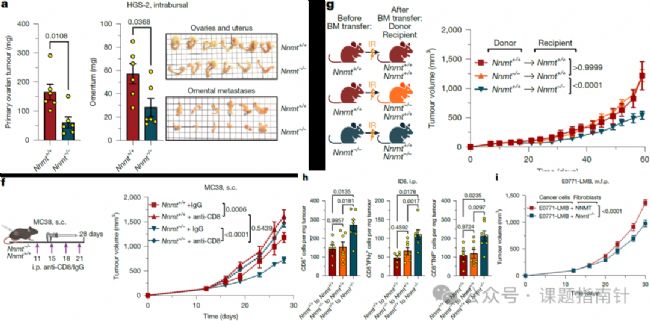
2、表型驗(yàn)證:腫瘤基質(zhì)的NNMT敲除抑制腫瘤生長
研究團(tuán)隊在多種免疫健全的全身性NNMT敲除(Nnmt⁻/⁻)小鼠腫瘤模型中驗(yàn)證其抗腫瘤效果:在Nnmt⁻/⁻小鼠的卵巢癌模型中,通過原位卵巢內(nèi)注射HGS-2細(xì)胞或腹腔注射ID8細(xì)胞,最終小鼠的原發(fā)卵巢腫瘤重量和網(wǎng)膜轉(zhuǎn)移灶重量均顯著低于野生型對照組,并且在腫瘤重量尚未出現(xiàn)顯著差異的早期Nnmt⁻/⁻小鼠腫瘤中CD8⁺ T細(xì)胞數(shù)量顯著增加,同時活化T細(xì)胞(體外經(jīng)PMA/離子霉素刺激后產(chǎn)生IFN-γ和TNF)比例明顯升高;在E0771-LMB乳腺癌模型(乳腺脂肪墊原位接種)、MC38結(jié)腸癌模型(皮下接種)、尾靜脈注射E0771-LMB細(xì)胞的肺轉(zhuǎn)移模型中均得到相同結(jié)果。
通過抗體介導(dǎo)的CD8⁺ T細(xì)胞耗竭實(shí)驗(yàn),發(fā)現(xiàn)清除CD8⁺ T細(xì)胞后,Nnmt⁻/⁻小鼠的抗腫瘤效應(yīng)完全消失,證明其抑瘤效果是CD8⁺ T細(xì)胞依賴性的。
骨髓嵌合體小鼠實(shí)驗(yàn)結(jié)果表明造血細(xì)胞中的Nnmt敲除不會改變腫瘤負(fù)荷,受體小鼠Nnmt缺陷抑制了腫瘤生長,并導(dǎo)致產(chǎn)生細(xì)胞因子的CD8+T細(xì)胞豐度增加;此外,相比于Nnmt敲除的成纖維細(xì)胞,Nnmt正常表達(dá)的成纖維細(xì)胞與E0771-LMB細(xì)胞原位共注射到Nnmt⁻/⁻小鼠乳腺脂肪墊中誘導(dǎo)的腫瘤更大,證明成纖維細(xì)胞而非造血細(xì)胞中的NNMT表達(dá)驅(qū)動腫瘤生長。
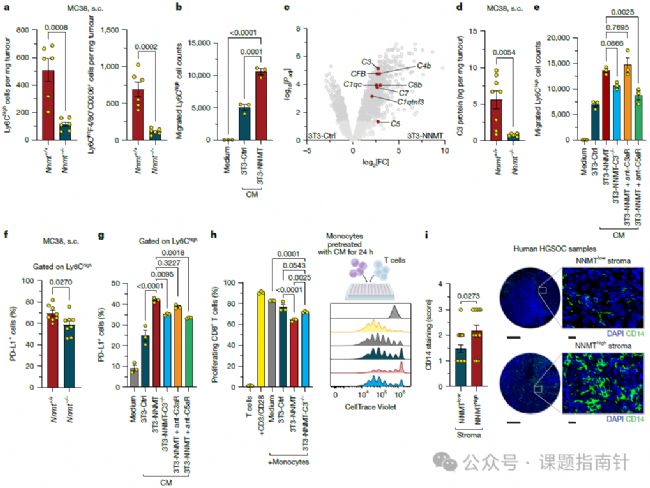
3、機(jī)制探究:表達(dá)NNMT的成纖維細(xì)胞通過補(bǔ)體分泌招募MDSCs
為了闡明NNMT如何介導(dǎo)免疫抑制,研究人員建立了NNMT過表達(dá)的NIH-3T3成纖維細(xì)胞模型(3T3-NNMT),通過RNA測序分析發(fā)現(xiàn)其基因表達(dá)譜中與髓系細(xì)胞遷移、活化和補(bǔ)體激活相關(guān)的通路顯著富集;蛋白質(zhì)組學(xué)分析細(xì)胞培養(yǎng)上清液顯示,3T3-NNMT細(xì)胞分泌的補(bǔ)體成分(包括C3、C1QA、C1QB、C1QC、CFB等)顯著增加,其中C3蛋白的分泌量增加了近5倍;在MC38結(jié)腸癌模型中,Nnmt⁻/⁻小鼠腫瘤組織中的C3蛋白水平顯著低于野生型小鼠,證實(shí)了體內(nèi)情況與體外實(shí)驗(yàn)的一致性;功能實(shí)驗(yàn)表明,3T3-NNMT的條件培養(yǎng)基能夠強(qiáng)力誘導(dǎo)Ly6Cʰⁱᵍʰ單核細(xì)胞的Transwell遷移,遷移細(xì)胞數(shù)量是對照組的3倍以上,而當(dāng)使用CRISPR-Cas9技術(shù)敲除C3基因后,這種趨化效應(yīng)被顯著抑制;進(jìn)一步研究發(fā)現(xiàn),這種單核細(xì)胞招募主要通過C5a-C5aR軸介導(dǎo),因?yàn)槭褂肅5aR拮抗劑能夠完全阻斷遷移效應(yīng),而C3aR拮抗劑則無此作用;流式細(xì)胞術(shù)分析顯示,在MC38和ID8腫瘤模型中,Nnmt⁻/⁻小鼠腫瘤內(nèi)的Ly6Cʰⁱᵍʰ單核細(xì)胞和Ly6CⁱⁿᵗF4/80⁺CD206⁺腫瘤相關(guān)巨噬細(xì)胞數(shù)量顯著減少,這兩種細(xì)胞都是已知的CD8⁺ T細(xì)胞強(qiáng)力抑制細(xì)胞。
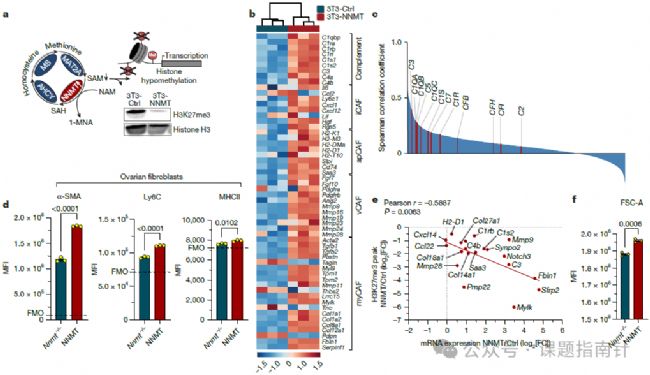
4、分子機(jī)制探究:NNMT驅(qū)動CAFs的表觀遺傳變化
研究人員深入探究了NNMT調(diào)控CAF功能的分子機(jī)制,發(fā)現(xiàn)NNMT通過消耗甲基供體SAM創(chuàng)造了一個"甲基化陷井":在低甲硫氨酸培養(yǎng)基中培養(yǎng)的3T3-NNMT細(xì)胞中,Western blot分析顯示組蛋白H3K27me3水平顯著降低,這表明NNMT過度表達(dá)確實(shí)導(dǎo)致了全局性的低甲基化狀態(tài);ChIP-seq分析進(jìn)一步揭示了這種表觀遺傳改變的具體基因組分布,發(fā)現(xiàn)H3K27me3的峰值大小在3T3-NNMT細(xì)胞中顯著減小,特別是在多個已知的促癌CAF基因(如編碼補(bǔ)體成分和細(xì)胞外基質(zhì)蛋白的基因)的啟動子區(qū)域;RNA-seq分析顯示,這些表觀遺傳變化伴隨著基因表達(dá)譜的顯著改變,包括多種CAF標(biāo)志物(如α-SMA、MHC II、Ly6C)的上調(diào),這表明NNMT表達(dá)足以誘導(dǎo)成纖維細(xì)胞獲得CAF樣表型;有趣的是,通過補(bǔ)充甲硫氨酸(SAM的前體)可以恢復(fù)SAM水平并阻止組蛋白低甲基化,同時顯著減弱NNMT驅(qū)動的補(bǔ)體因子C3和Cfb的轉(zhuǎn)錄誘導(dǎo),這進(jìn)一步證實(shí)了NNMT通過甲基代謝調(diào)控表觀遺傳的機(jī)制。
5、臨床轉(zhuǎn)化:治療策略開發(fā)與臨床前評估
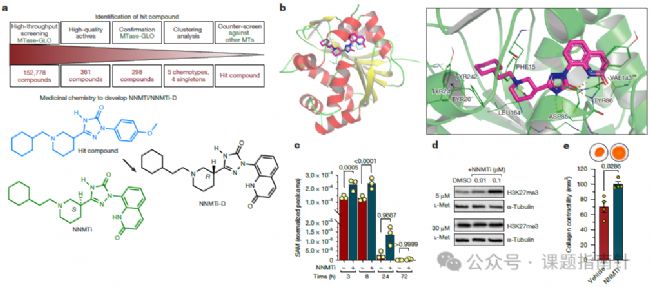
通過建立高通量篩選平臺,研究團(tuán)隊采用MTase-Glo法(檢測SAM向SAH的轉(zhuǎn)化)對包含152,778種化合物的化學(xué)庫進(jìn)行初步篩選,經(jīng)過劑量反應(yīng)驗(yàn)證和化學(xué)聚類分析,選定先導(dǎo)化合物并進(jìn)行了一系列藥物化學(xué)優(yōu)化,共合成了350多個結(jié)構(gòu)類似物,最終獲得了IC₅₀值低于10 nM的NNMT特異性抑制劑(NNMTi),并同步合成了活性降低200倍以上的非活性對映體(NNMTi-D)作為嚴(yán)格的陰性對照;在藥效學(xué)評估中,研究人員采用了多種給藥途徑(腹腔注射、瘤內(nèi)注射、口咽吸入)和多種小鼠腫瘤模型(HGS-2卵巢癌、MC38結(jié)腸癌、E0771-LMB乳腺癌),結(jié)果顯示NNMTi單藥治療能夠顯著降低腫瘤負(fù)荷(抑瘤率達(dá)60-80%)和轉(zhuǎn)移發(fā)生率,并通過LC-MS/MS檢測證實(shí)腫瘤內(nèi)1-MNA水平劑量依賴性下降;深入的機(jī)制研究表明,NNMTi治療后腫瘤微環(huán)境發(fā)生顯著重塑:免疫組化和流式細(xì)胞術(shù)分析顯示α-SMA⁺ myCAFs和Ly6C⁺ iCAFs等促癌CAF亞群比例下降,H3K27me3水平回升,C3蛋白分泌減少,Ly6CʰⁱᵍʰPD-L1ʰⁱᵍʰ M-MDSCs數(shù)量減少約50%,而活化的CD8⁺ T細(xì)胞(CD69⁺IFN-γ⁺)數(shù)量增加2-3倍;最令人鼓舞的是,當(dāng)NNMTi與臨床常用免疫檢查點(diǎn)抑制劑(抗PD-1抗體或抗CD47抗體)聯(lián)合使用時,在多種模型中均觀察到顯著的協(xié)同效應(yīng),聯(lián)合治療組腫瘤完全消退率可達(dá)40%,且能有效逆轉(zhuǎn)E0771-LMB等免疫治療耐藥模型的治療抵抗,為臨床轉(zhuǎn)化提供了強(qiáng)有力的實(shí)驗(yàn)依據(jù)。
- Th1細(xì)胞極化因子的核心網(wǎng)絡(luò)與信號機(jī)制及在自身免疫病理中的雙重作用
- 干細(xì)胞和免疫細(xì)胞在來源、功能、臨床應(yīng)用上的區(qū)別與共同點(diǎn)
- 組織保存液的作用、特性、使用方法及在科研實(shí)驗(yàn)中的應(yīng)用
- Nature文章分享:警示PD-1療法可能以犧牲長期免疫力換取短期療效
- IL-4/IL-21/IL-10/BAFF等B細(xì)胞極化因子的作用機(jī)制及在疾病中的應(yīng)用
- 大鼠小膠質(zhì)細(xì)胞提取與分選攻略
- 人/小鼠CD8+ T細(xì)胞分選試劑盒特點(diǎn)及驗(yàn)證數(shù)據(jù)
- IL-10細(xì)胞因子的信號通路、調(diào)控機(jī)制及在自身免疫性疾病治療中的應(yīng)用






