抵抗素誘導巨噬細胞與平滑肌細胞共培養體系中細胞從增殖向凋亡轉變
動脈粥樣硬化性心血管疾病中,斑塊不穩定性是導致中風、心肌梗死等臨床事件的關鍵原因。其核心在于斑塊易損性,而纖維帽變薄、壞死核心形成、炎性巨噬細胞浸潤增加及大量凋亡細胞構成的壞死核心,均會提升斑塊易損性,其中冠狀動脈和頸動脈的薄帽斑塊更易破裂。血管平滑肌細胞和巨噬細胞是斑塊發展的主要細胞。血管平滑肌細胞通過遷移、增殖和產生基質促進內膜增厚與纖維帽形成。巨噬細胞可在促炎的 M1 型和修復性的 M2 型間轉換,且 M1 型在易破裂斑塊區域更常見。
抵抗素是一種由巨噬細胞分泌的促炎脂肪因子,研究發現其與頸動脈手術患者的炎癥增強相關,且體外實驗顯示抵抗素可促使巨噬細胞向 M1 樣表型轉化、誘導血管平滑肌細胞功能障礙。PKCε 作為抵抗素作用的重要上游調節因子,會介導下游信號加劇細胞功能障礙和炎癥。
基于此,美國帕洛阿爾托醫療保健系統血管外科的研究團隊探討了在細胞間存在通訊與相互作用的情況下,生理水平的抵抗素對血管平滑肌細胞和巨噬細胞的影響。研究采用間接和直接共培養模型,分別考察細胞分泌物和直接細胞接觸條件下抵抗素的作用,并聚焦于與斑塊穩定性相關的細胞增殖、炎癥反應及細胞死亡等方面。研究成果發表在Surgery期刊,題為“Physiological levels of resistin induce a shift from proliferation to apoptosis in macrophage and VSMC co-culture”。

首先,研究人員發現在間接共培養體系中,未處理的巨噬細胞條件培養基對血管平滑肌細胞(VSMC)增殖有輕微促進作用,而經抵抗素處理的巨噬細胞條件培養基的促進作用更明顯(圖 1)。抵抗素處理能顯著增強 VSMC 增殖,且若提前用 εV1-2 抑制巨噬細胞中的 PKCε,這種增殖促進效應會減弱(p<0.05)。
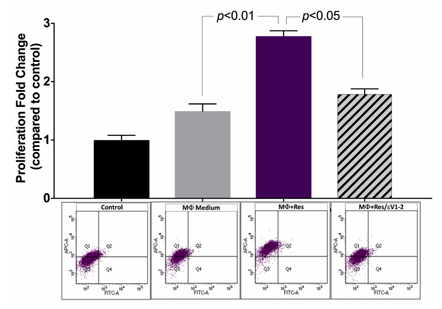
圖1 間接共培養可促進 VSMC 增殖,且抵抗素通過PKCε 進一步增強該增殖作用
為了進一步研究巨噬細胞分泌物對 VSMCs的影響,研究人員通過檢測增殖標志物(PCNA、cyclin D1)和炎癥指標(NFκB-2)的基因表達發現,經抵抗素處理的巨噬細胞條件培養基可顯著上調 VSMCs 中上述標志物的表達(圖 2A和B),而抑制 PKCε 可減弱這些效應,使基因表達回到接近對照組的水平。

圖2 巨噬細胞分泌物上調 VSMCs 中增殖和炎癥標志物的基因表達
接下來,研究人員直接共培養中巨噬細胞與血管平滑肌細胞的不同比例。結果顯示,未處理的巨噬細胞能促進體系增殖,其中血管平滑肌細胞:巨噬細胞為 1:4 時增殖顯著增加,1:6 時趨于穩定(圖 3A),故后續實驗選用 1:4 比例。向該體系加入抵抗素后,24 小時和 48 小時增殖細胞數量逐漸減少,凋亡細胞數量增加,且這種從增殖向凋亡的轉變由 PKCε 介導(圖 3B–C)。
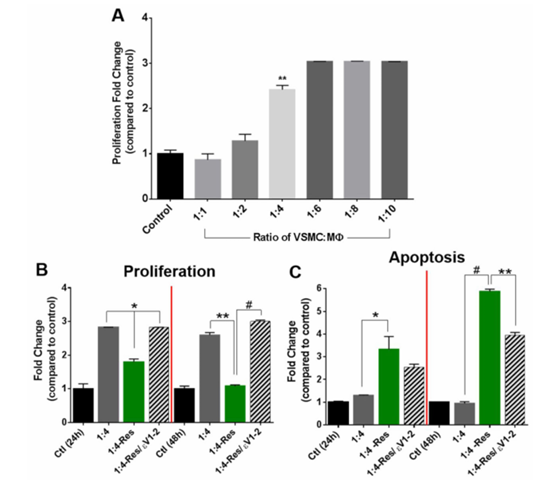
圖3 直接共培養可刺激細胞增殖,但抵抗素會誘導細胞向凋亡轉化。
最后,為了進一步研究直接細胞間相互作用下抵抗素對細胞狀態的影響,研究人員將細胞與抵抗素共培養 48 小時后,對增殖標志物、炎癥標志物及凋亡標志物的基因表達情況進行了分析,結果發現,抵抗素處理使共培養體系在轉錄水平呈現從增殖向凋亡的轉變:48 小時后增殖標志物基因表達無變化(圖 4A),炎癥標志物表達與間接共培養類似(圖 4B)。但凋亡標志物 caspase 3 和 caspase 8 表達上調(圖 4C),且 PKCε 在該轉變中的作用得到進一步確認。
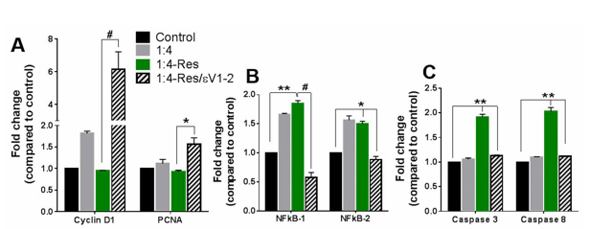
圖4 直接的細胞間相互作用使抵抗素能夠上調凋亡標志物。
總之,該研究表明,在細胞組成接近斑塊易損區域的血管平滑肌細胞與巨噬細胞共培養體系中,抵抗素會促使細胞從增殖轉向凋亡,而這一過程由 PKCε 介導。這意味著 PKCε 可能成為治療抵抗素相關動脈粥樣硬化并發癥的潛在靶點。
參考文獻:Zuniga MC, Raghuraman G, Zhou W. Physiologic levels of resistin induce a shift from proliferation to apoptosis in macrophage and VSMC co-culture. Surgery. 2018 Apr;163(4):906-911. doi: 10.1016/j.surg.2017.10.051. Epub 2018 Feb 1. PMID: 29361366; PMCID: PMC5857465.
原文鏈接:https://pubmed.ncbi.nlm.nih.gov/29361366/
圖片來源:所有圖片均來源于參考文獻
小編旨在分享、學習、交流生物科學等領域的研究進展。如有侵權或引文不當請聯系小編修正。如有任何的想法以及建議,歡迎聯系小編。感謝各位的瀏覽以及關注!進入官網www.naturethink.com或關注“Naturethink”公眾號,了解更多相關內容。
點擊了解:仿生多細胞動態共培養系統






