文章解讀:in vivo CAR-T療法中VivoVec慢病毒遞送系統的研究
文章來源公眾號:落花微雨的知識樹 作者:心字疊衣
最近,in vivo CAR-T療法無疑成為了生物醫學領域最炙手可熱的話題!從學術會議到投資論壇,從科研論文到媒體報道,這股熱潮幾乎席卷了整個生命科學界。網絡上關于這項技術的討論呈現出明顯的兩極分化——支持者視其為癌癥治療的終極解決方案,質疑者則對其安全性和商業化前景持保留態度。但無論爭議如何,in vivo CAR-T療法的迅猛發展本身就說明了其巨大的潛力和價值。
作為科研工作者,我們更需要透過現象看本質。與其被外界的喧囂所干擾,不如靜下心來深入研讀幾篇高質量的文獻,從基礎機制到臨床數據,從技術瓶頸到未來方向,真正理解這項技術的核心所在。今天,就讓我們一起開啟這場in vivo CAR-T的文獻探索之旅!
這是2024年8月份發表在blood的一篇文章:In vivo CAR T-cell generation in nonhuman primates using lentiviral vectors displaying a multidomain fusion ligand. 雖然這不是最新的文獻,但是VivoVec是Umoja Biopharma開發的慢病毒遞送系統,所以這篇文獻還是值得學習一下的。說起來,這是解讀的第二篇,第一篇詳見:文獻閱讀[1]-CAR T cells produced in vivo to treat cardiac injury
01:文章前言
文章里作者提到了目前普通CAR-T制備的問題:一個主要的問題制備復雜,需要從每個患者身上收集大量的T細胞,將細胞運送到專門的制造中心,通過進行體外基因編輯和T細胞擴增,將其制備成最終的產品,期間需要進行QC,最終才能將CAR-T細胞產品回輸。這一過程導致了在初始T細胞收集和最終產品回輸之間存在大量的等待期。此外,CAR-T回輸前也需要進行清淋,而且有時候伴隨著較大的毒性,需要住院治療。目前CAR-T細胞的制備和給藥過程的復雜性,以及高昂的成本使得只有一小部分符合條件的患者可以獲得CAR-T細胞治療。
基于此,作者開發了VivoVec系統:
基礎載體類型:是第三代自失活慢病毒載體。這類載體經過基因工程改造,刪除病毒復制所需基因,且啟動子區域具有自失活設計,可降低插入突變風險,符合臨床安全性要求。
表面展示的功能元件:
1)載體表面展示抗CD3單鏈可變片段。該scFv是人工設計的抗體片段,能特異性結合T細胞表面的CD3分子,實現載體對T細胞的靶向性結合。
2)偽型化包膜蛋白:載體采用低密度脂蛋白受體趨向性的cocal融合糖蛋白進行偽型化:cocal糖蛋白是囊泡性口炎病毒G蛋白(VSV-G)的結構類似物,但具有更強的生物學特性:抗血清滅活能力,相比傳統VSV-G包膜,cocal蛋白能抵抗人體補體系統的中和作用,確保載體在體內循環時保持穩定,避免被快速清除。病毒的cocal通過與細胞表面的LDLR識別,從而將CAR基因傳遞到T細胞內。
3)同時表達CD80和CD58共刺激配體;
02:文章正文
2.1 VVPs displaying CD80 and CD58 generate greater numbers of CAR T cells with increased in vitro and in vivo antitumor functionality.
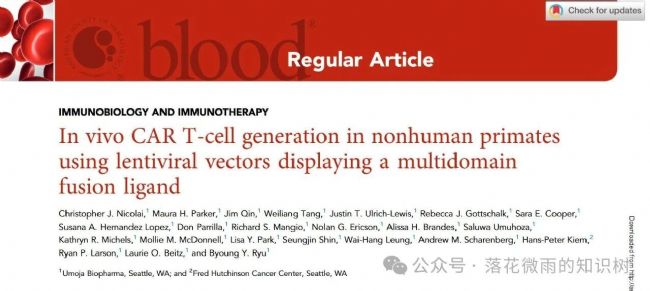
抗原遞呈細胞同時向T細胞提供peptide-MHC抗原呈遞和共刺激信號,從而使得T細胞活化。這些信號對于確保T細胞激活,促進分化,獲得效應功能和形成長期記憶至關重要。CD28和CD2,以及它們各自的配體CD80和CD58,是構成T細胞-抗原提呈細胞的關鍵共刺激信號。作者猜測,在先前展示抗CD3 scFv的VVPs中加入CD80和CD58共刺激配體,將增強其激活T細胞的能力,從而產生具有改善抗腫瘤功能的CAR T細胞。為了驗證這一假設,作者構建了VVPs和共表達CD80和CD58的VVPs,并在體外培養的健康人PBMCs中評估2種共刺激配體的作用(S1A-B)。不同于典型的使用抗CD3/CD28磁珠刺激的體外制備CAR-T細胞的方案,VVPs直接添加到PBMCs中,而不需要任何外源性刺激。共刺激分子的加入大大增強了病毒顆粒結合T細胞的能力(S1C)。
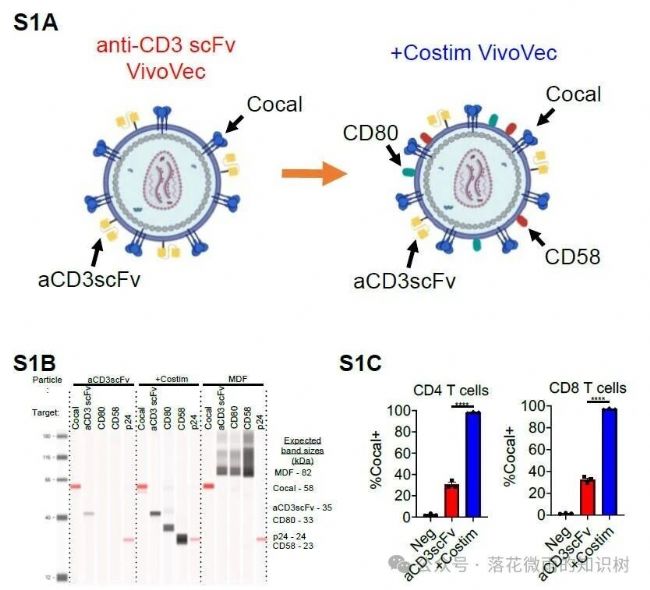
而且共刺激分子的加入也導致短期T細胞活化增強,這里是VVPs加入三天后,通過流式檢測CD25的表達水平驗證的(1A)。
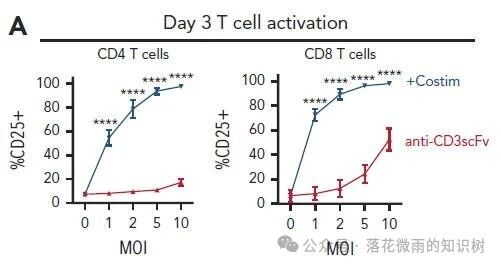
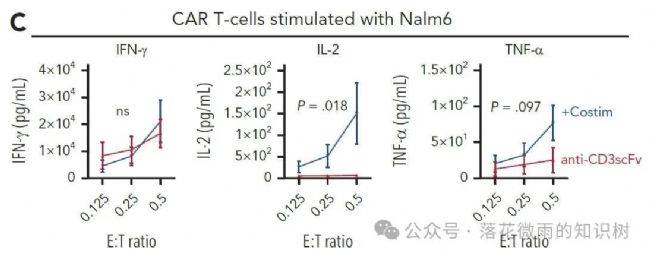
而且共刺激分子的加入也導致T細胞釋放了更多的細胞因子,包括IFNγ,IL-2和TNF-α(S1D)。
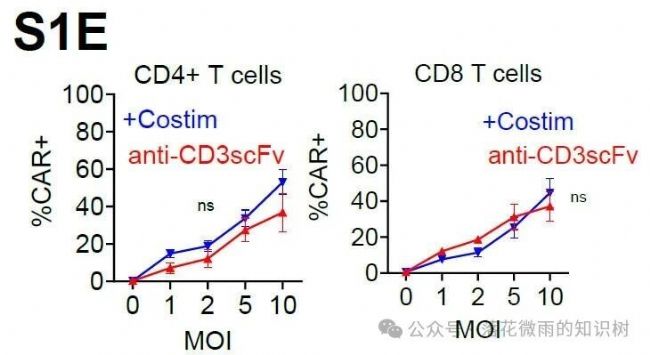
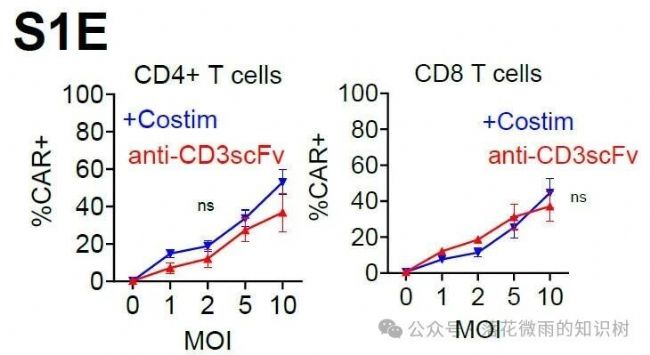
不論是否含共刺激配體的VVPs都能產生相似比例的CAR-T細胞(S1E)。
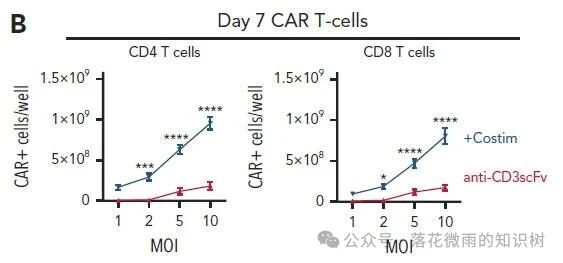
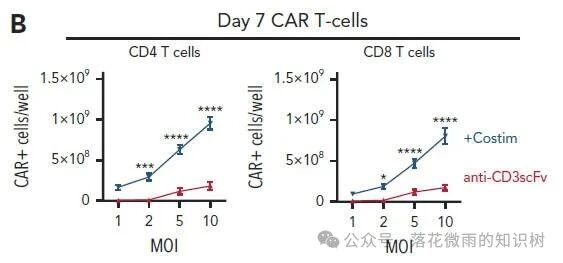
但是有共刺激配體的VVPs可以產生更多的CAR-T細胞(1B)。
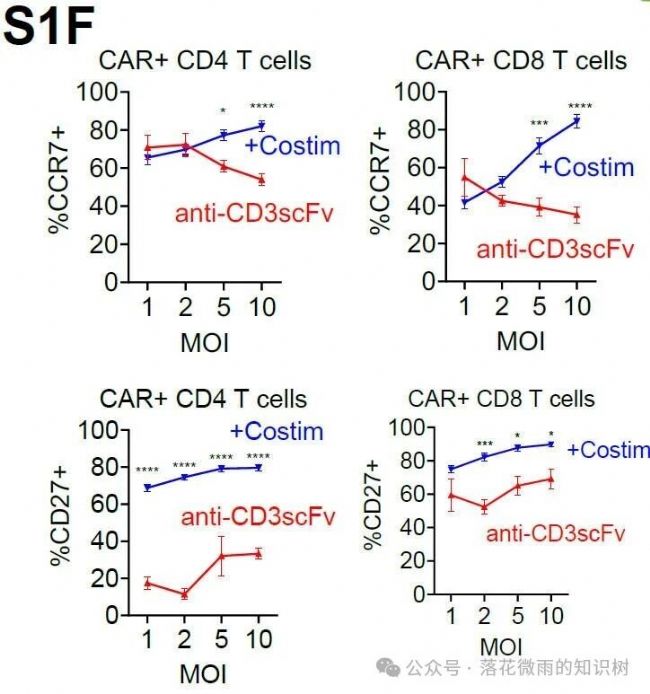
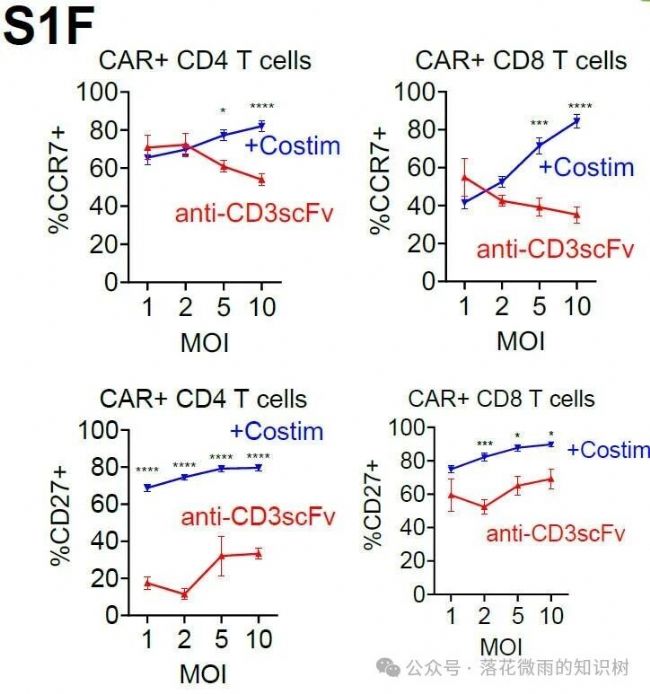
表型上,表達共刺激分子的VVPs產生的CAR-T細胞表面表達更多的CCR7和CD27(S1F)。這兩個marker是記憶性T細胞群相關的標志物,與體外CAR-T細胞治療的臨床反應呈正相關。總的來說,這些數據表明,含有CD80和CD58共刺激配體的VVPs表現出增加的T細胞結合和激活,從而導致更多的CAR-T細胞生成,并具有較低分化的T細胞表型。
將表達或不表達共刺激分子的VVPs產生的CAR-T細胞分別與Nalm-6細胞以不同的ET比共培養,24小時后,檢測細胞因子的表達。表達共刺激分子的VVPs組的CAR-T細胞比單獨表達抗CD3 scFv的VVPs產生的IFNγ的量相似,但IL2和TNF-α的水平更高(1C)。
表達共刺激分子的VVPs組的CAR-T細胞與Nalm-6細胞共培養后,CAR-T細胞擴增的也更多。這里是由CellTrace dilution來判斷的。從圖中可以看到,Costim組的CellTrace的熒光都偏弱,說明這個組的CAR-T細胞擴增更強,造成CellTrace Dye被稀釋(S1G)。
將VivoVec生成的抗CD19 CAR-T細胞(分兩組:含共刺激分子CD80/CD58的VVPs vs. 僅含anti-CD3 scFv的VVPs)與表達CD19的腫瘤細胞(Nalm6)共培養。每2-4天移除舊培養基,重新添加新鮮腫瘤細胞(圖中箭頭表示刺激時間點),持續監測腫瘤細胞數量變化(通過熒光標記定量)。含共刺激分子的VVPs組的CAR-T細胞持續抑制腫瘤生長,即使在多次刺激后仍能有效控制腫瘤細胞數量(圖中藍色曲線維持低位)。僅含anti-CD3 scFv的VVPs組,隨刺激次數增加,腫瘤細胞逐漸增殖(紅色曲線上升),表明CAR-T細胞功能衰竭或持久性不足(1D)。
雌性Nod.Cg-PrkdcscidIL2rgtm1Wjl/SzJ小鼠(這個小鼠重度免疫缺陷導致T/B細胞缺失;IL2rg基因敲除缺乏NK細胞;MHC I/II雙敲除)。Day -4,通過 尾靜脈注射 2.5E5個 Nalm6細胞。Day -1,用 IVIS測量小鼠腫瘤負荷。根據腫瘤大小隨機分組,確保組間基線一致。通過腹腔注射2E7個PBMCs。Day 0,腹腔注射攜帶CAR基因的 VivoVec病毒顆粒(劑量根據分組調整),體積200 μL(S1E)。
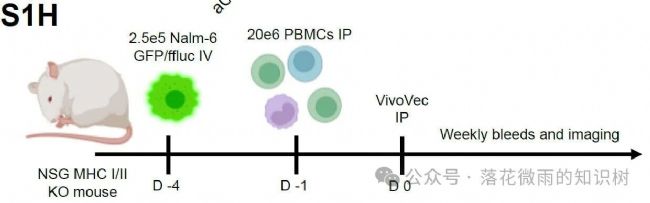
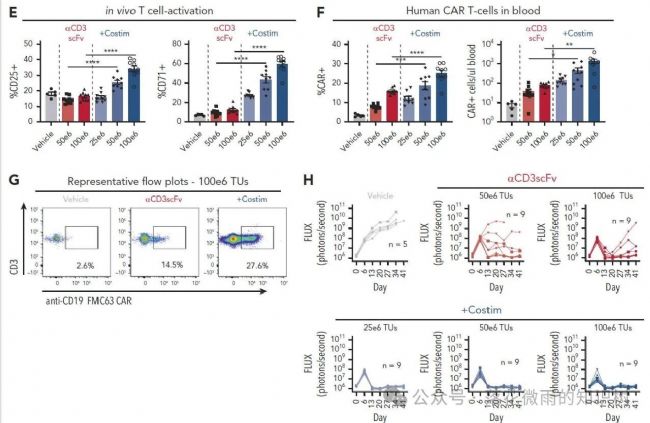
VVP給藥4天后,取小鼠的外周血,通過流式細胞術定量分析人源CD3+ T細胞表面CD25和CD71的表達水平,評估其活化狀態。1E的橫坐標代表的是不同VivoVec病毒顆粒的注射劑量,單位為轉導單位(TU)。與體外研究結果一致,表達帶有共刺激配體的抗CD3 scFv的VVPs比單獨表達抗CD3 scFv的VVPs誘導了更強的T細胞活化,且呈劑量依賴性。VVP給藥11天后檢測外周血中CAR-T細胞頻率。用含共刺激配體的抗CD3 scFv的VVPs處理的動物顯示出更多的CAR-T細胞數量(1F-G)。最后,對腫瘤負荷進行評估,使用共刺激配體表達抗CD3 scFv的VVPs治療,在VivoVec病毒顆粒較低劑量下腫瘤抑制作用就很強了(1H)。
2.2 An MDF protein comprising costimulatory molecules enhances T-cell activation and transduction.
作者設計了一種包含多個結構域的蛋白(MDF):包括CD58、抗CD3 scFv和CD80組成的單鏈長肽。這樣可以簡化VVPs的制備,并且成功將MDF成功展示在病毒表面(S2A)。
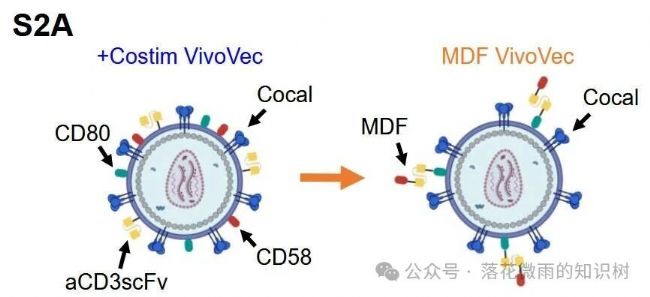
出乎意料的是,與單獨的抗CD3 scFv或含有共刺激分子的病毒顆粒相比,MDF VVPs與T細胞的結合要更多(2A),并導致更高的T細胞CD25表達(2B)。
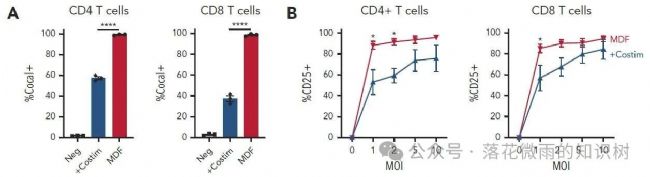
但是MDF VVPs病毒顆粒誘導的細胞因子并沒有明顯增加(S2B)。
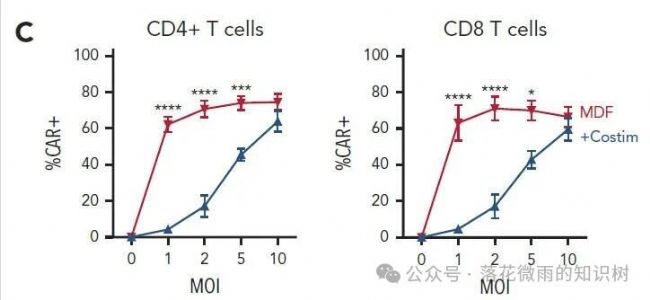
值得注意的是,MDF VVPs在體外能更有效地產生CAR-T細胞,尤其是在低感染復數時(2C)。
與含有共刺激分子的病毒顆粒相比,MDF VVPs制備的CAR-T細胞表面表達相當的CCR7和CD27記憶細胞標志物(S2C)。
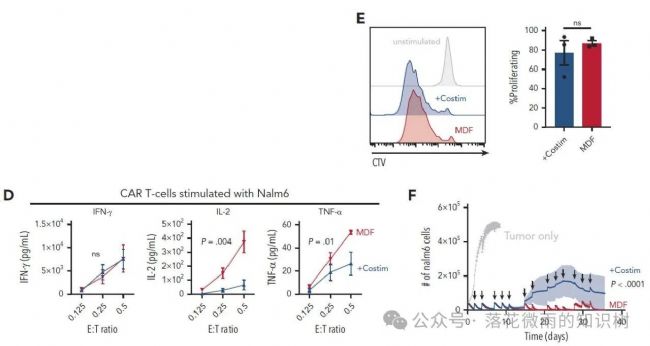
接下來就是,與表達共刺激分子的VVPs組相比,MDF VVP產生的抗CD19 CAR-T細胞在與Nalm6細胞共培養時,CAR-T細胞擴增的量差不多(2E),IFNγ產生量差不多(2D),但產生更多的IL-2和TNF-α(2D),提示MDF VVP產生的CAR-T細胞可能具有更好的功能性。在連續刺激實驗中,MDF VVP產生的CAR-T細胞能夠更好地控制Nalm6腫瘤的生長(2F)。
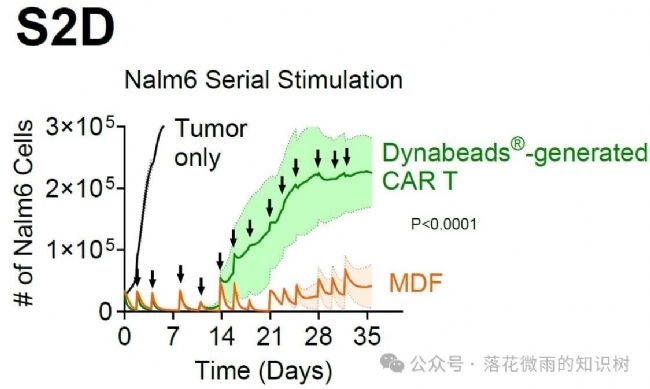
在連續刺激實驗中,MDF VVP產生的CAR-T細胞甚至優于使用傳統的CD3/CD28 beads為基礎的刺激方案產生的CAR-T細胞(S2D)。
2.3 MDF VVPs exhibit enhanced in vivo functionality in a humanized mouse leukemia model.
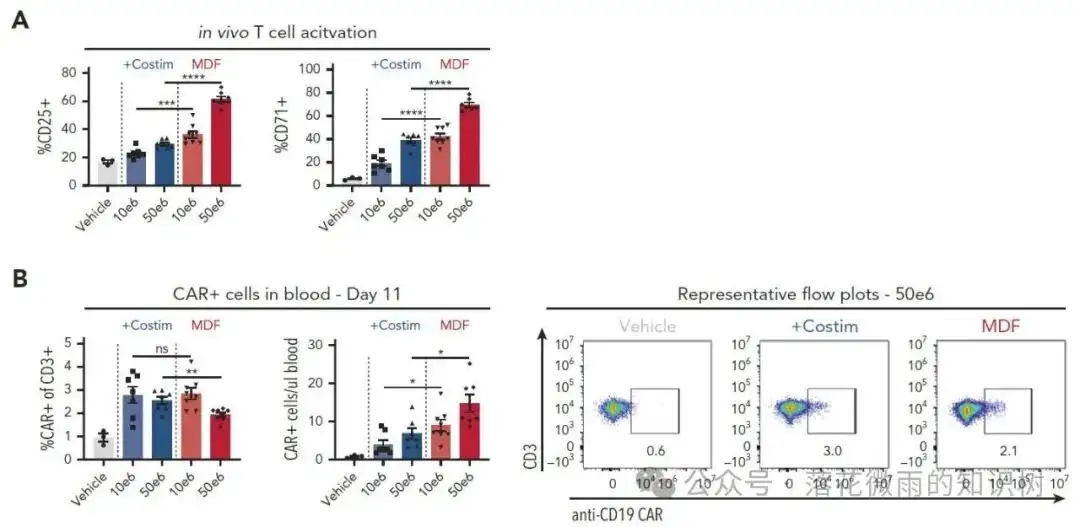
作者再次使用NSG MHC I/II KO模型驗證MDF VVP的抗腫瘤作用。 VVP給藥4天后,取小鼠的外周血,通過流式細胞術定量分析人源CD3+ T細胞表面CD25和CD71的表達水平,評估其活化狀態。與體外研究結果一致,MDF VVPs比表達共刺激的VVPs誘導了更強的T細胞活化,且呈劑量依賴性(3A)。VVP給藥11天后,作者觀察到兩種病毒顆粒在血液中產生了相似比例的CAR-T細胞,但MDF VVPs病毒顆粒可以產生更多的CAR-T細胞數目(3B)。這里與Figure1相比,3B中CAR-T細胞的數目明顯少了很多,作者給出的解釋是因為不同donor不一樣的原因。
雖然兩種病毒顆粒均能控制腫瘤生長,但MDF VVPs在控制腫瘤生長和總生存期方面表現略好。
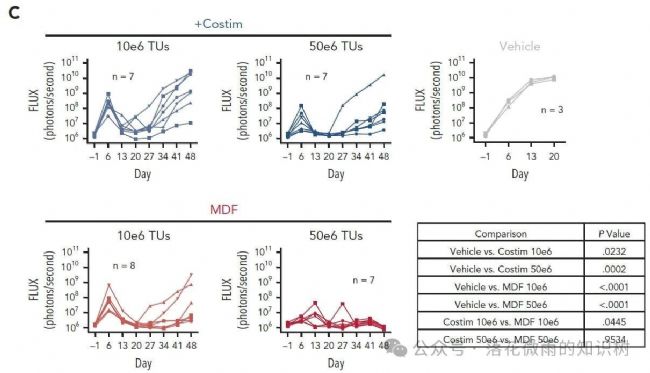
這在10E6個轉導單位的較低劑量時尤為明顯,MDF VVPs治療動物的中位生存期為90.5天,而表達共刺激分子的病毒顆粒組的中位生存期為62天(3D)。值得注意的是,在50E6個轉導單位的較高劑量下,MDF VVP處理的動物在研究期間達到了100%的存活率。這些數據表明,在這個模型中,展示MDF蛋白的VVPs相對于表達抗CD3 scFv和表達共刺激配體的VVPs具有更好的抗腫瘤效果。
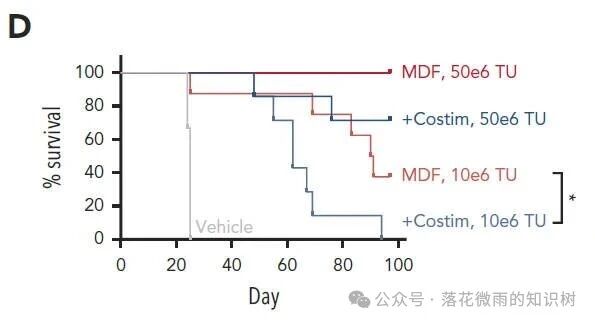
2.4 MDF VVPs administered intranodally induce potent and prolonged B-cell depletion in NHPs.
人源化小鼠模型具有局限性,并不能完全再現動物免疫系統的完整程度,特別是完全缺乏正常發育的次級淋巴組織和對異種移植物抗宿主病的易感性。為了解決這些局限性,作者在M nemestrina中開發了一個NHP模型,因為該物種允許用HIV-1衍生的慢病毒載體轉導。在這個模型中,作者使用了一種NHP/人交叉反應的抗CD20 CAR,此前已經證明在恒河猴體內使用體外制造的CAR-T細胞可以消除B細胞。為了使MDF蛋白適用于該模型,作者將抗人CD3 scFv替換為抗NHP CD3 scFv。人的CD58和CD80保留下來,因為這兩種蛋白在這兩個物種中的序列具有高度同源性(S3A)。
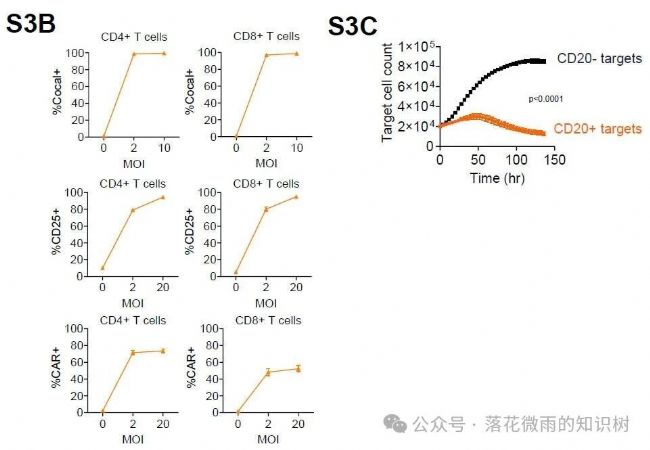
評估MDF VVPs的NHP替代物對M.nemestrina CD4和CD8 T細胞的結合、激活和轉導進行體外驗證(S3B)。與靶細胞LLC-MK2-NLO+/-CD20共培養,驗證CAR-T細胞的細胞殺傷功能(S3C)。總的來說,這些結果表明,NHP MDF VVPs結合、激活和轉導NHP T細胞的能力與人MDF VVPs相當。
NHP模型:簡言之,通過淋巴結注射,將攜帶抗CD20 CAR負載的NHP MDF VVPs以不同劑量注射到4只動物的淋巴管系統。與靜脈給藥途徑相比,選擇淋巴結給藥途徑可以實現有效的病毒顆粒與T細胞相互作用,同時減少全身組織對游離病毒顆粒的暴露。動物每周取血1-2次,通過流式細胞術檢測病毒顆粒誘導的T細胞活化、CAR表達和隨后的B細胞耗竭。同時對動物進行CRS和ICANS體征監測。在這個實驗中,作者既沒有清淋,也沒有額外補充細胞因子。其中,1只動物(Z20020)接受了低劑量的VVPs(原劑量的五分之一)。
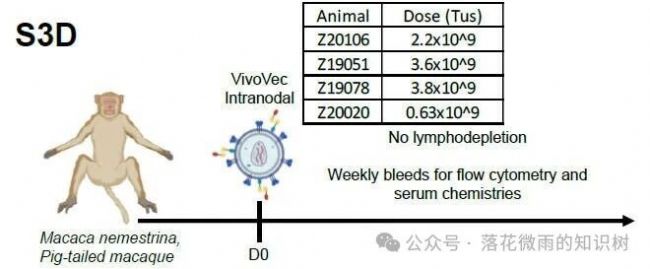
給藥后7天,4只動物中有3只觀察到NHP MDF VVP誘導的T細胞活化(4A)。在這3只動物中,NHP MDF VVP給藥效果顯著,在第10天產生的CAR T細胞占循環T細胞的比例高達65% (4B),相當于每微升血液中含有5963875和11182個CAR-T細胞。低劑量組的Z20020, 作者沒有觀察到明顯的T細胞活化,CAR的表達,也沒有觀察到B細胞的消除。
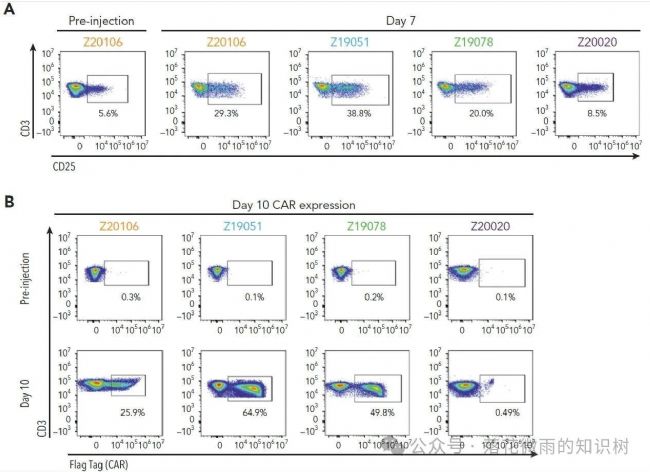
正如預期的那樣,到第7天,在所有檢測到CAR-T細胞的動物中,循環B細胞都檢測不到了。說明CAR-T細胞大量產生與B細胞消除是同時出現的(4C-D)。相比之下,在產生CAR-T細胞的3只動物中,循環B細胞的丟失是一致的,也非常持久。在治療后的第56、63和76天,循環B細胞幾乎檢測不到(Z19051稍微差一點,B細胞在63和76還是能看到一點B細胞)。值得注意的是,1只動物( Z20106 )在第49天顯示出大量的血液CAR T細胞的重新擴增,以應對在研究的第42天明顯的少量B細胞的再次出現。這表明VivoVec產生的CAR-T細胞具有持久性,這預示著記憶性CAR-T細胞的產生。與記憶性T細胞的形成一致,B細胞也在第二只動物的第43天( Z19078 )的循環中重新出現,然后在第49天再次丟失。直到第63天,B細胞在該動物中仍然檢測不到,這表明抗原特異性記憶CAR-T細胞功能持續存在。
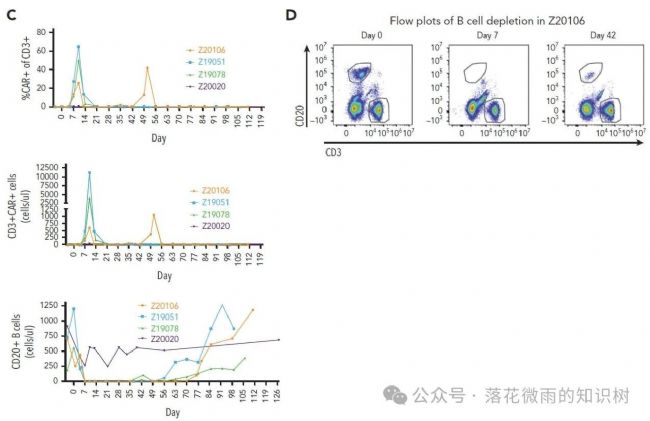
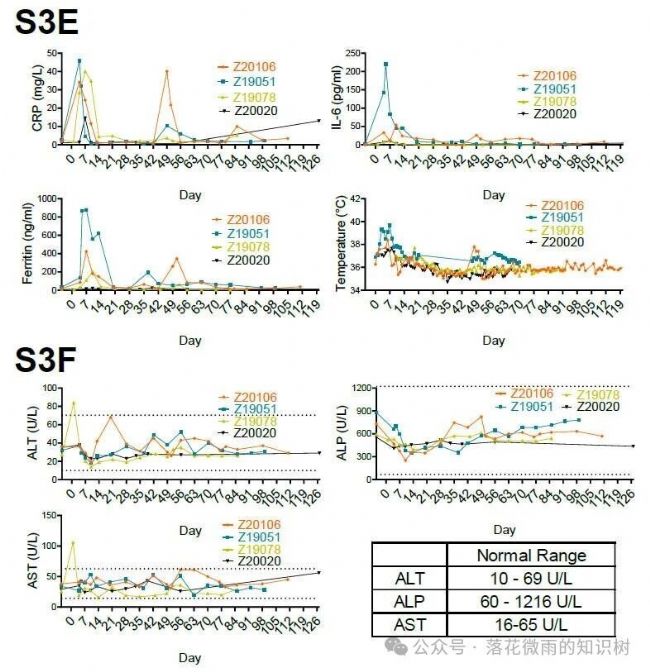
在CRS方面,作者在血液(S3E)中檢測到,CAR-T細胞產生的前不久就會觀察到C反應蛋白(CRP)水平升高,這表明這是CAR-T細胞介導的,而不是病毒顆粒導致的。這是短暫的,隨著CAR-T細胞在第14天從血液中消失,CRP水平正常化。如上所述,1只動物在第49天經歷了血液CAR-T細胞的回升(4C),這也再次伴隨著CRP的短暫升高。IL-6,鐵蛋白和溫度遵循類似的規律。除了CRS癥狀,作者在前2只動物中觀察到輕微的震顫和短暫的癲癇。這些事件是短暫的,與第10天觀察到的CAR-T細胞擴增峰值相吻合。給予托珠單抗和阿那白滯素治療后震顫消失。作者沒有觀察到任何明顯的肝臟毒性的跡象,與谷丙轉氨酶,谷草轉氨酶,堿性磷酸酶仍然保持在正常水平,除1只動物的谷丙轉氨酶和谷草轉氨酶在第1天出現短暫輕度升高外(S3F)。
取VVP治療最長時間(139天)的1只動物進行剖檢,20種不同組織通過ddPCR評估載體基因組整合。在注射的部位inguinal lymph node和緊接著的medial iliac lymph node可以檢測到抗CD20 CAR轉基因。但是在其它組織中并沒有檢測到,這表明在VivoVec處理后,轉基因細胞主要被隔離在注射和鄰近的淋巴結中幾個月(4E)。
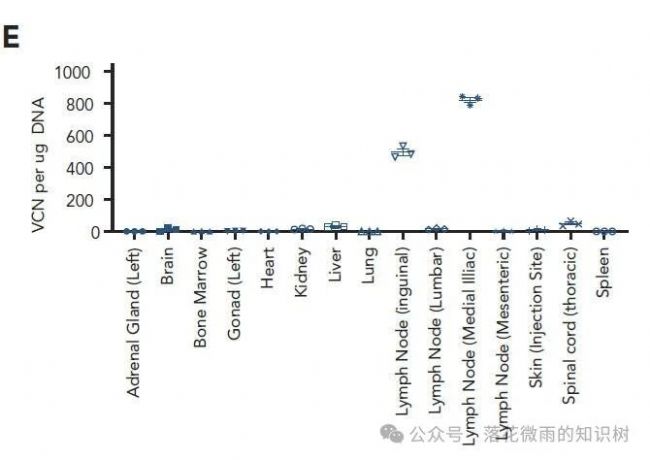
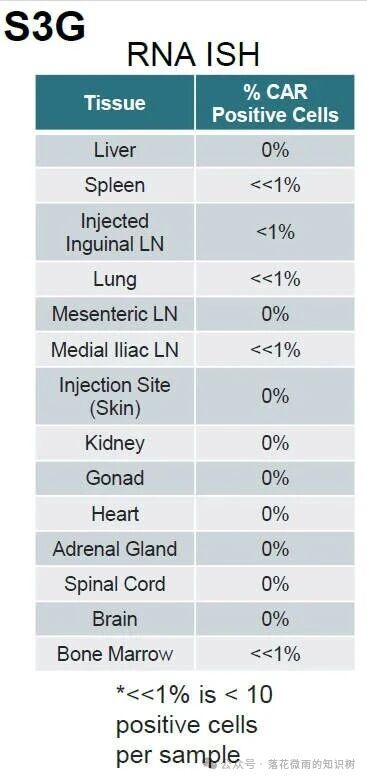
作者通過RNA ISH檢測了CAR基因的生物分布(S3G)。與ddPCR數據一致,作者在注射的部位inguinal lymph node和緊接著的medial iliac lymph node可以檢測到極少數細胞中CAR的表達。還在脾臟、骨髓和肺中檢測到低水平的信號,作者認為這些信號是CAR+細胞向這些部位轉運的標志。此外別的組織內依然檢測不到。總的來說,這些數據表明,VivoVec通過淋巴內注射,在沒有清淋的情況下,可以在免疫健全的NHP中有效地生成CAR-T細胞。生成的CAR-T細胞功能強大,導致B細胞清除長達76天。
03:方法參考
3.1 Vector production:
將5種質粒同時轉入懸浮培養的HEK 293T細胞:gag pol(編碼病毒結構蛋白(衣殼、酶等)); rev(協助病毒RNA轉運出細胞核); cocal(編碼低密度脂蛋白受體嗜性的病毒包膜糖蛋白(替代VSV-G)); MDF(編碼多域融合蛋白); payload(攜帶目標CAR轉基因, 如抗CD20 CAR)。轉染16小時后加入含15 U/mL Denarase(一種核酸酶)的新鮮培養基,降解殘留DNA/RNA以降低粘度并提高載體純度。次日收獲上清,用陰離子交換層析(Mustang Q色譜柱)初步純化,通過切向流過濾濃縮并置換緩沖液,通過0.2 μm PES濾膜除菌過濾,最后分裝冷凍最終病毒載體產品(VVPs)。
3.2 Particle binding:
PBMCs與病毒顆粒在室溫下共培養1-4 h,每毫升病毒對應2E7個細胞,感染復數(也就是MOI)為2-10。使用anti-cocal antibody通過流式評估病毒顆粒/T細胞結合。這里的cocal是表達在VVPs病毒顆粒表面的糖蛋白,病毒顆粒與細胞共孵育后短時間內(1-4小時)進行的檢測。這個時間點主要發生的是病毒顆粒與細胞表面的特異性結合(通過MDF蛋白),還來不及發生高效的病毒轉導和細胞內基因表達。此時檢測到的cocal信號幾乎完全來源于附著在T細胞表面的完整病毒顆粒上的cocal包膜糖蛋白,并非來源于T細胞內部表達或產生的cocal蛋白(T細胞本身不表達cocal)。
3.3 In vitro PBMC transduction:
病毒顆粒直接加入到PBMCs中,按照每毫升對應2E6個PNMCs細胞。分別在第3天和第7天用流式檢測激活和轉導情況。
3.4 In vitro PBMC transduction:
取5E4個CAR-T細胞,使用CellTrace Violet熒光染料(這種染料可穿透細胞膜,與胞內蛋白質共價結合,用于追蹤細胞分裂。而且細胞每分裂一次,熒光強度減半)進行標記。將標記后的CAR-T細胞與5E4個Nalm6腫瘤細胞共培養。培養體系使用X-VIVO無血清培養基(不含IL-2,以排除外源細胞因子對增殖的干擾)。5天后通過流式檢測存活的CAR+細胞(通過死活染料排除死亡細胞,再通過CAR特異性抗體確認轉導成功),以及通過CellTrace Violet熒光強度的稀釋程度,熒光強度越低,說明細胞分裂次數越多。這樣結果用于量化CAR-T細胞在腫瘤抗原刺激下的增殖能力。
3.5 PBMC-humanized mouse model:
雌性Nod.Cg-PrkdcscidIL2rgtm1Wjl/SzJ小鼠(這個小鼠重度免疫缺陷導致T/B細胞缺失;IL2rg基因敲除缺乏NK細胞;MHC I/II雙敲除)。Day -4,通過 尾靜脈注射 2.5E5個 Nalm6細胞。Day -1,用 IVIS測量小鼠腫瘤負荷。根據腫瘤大小隨機分組,確保組間基線一致。通過腹腔注射2E7個PBMCs。Day 0,腹腔注射攜帶CAR基因的 VivoVec病毒顆粒(劑量根據分組調整),體積200 μL。監測指標腫瘤負荷和血液中的CAR T細胞生成及免疫細胞變化。這里作者用腹腔注射PBMC的原因是什么?腹腔內含大網膜、腸系膜淋巴結等次級淋巴器官,是免疫細胞歸巢和激活的理想場所。注入腹腔的PBMCs可通過 腹膜淋巴管進入循環系統(需2-5天)。實驗設計中,Day -1注射PBMCs后,Day 0給予VivoVec,預留了T細胞遷移至淋巴組織的時間。但是如果靜脈注射,PBMCs可能滯留肺部或脾臟,腹腔注射則提供更穩定的局部微環境。
3.6 NHP model:
該實驗將編碼抗CD20 CAR的VivoVec載體顆粒(VVPs)直接注射到豬尾獼猴的淋巴結內(最多4個,每處≤1mL)。每日監測,記錄動物的體溫、活動狀態、食欲、糞便情況和整體健康狀況。實驗嚴格遵守動物倫理規范,每日監測動物生理狀態,并在特定時間點采血進行流式分析(檢測CAR T細胞生成、免疫細胞表型等)、DNA檢測(用于后續的生物分布檢測,如ddPCR檢測載體基因組)及臨床生化檢驗(監測血常規、生化指標等,評估潛在毒性或副作用,如CRS相關指標CRP、IL-6、鐵蛋白、肝酶ALT/AST等),以評估體內CAR T細胞的生成、功能、B細胞清除效果以及安全性。對出現CRS/ICANS跡象的動物,按方案使用了托珠單抗、阿那白滯素、地西泮進行治療,其中一只動物還使用了地塞米松。
3.7 MDF sequence:







