熒光偏振技術研究青霉素與PBP5相互作用,解析抗生素耐藥分子機制
隨著抗生素耐藥問題日益嚴峻,深入研究其分子基礎顯得尤為重要。本研究聚焦于青霉素與青霉素結合蛋白(PBP5)的結合機制,采用熒光偏振技術,探索不同PBP5變異體的結合行為,揭示抗性差異的關鍵所在。
青霉素與β-內酰胺類抗生素的作用機制
芐青霉素最早發現于 20 世紀 20 年代,此后又有數千種新的青霉素衍生物被發現。青霉素屬于β-內酰胺類抗生素²,該類抗生素是目前臨床上最常用的一類。新的β-內酰胺類藥物不斷被開發出來,以擴展其對更多細菌種類的作用范圍,或用于對抗耐藥機制¹。
β-內酰胺類抗生素通過與細菌細胞壁中的青霉素結合蛋白(PBPs)結合并作用于其功能,從而發揮殺菌作用²。PBPs是一類在細菌細胞壁肽聚糖交聯最后步驟中發揮關鍵作用的酶¹。β-內酰胺類藥物通過抑制該交聯過程,破壞細菌細胞壁的構建。
細菌細胞壁對于維持細胞結構、調控滲透壓以及保護微生物具有重要作用。一旦這一過程被干擾,細菌將無法維持其結構完整性³。
PBP酶變異與抗藥性的關系
每種細菌都有自己特定的 PBP 酶,每種菌株可能含有3至8種不同的PBP¹。對β-內酰胺類抗生素的耐藥性正日益嚴重,其主要機制是由細菌產生的β-內酰胺酶介導。β-內酰胺酶可水解β-內酰胺環,使抗生素失活¹。因此,研究不同變異類型的PBPs,以了解其分子機制及其與β-內酰胺的結合行為至關重要。
腸球菌 (Enterococcus faecium )是一種可引發嚴重感染的細菌,且表現出高度的β-內酰胺耐藥性。已有從臨床分離出的、表現耐藥性的PBP5變異體被鑒定⁴。有趣的是,這些突變并未改變PBP5的蛋白質結構²。本研究中,我們使用熒光偏振技術(fluorescence polarization, FP),測定青霉素與這些臨床來源耐藥性PBP5變異體的結合親和力。
BOCILLIN FL 是一種熒光標記的青霉素衍生物(BODIPY標記的青霉素V)。如圖1所示,當PBP5與BOCILLIN FL結合時,FP信號隨時間增加,表明發生了結合事件。
 圖 1:BOCILLIN FL 熒光偏振動力學實驗
圖 1:BOCILLIN FL 熒光偏振動力學實驗野生型及變異型PBP5蛋白按照Hunashal等人²先前的方法,從分離的腸球菌(Enterococcus faecium)變異株中表達并純化。
BOCILLIN FL購自Thermo Fisher Scientific,并從1 mM的DMSO儲備液中新鮮配制,實驗中最終使用濃度為30 nM。實驗用的緩沖液為:100 mM磷酸鈉(pH 7.0)、0.01% Triton X-100,并加入黑色384孔板(聚苯乙//烯,Corning)中,每孔加5 µL。
實驗通過向每孔加入15 µL PBP5蛋白(最終濃度3.6 µM)開始,并用熱封膜(ThermalSeal,EXCEL Scientific)封板。陰性對照孔中不加PBP5,僅含緩沖液。
隨后,在 37°C 溫度下使用 CLARIOstarPlus測量熒光偏振,濾光片設置為熒光素。閃爍 100 次,目標 mP 值為 10mP。總共收集了 100 個測量點,每輪循環時間為 40 秒。
與 BOCILLIN 的相互作用
圖 2 顯示了野生型 PBP5(WT,即 PBP5 T485)隨著時間的推移與 BOCILLIN 的結合情況,通過 FP 值的增加(綠色曲線)可觀察到。正如預期,催化不活躍的 PBP5 S422A 變體沒有與 BOCILLIN 結合(藍色曲線),因為 β-內酰胺類藥物嚴格要求與活性位點絲氨酸結合。
其中一個臨床上最具耐藥性的PBP5變體T485A,其與BOCILLIN的結合速率顯著降低(紅色曲線),接近S422A的無結合狀態。相比之下,耐藥性最弱的PBP5變體T485M,則表現出較高的結合速率(橙色曲線)。
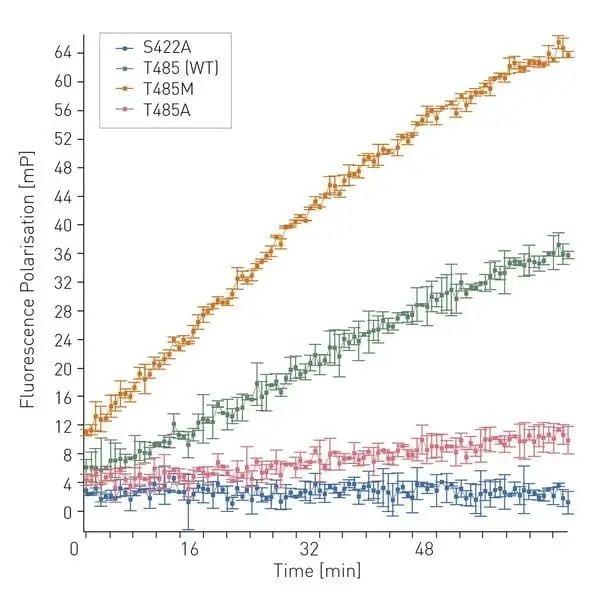 圖 2:WT、S422A、T485A 和 T485M PBP5 變體隨時間變化的 BOCILLIN 熒光偏振曲線。
圖 2:WT、S422A、T485A 和 T485M PBP5 變體隨時間變化的 BOCILLIN 熒光偏振曲線。結論
熒光偏振實驗結果表明,β-內酰胺類抗生素通過PBP5活性位點中的S422殘基特異性結合。不同的臨床來源PBP5變體展示出顯著不同的熒光偏振信號變化,與其臨床耐藥性水平密切相關。CLARIOstar Plus設備在監測這些變體結合行為差異方面表現出高度靈敏性,為結合動力學研究提供了強有力支持。該設備的溫控功能確保了動力學實驗中溫度的穩定性和一致性。
References
- Bush, K., Bradford, P. β-Lactams and β-Lactamase Inhibitors: An Overview. Cold Spring Harb Perspect Med.(2016) Volume 6 (8) www.ncbi.nlm.nih.gov/books/NBK9957/#
- Hunashal, Y. et al. Molecular basis of β-lactam antibiotic resistance of ESKAPE bacterium E. faecium Penicillin Binding Protein. Nat. Commun. (2023) 14: 4268
- Yip, D., Gerriets, V., Penicillin. StatPearls Publishing. (2023)
- Rice L.B., Bellais S., Carias L. L., Hutton-Thomas R., Bonomo R. A., Caspers P., Page M. G. P., Gutmann L. Impact of specific pbp5 mutations on expression of
轉載自:BMG LABTECH
歡迎關注進科馳安官方微信(微信公眾號:Bio-Gene)
回復:BMG,查看更多相關視頻
長按/掃描以下二維碼可識別關注公眾號

廣州進科馳安科技有限公司
Bio-Gene Technology Ltd.
熱線:176 2009 3784
www.bio-gene.com.cn
marketing@bio-gene.com.cn
香港 北京 上海 廣州






