CD4+T經1α介導的內皮氧化酶1增加誘導HIV相關的內皮功能障礙和高血壓
CD4+ T Cells Expressing Viral Proteins Induce HIV-Associated Endothelial Dysfunction and Hypertension Through Interleukin 1α-Mediated Increases in Endothelial NADPH Oxidase 1
Keywords: CD4-positive T-lymphocytes; HIV; endothelium; hypertension; interleukin-1alpha; oxidative stress; viral proteins.
心血管疾病(CVD)現已成為HIV感染者(PLWH)的主要死因,而高血壓是CVD的主要風險因素,在聯合抗逆轉錄病毒療法(cART)治療下的PLWH中非常普遍。盡管HIV相關高血壓的流行病學問題已經明確,但其病因仍然大多未知,且缺乏關于其潛在機制的實驗研究。
較高的非傳染性合并癥數量已被證明不足以解釋PLWH中較高的高血壓患病率,這支持病毒學或治療相關因素對病理生理學的貢獻。有趣的是,接受cART治療的PLWH 患者的高血壓患病率始終高于cART初治患者,而cART初治患者則低于未感染者。這些觀察表明,CD4+ T淋巴細胞(T細胞),在接受cART治療的PLWH中含量高,在cART初治患者中含量低,可能與高血壓有關。
點擊了解:仿生多細胞動態共培養系統
CD4+ T細胞是cART治療的PLWH中最大且最為明確的HIV儲存庫。HIV仍保持轉錄活性在CD4+ T細胞中,病毒蛋白表達依然存在。HIV衍生蛋白在cART治療的PLWH體內循環并創造促進CVD的炎癥環境。因此,可假設雄性和雌性小鼠中表達HIV衍生蛋白的CD4+ T細胞通過釋放促炎細胞因子誘導高血壓。為驗證這一假設,美國南阿拉巴馬大學莫比爾分校血管生物學中心及奧古斯塔大學喬治亞醫學院生物化學和分子生物學系團隊在一項研究中結合了骨髓移植(BMT)的Tg26 HIV小鼠模型與及T細胞過繼性轉移,并分析了PLWH中主動脈標本。研究成果發表于Circulation 期刊題為“CD4+ T Cells Expressing Viral Proteins Induce HIV-Associated Endothelial Dysfunction and Hypertension Through Interleukin 1α-Mediated Increases in Endothelial NADPH Oxidase 1 ”。

首先,為研究病毒蛋白在HIV相關高血壓發病機制中的作用,使用Tg26轉基因小鼠,提供了一種非傳染性的HIV模型,類似于接受抗逆轉錄病毒治療的PLWH 。實驗報告顯示,在正常雄性和雌性Tg26小鼠中病毒蛋白的表達在保持晝夜節律的同時,血壓(BP)有所增加(圖1 A、B、D、E),但不影響心率。基于血管系統在控制血壓中的關鍵作用以及HIV對血管功能的已知有害影響,評估了二級腸系膜動脈的血管反應性。Tg26小鼠中病毒蛋白的表達導致雄性和雌性(圖1 C、F)小鼠對乙酰膽堿(ACh)的血管舒張反應明顯受損,而對硝普鈉(SNP)的血管舒張反應則未改變,這支持內皮細胞水平的功能障礙。這些數據表明。Tg26小鼠中病毒蛋白的表達會提高血壓并損害內皮依賴性血管舒張反應。
為了檢驗造血細胞衍生的病毒蛋白是否可能導致內皮功能障礙和高血壓,采集并移植了WT小鼠和Tg26小鼠的骨髓(圖1 G)。通過尾袖測量血壓顯示,相較于WT-WT,Tg26-WT小鼠的BMT顯著提高了雄性和雌性小鼠的收縮壓(SBP)(圖1 H、I)。從WT到Tg26小鼠的BMT消除了上述雄性和雌性Tg26小鼠報告的高血壓表型,并將血壓水平降低至WT-WT組(圖1 H、I)。值得注意的是,血管反應性研究的結果與BP數據相符。事實上,從Tg26到WT小鼠的BMT重現了正常Tg26小鼠中的腸系膜動脈內皮功能障礙,而從WT小鼠到Tg26小鼠的BMT則恢復了腸系膜動脈對ACh的舒張反應(圖1 J、K)。在腸系膜動脈中觀察到,從Tg26到WT小鼠的BMT損傷了主動脈內皮功能,而從WT到Tg26小鼠的BMT則恢復了導管動脈對ACh的反應而不影響SNP介導的舒張反應。這些結果表明,源自造血細胞的病毒蛋白是雄性和雌性Tg26小鼠內皮功能障礙和高血壓的根源。

圖1 雄性和雌性小鼠的造血細胞中HIV蛋白的表達會增加血壓,并損害阻力血管的內皮功能。
研究人員試圖確定導致內皮功能障礙和高血壓的免疫細胞亞型,因此開發了一種新系統(圖2 A),將WT胸主動脈與脾臟來源的CD3+ T細胞或BM來源巨噬細胞共培養。與暴露于WT CD3+ T細胞相比,WT主動脈暴露于Tg26 CD3+ T細胞會損害血管舒張反應(圖2 B),但暴露于來自WT或Tg26小鼠的BM來源巨噬細胞并未改變血管舒張反應(圖2 C)。
基于T細胞參與高血壓需要共刺激的證據,通過用CTLA4-Ig(如abatacept)阻斷共刺激信號,進一步研究了T細胞對HIV相關高血壓發病機制的貢獻。阿巴西普(Abatacept )降低了平均動脈壓(圖2 D、E)和舒張壓,同時恢復了阻力性(圖2 F)和傳導性血管的內皮功能,但未影響平滑肌細胞依賴性血管舒張(圖2 G)。這些數據綜合提供了體外和體內證據,表明源自T細胞的病毒蛋白對觀察到的BP升高和內皮功能障礙有影響。
使用CD4+ 輔助T細胞和CD8+ 細胞毒性T細胞重復共培養實驗(圖2 A)以縮小參與的T細胞亞型,發現暴露于CD4+,而非CD8+,會損害內皮依賴性舒張反應。進一步測試CD4+ T細胞的作用,發現CD4+ 耗竭使Tg26小鼠的SBP水平降至WT小鼠水平,且未影響WT小鼠的血壓,同時也恢復了對ACh的血管舒張反應,但未改變血管平滑肌細胞依賴性血管舒張。在缺失CD4+ 和 CD8+ T細胞的TCRα敲除小鼠中進行CD4+ T細胞的過繼性轉移,發現相較于從WT小鼠分離的CD4+ T細胞,Tg26 CD4+ T細胞的過繼性轉移顯著升高了SBP。這些結果共同支持,CD4+ T細胞表達的病毒蛋白在高血壓和內皮功能障礙中的作用。
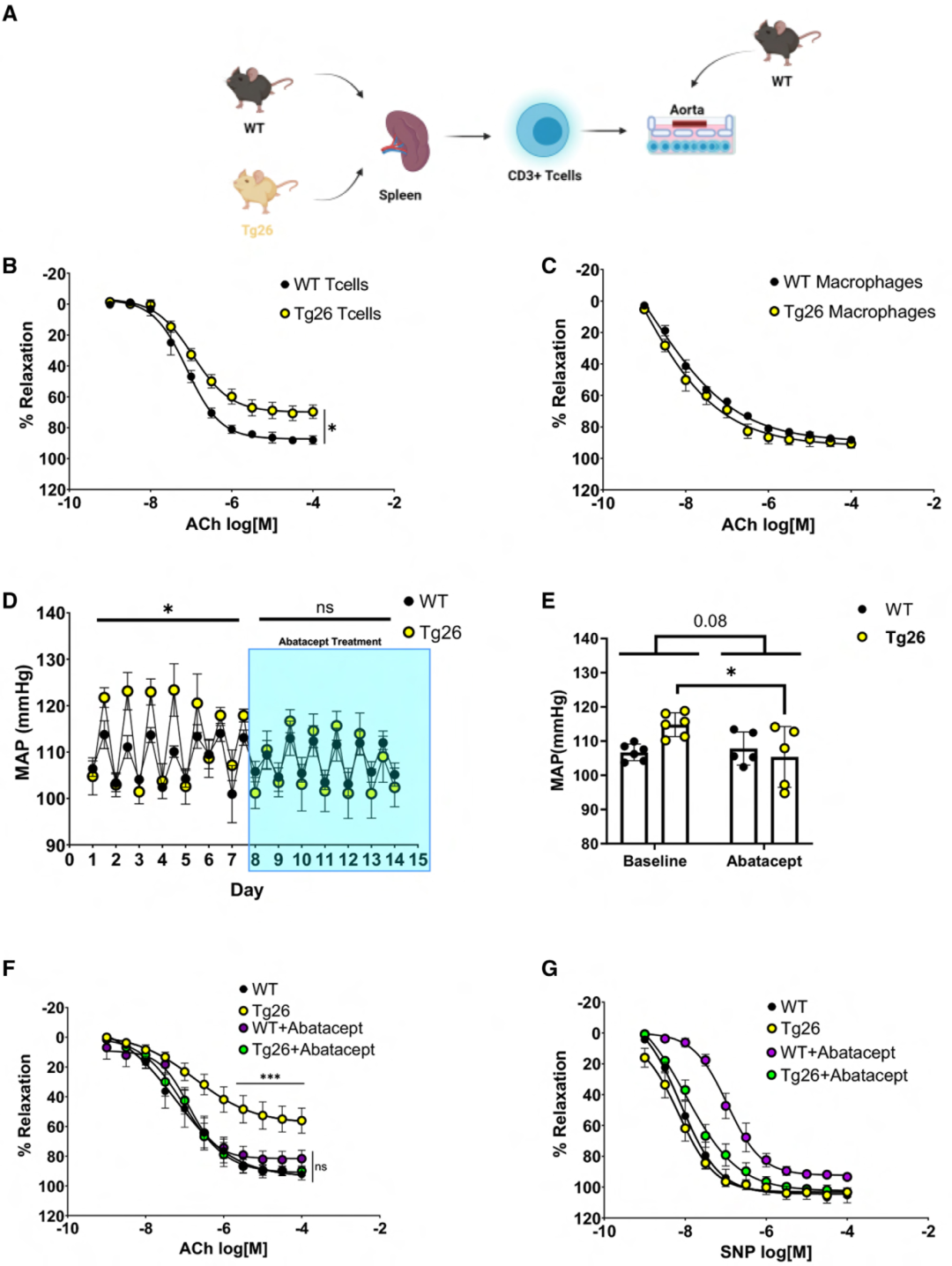
圖2 CD3+ T細胞中HIV蛋白的表達可誘發內皮功能障礙和高血壓。
基于促炎細胞因子在高血壓發展中的作用,接下來對完整和BMT小鼠的血漿進行了Cytokine Panel分析,測量顯示,Tg26小鼠的病毒蛋白表達顯著提高了循環中的IL-1α水平(圖3 A、B),而其他促炎細胞因子則無顯著變化。從Tg26到WT小鼠的BMT增加,用WTs替代Tg26 BM降低IL-1α水平(圖3 C、D)。此外,較CD8+ T細胞,病毒蛋白表達在CD4+ T細胞中誘導IL-1α更顯著地增加(圖3 E、F)。阿巴西普抑制T細胞共刺激(圖3 G)和CD4+ T細胞耗竭(圖3 G)降低了Tg26小鼠血漿IL-1α水平,表明CD4+ T細胞是循環IL-1α升高的來源。
正常WT和Tg26小鼠接受IL-1α中和抗體處理,發現IL-1α中和使Tg26 小鼠BP水平降低(圖3 H、I),心率無變化,且恢復阻力動脈內皮依賴性舒張(圖3 J),但未影響平滑肌細胞依賴性血管舒張。同時,在IL-1α中和抗體存在下重復了T細胞-主動脈共培養實驗,發現 IL-1α中和保護了主動脈環免受Tg26 CD4+ T細胞誘導的內皮功能障礙(圖3 K),且未影響SNP介導的舒張。將WT小鼠接受每日20 mg/kg的外源性IL-1α治療,發現IL-1α注射升高了SBP,并損害了內皮依賴性血管舒張(圖3 L、M),但平滑肌細胞依賴性舒張無異。這些數據支持,CD4+ T細胞來源的IL-1α在HIV病毒蛋白相關的內皮功能障礙和高血壓中的作用。
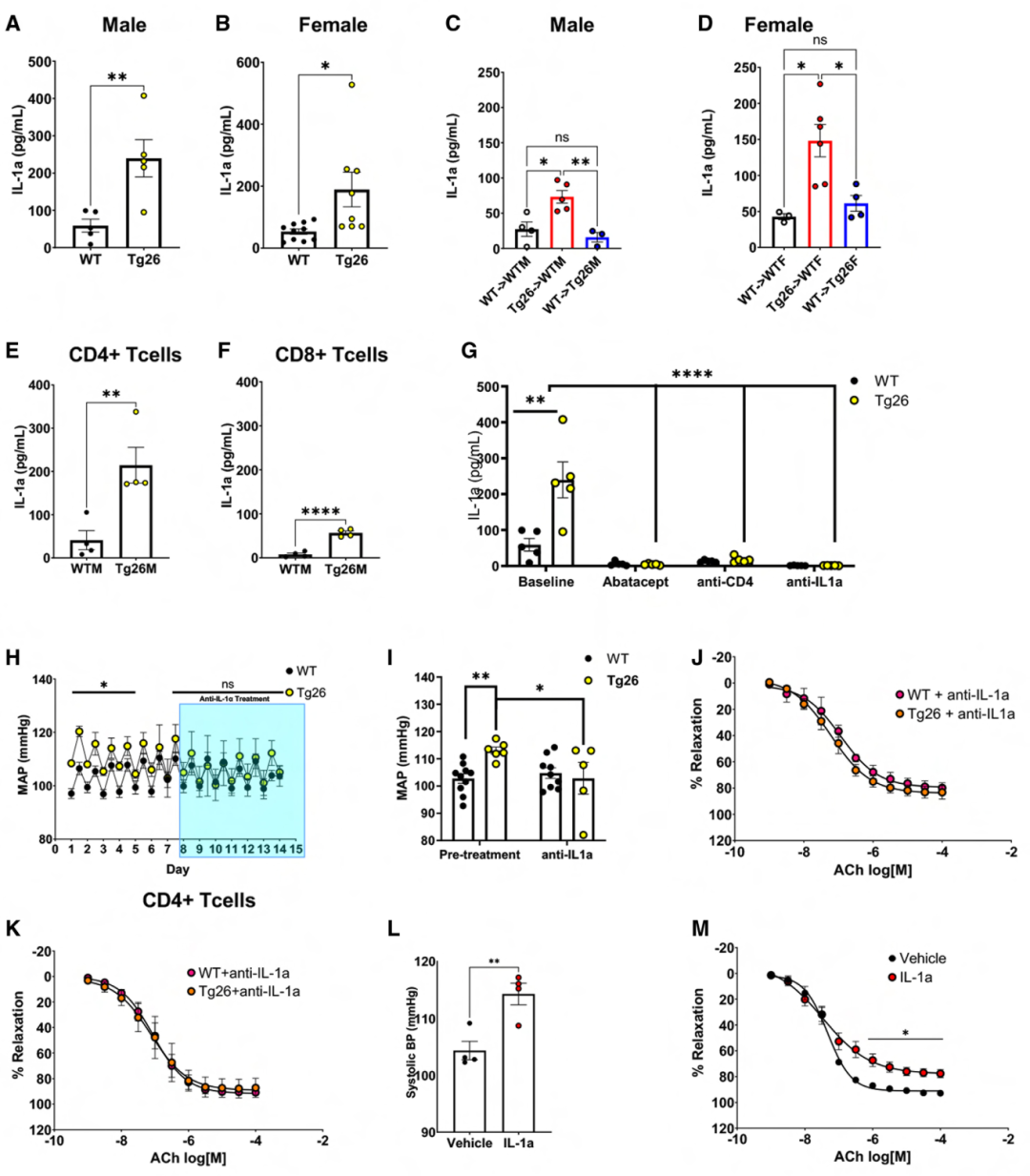
圖3 CD4+ T細胞中病毒蛋白的表達會誘導IL-1α的表達,從而損害內皮功能并誘發高血壓。
過量的活性氧,尤其是高NAD(P)H氧化酶衍生的活性氧,與HIV和T細胞介導的高血壓和血管功能障礙有關。因此,實驗定量了主動脈中NOX亞型轉錄物表達,發現 Tg26小鼠的病毒蛋白表達增加了NOX1,但非NOX2和NOX4的顯著增加,CD4+ 耗竭降低了完整小鼠主動脈中的NOX1水平,NOX2和NOX4水平未顯著變化。與上述發現一致,從Tg26到WT小鼠的BMT僅增加了主動脈中的NOX1,且WT大主動脈暴露于Tg26 CD3+ T細胞僅增加NOX1。為驗證這些發現的可轉化性,測量了接受心臟搭橋手術的PLWH丟棄的主動脈活檢標本中NOX的表達,發現PLWH患者的NOX1水平高于血清陰性患者。使用選擇性NOX1抑制劑GKT771,發現其消除了WT與Tg26雄性小鼠之間的血管舒張差異,也消除了WT-WT及Tg26-WT BMT小鼠之間的差異。NOX1的缺失可防止病毒蛋白誘導的高血壓和內皮功能障礙,同時未改變血管平滑肌細胞依賴性舒張。這些數據表明,CD4+ 來源的病毒蛋白通過NOX1依賴機制損害內皮功能并升高BP。
研究人員假設IL-1α會增加內皮NOX1表達。為驗證這一假設,將hMVECs暴露于IL-1α,發現 IL-1α增加了內皮NOX1表達(圖4 A),但NOX2、NOX4或NOX5(圖4 B-D)表達無顯著變化。此外,測量了8-羥基-2'-脫氧鳥苷水平(8-OHdG,活性氧誘導氧化損傷的指標),發現IL-1α顯著提高了hMVECs中的 8-OHdG水平(圖4 E),表明 IL-1α是NOX1表達和活性氧產生增加的來源。使用NOX1抑制劑GKT771,發現抑制 NOX1消除了IL-1α處理小鼠與載體處理小鼠腸系膜血管舒張差異(圖4 F)。為探究IL-1α促進內皮NOX1表達的潛在機制,測試了NF-κB和caspase 1的作用。發現抑制 NF-κB和caspase 1均能防止IL-1α誘導的內皮依賴性舒張受損(圖4 G)以及IL-1α介導的內皮NOX1增加(圖4 H、I)。這表明,IL-1α會增加hMVECS中的NOX1和氧化應激。
最后,為確定CD4+ T細胞是否能介導NOX1增加,將接受心臟搭橋手術的血清陰性患者丟棄的人類主動脈標本暴露于WT或Tg26 CD4+ T細胞條件培養基(圖4 J),發現暴露于CD4+ T細胞培養基會增加NOX1表達,并誘導NOX2上升的趨勢,但未達到統計顯著性(圖4 K-N)。這些結果表明,源自CD4+ T細胞的病毒蛋白會增加人體血管NOX1表達。
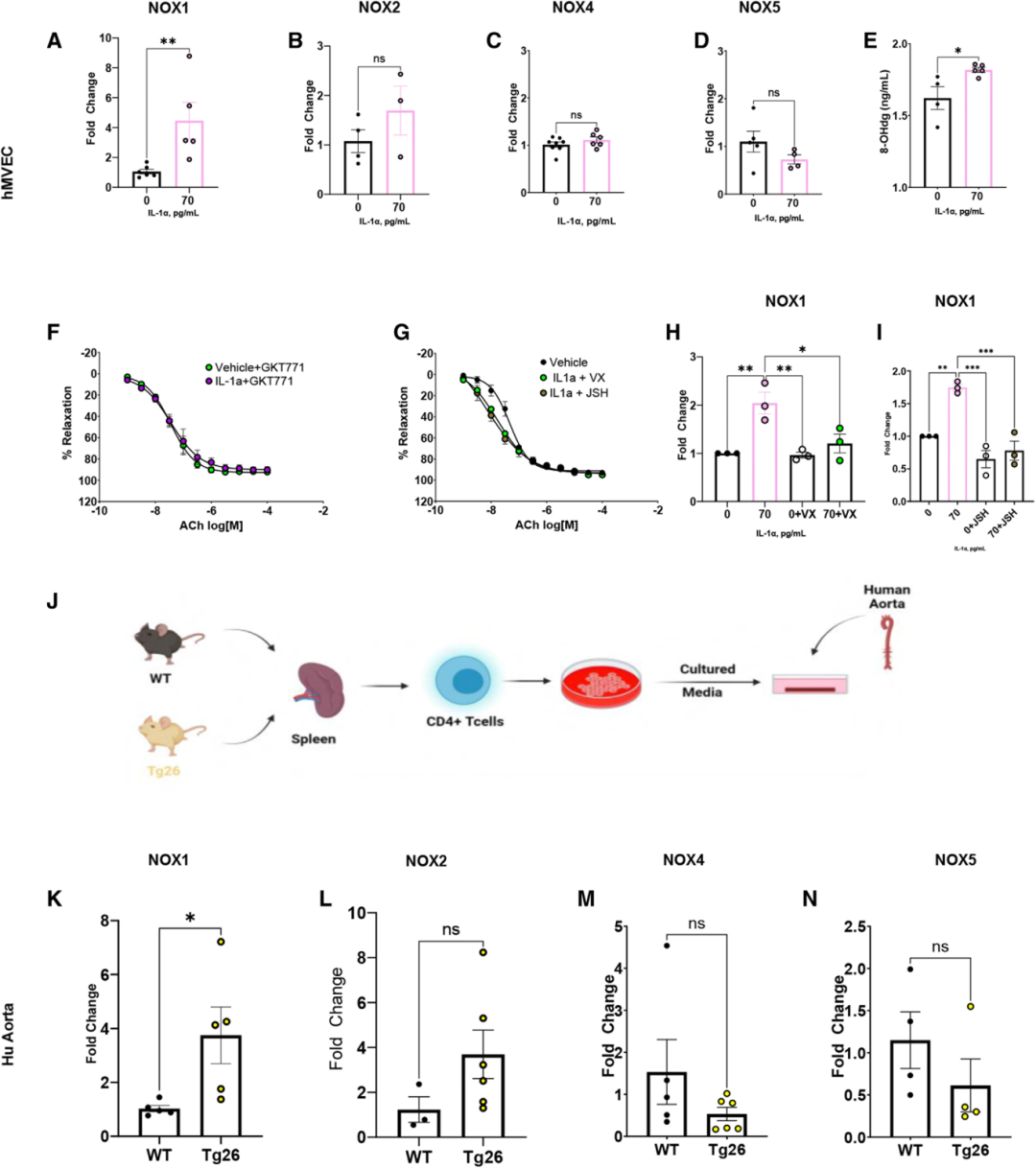
圖4 IL-1α和CD4+ T細胞增加內皮NOX1和活性氧的水平。
總之,該研究shouci提供了實驗證據,表明CD4+ T細胞中病毒蛋白的表達會導致促炎細胞因子IL-1α的分泌,從而提高內皮細胞的NOX1水平,進而損害內皮舒張功能并提高血壓。這是shouge機制性研究介紹了NOX1抑制劑、IL-1α抗體和IL-1受體阻斷,作為緩解PLWH 患者高血壓患病率上升的潛在治療途徑。
參考文獻:Kress TC, Barris CT, Kovacs L, Khakina BN, Jordan CR, Bruder-Nascimento T, Stepp DW, MacArthur R, Patel VS, Chen J, Pacholczyk R, Kennard S, Belin de Chantemèle EJ. CD4+ T Cells Expressing Viral Proteins Induce HIV-Associated Endothelial Dysfunction and Hypertension Through Interleukin 1α-Mediated Increases in Endothelial NADPH Oxidase 1. Circulation. 2025 Apr 22;151(16):1187-1203. doi: 10.1161/CIRCULATIONAHA.124.070538. Epub 2025 Feb 5. PMID: 39907014; PMCID: PMC12011537.
原文鏈接:https://pubmed.ncbi.nlm.nih.gov/39907014/
圖片來源:所有圖片均來源于參考文獻
小編旨在分享、學習、交流生物科學等領域的研究進展。如有侵權或引文不當請聯系小編修正。如有任何的想法以及建議,歡迎聯系小編。感謝各位的瀏覽以及關注!進入官網www.naturethink.com或關注“Naturethink”公眾號,了解更多相關內容。
點擊了解:仿生多細胞動態共培養系統






