阿爾茲海默癥(AD)模型的三種構建方法解析
一、阿茲海默癥(AD)核心基礎
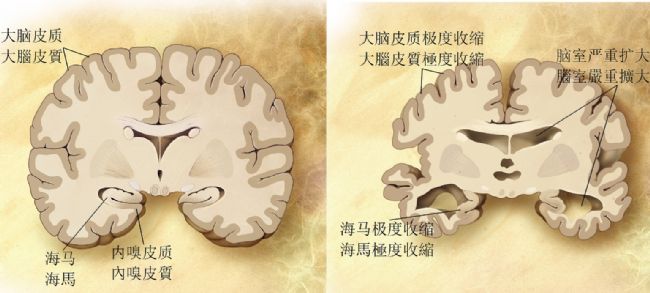
AD 是進行性神經退行性疾病,核心病理特征為大腦皮層與海馬區的 β- 淀粉樣蛋白(Aβ)沉積形成老年斑、tau 蛋白過度磷酸化形成神經纖維纏結,最終導致神經元凋亡與認知功能衰退。臨床分為兩類:
- 散發性 AD:占比 90% 以上,發病與年齡(≥65 歲)、高血壓、糖尿病、高脂血癥等危險因素相關;
由于臨床 AD 患者腦組織樣本難以獲取,且無法動態觀察疾病進展,動物模型成為研究 AD 發病機制、篩選治療藥物、驗證干預靶點的核心工具。
二、三類常用 AD 動物模型構建方法(小鼠為主)
(一)轉基因小鼠模型(模擬家族性 AD)
適用場景:長期機制研究(如 Aβ/tau 代謝機制)、慢性藥物干預實驗(觀察 6 個月以上療效)。
核心原理:通過基因工程將人類 AD 致病突變基因(APPsw、PS1ΔE9、tauP301L)轉入小鼠基因組,使小鼠自發表達突變蛋白,逐步出現 Aβ 沉積、tau 磷酸化及認知障礙,病理進程與人類家族性 AD 高度相似。
1.操作要點
·品系選擇:基礎款選 APP/PS1 雙轉基因小鼠(6-8 月齡出現 Aβ 沉積,12 月齡認知障礙明顯,成本適中);進階款選 3×Tg-AD 小鼠(8-10 月齡同時出現 Aβ 沉積與 tau 纏結,病理全面但成本高)。均需選用 SPF 級小鼠,性別統一(雌性認知更穩定),起始年齡 6-12 周齡。
·飼養管理:溫度 22-24℃、濕度 50-60%,12h 光照 / 黑暗循環;飼料無過敏原,飲水無菌;單籠或 2-3 只 / 籠飼養,避免應激(應激加重 Aβ 沉積)。
2.模型驗證(建模后 6-12 月齡)
·病理檢測:免疫組化(IHC)用 6E10 抗體檢測 Aβ 沉積、AT8 抗體檢測 tau 磷酸化;Western blot 檢測 Aβ1-42、p-tau(Ser396/Ser404)表達,計算 p-tau/tau 比值。
·行為學測試:Morris 水迷宮(成功模型潛伏期延長、目標象限停留時間縮短)、新物體識別實驗(成功模型探索新物體比值 < 0.5)、Y 迷宮(成功模型交替率 < 50%)。
3.優缺點
·優點:病理穩定,與人類 AD 相似度高,可長期觀察;
·缺點:建模周期長(≥6 個月),成本高(小鼠單價 1000-2000 元 / 只),無法模擬散發性 AD。
(二)Aβ 注射誘導模型(模擬散發性 AD)
適用場景:短期藥物干預實驗(1-4 周)、急性病理研究(如 Aβ 誘導的神經炎癥機制)。
核心原理:將人工合成的 Aβ1-42 寡聚體(毒性最強,易沉積)通過立體定位注射至小鼠海馬區,直接誘導局部神經元損傷、小膠質細胞活化,7-14 天出現認知障礙,建模周期短。
1.操作要點
·Aβ 制備:用無水 DMSO 溶解 Aβ1-42 粉末(純度≥95%),配 10μM 儲存液分裝凍存(-80℃,≤6 個月);使用前 37℃孵育 24h 形成毒性寡聚體(避免反復凍融)。
·立體定位注射:1% 戊巴比妥鈉(50mg/kg)麻醉小鼠,固定于定位儀;參照腦圖譜定位海馬坐標(前后囟 - 2.0mm,左右 ±0.8mm,深度 2.0mm);顱骨鉆孔后,每側海馬緩慢注射 2μL Aβ 寡聚體(0.5μL/min),留針 5min 拔針。
·術后護理:腹腔注射青霉素(5 萬 U / 只)2 天預防感染,單籠飼養,觀察蘇醒情況,術后 3 天避免應激。
2.模型驗證(建模后 1-4 周)
·病理檢測:注射后 21 天取腦,IHC 檢測海馬區 Aβ 沉積(6E10 染色)、小膠質細胞活化(Iba-1 染色,成功模型陽性細胞增 2-3 倍)。
·行為學測試:建模后 14 天做 Morris 水迷宮,與假手術組對比,建模組潛伏期延長≥50% 為成功。
3.優缺點
·優點:建模周期短(2 周),成本低(ICR 小鼠 20-30 元 / 只),可模擬散發性 AD 急性病理;
·缺點:病理局限于海馬區,無法模擬 AD 進行性發展,不適合長期機制研究。
(三)D - 半乳糖 + AlCl₃聯合誘導模型(模擬 AD 早期)
適用場景:AD 預防藥物研究(如抗氧化劑篩選)、環境因素(如鋁暴露)相關機制研究。
核心原理:D - 半乳糖導致氧化應激(ROS↑、SOD↓),Al³⁺抑制 Aβ 降解酶并促進 Aβ 沉積,二者聯合模擬 AD 早期認知衰退與氧化損傷,病理溫和。
1.操作要點
·試劑配制:D - 半乳糖用生理鹽水配 5% 濃度(現配現用);AlCl₃配 0.2mol/L 濃度,調 pH 至 7.2(避免損傷腹腔),4℃保存≤1 周。
·給藥方式:腹腔注射 D - 半乳糖(120mg/kg)+ AlCl₃(40mg/kg),每天 1 次,連續 42 天;對照組注射等體積生理鹽水。
2.模型驗證(建模 6 周后)
·氧化應激指標:檢測血清 / 腦組織 SOD 活性(成功模型↓30%-40%)、MDA 含量(成功模型↑50%-60%)。
·行為學測試:新物體識別實驗(成功模型探索新物體比值 < 0.45)、避暗實驗(成功模型錯誤次數↑2-3 倍)。
·病理檢測:HE 染色觀察海馬神經元,成功模型神經元數量↓20%-30%,排列紊亂。
3.優缺點
·優點:操作簡單(無需定位儀),成本極低,適合大規模藥物篩選;
·缺點:病理輕微(無明顯 Aβ/tau 異常),與人類 AD 相似度低,不適合機制研究。
三、模型構建關鍵注意事項(避坑指南)
1.模型選擇原則:長期機制研究(≥6 個月)選轉基因模型,短期藥物干預(1-4 周)選 Aβ 注射模型,抗氧化研究選 D - 半乳糖 + AlCl₃模型。
2.樣本量與操作規范:每組至少 8-10 只小鼠(滿足方差分析);轉基因小鼠每 3 代換種鼠(防基因漂移),定期 PCR 驗證基因型;Aβ 注射嚴格控孵育時間與坐標誤差;腹腔注射時針頭斜面朝上(30°-45°),避免刺傷內臟。
3.對照設置:需含空白對照(正常小鼠)、陰性對照(對應模型的生理鹽水 / 野生型對照);可選陽性對照(多奈哌齊 1mg/kg/d 處理的模型小鼠),驗證實驗體系有效性。
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com






