拉伸應力下調胚胎干細胞來源的擬胚體中成骨標志物的表達和礦化
Tension Force Stress Downregulates the Expression of Osteogenic Markers and Mineralization in Embryonic Stem-Cell-Derived Embryoid Bodies
Keywords: embryoid body; extracellular signal-regulated kinase; mineralization; osteogenic marker; tensile stress.
擬胚體(EBs)是胚胎干細胞(ESCs)的3D聚集體,能夠分化成各種譜系細胞。大量研究結果表明,EBs與細胞外基質(ECM)的協同應用在引導組織再生(GTR)方面具有很大的優勢。ECM 成分可以提供調節 ESCs 和/或 EBs 擴增和分化為特定譜系的線索。因此,具有天然骨ECM成分的支架可以直接增強ESCs的成骨分化和骨形成。
支架本身可以激活各種機械信號,并影響與其纖維拓撲結構相關的細胞行為。牽張應變應力是暴露于支架上或支架內生長的細胞的主要機械刺激,并調節細胞增殖和/或分化為功能化細胞的命運。然而,應變應力對EBs成骨分化和礦化的影響及其相關機制知之甚少。
點擊了解:牽張應變細胞培養儀
在各種機械傳感分子中,絲裂原活化蛋白激酶(MAPKs),如細胞外信號調節激酶(ERK)、c-Jun N末端激酶(JNK)和p38 MAPK在機械信號轉導中起著至關重要的作用。激活的 MAPKs 將外源性機械信號轉移到細胞核中,并根據機械刺激的條件介導轉錄激活。Wnt/β-catenin 信號也被機械信號激活,并調節細胞向各種譜系細胞的分化。
基于此,韓國國立全北大學牙科學院口腔生物科學研究所團隊在一項研究中探索了拉伸應力如何影響 EBs 的成骨潛力,并研究 β-連環蛋白或 MAPK 中的哪一個在施加應力的 EBs 中充當主要機械信號介質。研究表明,拉伸負荷應力通過下調ERK1/RUNX2調控的信號來抑制EBs的成骨分化和礦化。其成果發表于 CELLS 期刊題為“Tension Force Stress Downregulates the Expression of Osteogenic Markers and Mineralization in Embryonic Stem-Cell-Derived Embryoid Bodies”。

圖1展示了使用懸滴法從ESCs培養EBs以及使用體外牽張設備應用循環拉伸應力的實驗設計。首先,在孵育的幾個時間點測定了EBs中多能性相關標記物的水平。EBs中未分化狀態標記物 Oct4和Sox2在第1天EBs中強烈表達,且在第3天EBs中發現了這種表達。第7 天 EBs 也顯示出與 第1 天相似的 Sox2 表達水平,但 Oct4 的表達水平顯著降低。同時,還檢測了 EBs 在補充或不補充 DAG(二酰基甘油)的培養物中表達成骨轉錄因子 RUNX2 和 Osterix 的特性,免疫熒光染色顯示,第3天的EBs表達RUNX2和Osterix,DAG處理后表達明顯增加。
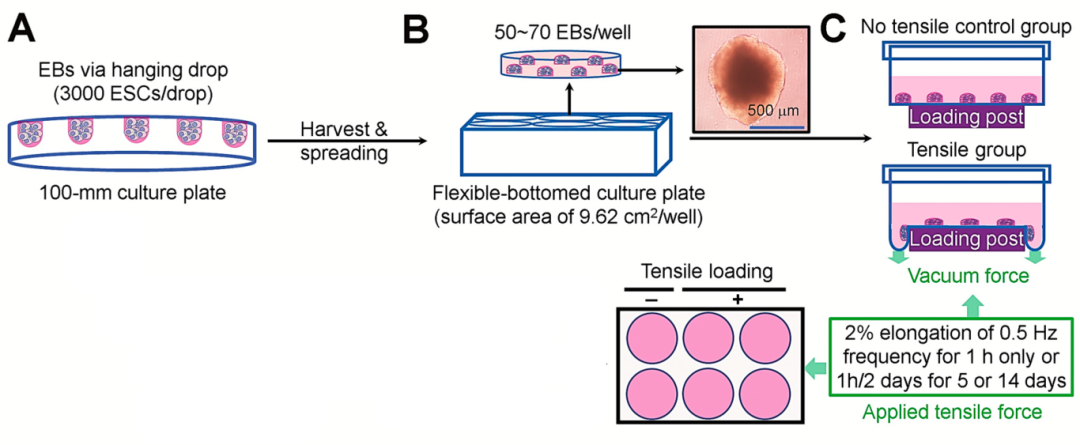
圖1 ESC衍生EBs的拉伸應力應用實驗設計。
隨后,通過ARS染色研究了拉伸應力如何影響DAG誘導的EBs礦化。與生長培養基中的EB培養物相比,添加DAG的EBs顯示出更多的ARS陽性菌落,但在應用于2% 幅度拉伸應力的EBs中這種增加有所下降(圖2 A)。ARS特異性光密度(405 nm)的測量支持了DAG誘導的EBs礦化及其因拉伸應力而顯著降低的趨勢(圖2 B)。與僅補充DAG的培養物相比,施加拉伸應力的培養物中直徑超過300 μm的EBs數量顯著減少(圖2 C)。此外,補充 DAG的EBs表達的RUNX2、Osterix、BSP和OCN水平顯著提高,但ALP和OPN水平不高(圖2 D)。DAG 刺激的這些成骨基因在 EBs中的表達在拉伸應力的協同作用下被顯著減弱。同樣,免疫印跡測定顯示DAG刺激RUNX2的誘導,并通過拉伸應力抑制(圖2 E、F)。這些數據表明,循環拉伸應力減少DAG誘導的EBs礦化,這是由成骨調控分子的下調所控制的。
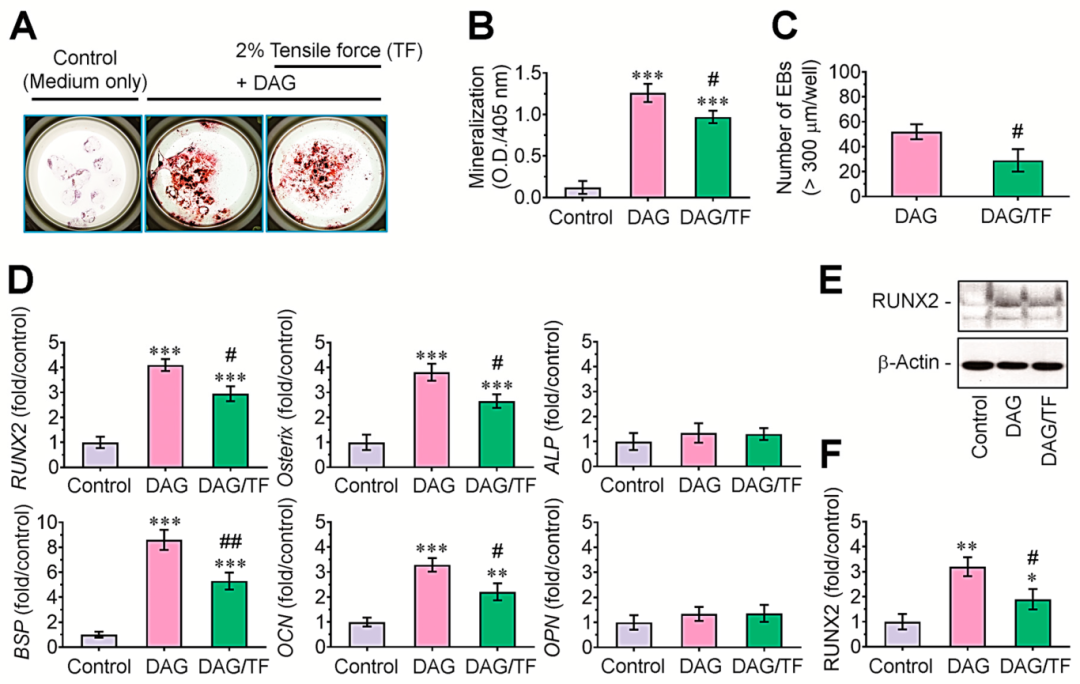
圖2 循環拉伸應力抑制DAG刺激的EBs的成骨細胞分化和成骨標志物表達。
接下來,為了了解為什么拉伸應力會抑制 DAG 刺激的 EBs 礦化,首先檢查了 EBs 中整合素和 β-連環蛋白的蛋白質水平。與生長培養基提供的對照EBs相比,DAG處理的EBs在全蛋白裂解物中顯示出整合素α5和β1以及β-連環蛋白的明顯增加,并且在拉伸加載后的指定時間(0-48小時)沒有因拉伸應力而改變(圖3 A),整合素和β-連環蛋白特異性的條帶強度也顯著提高,且同樣在拉伸應力后沒有減少(圖3 B-D)。此外,僅補充DAG或與拉伸應力聯合應用的EBs組在細胞質和核酸部分均顯示出顯著高于對照組的β-連環蛋白水平(圖3 E-G)。
然后,為了探討β-連環蛋白介導的信號對DAG刺激的EBs成骨分化的作用,用si-對照或si-β-連環蛋白轉染。免疫印跡測定表明,si-β-連環蛋白轉染顯著降低了全蛋白裂解物中的β-連環蛋白水平。在培養14天后,與補充DAG或聯合si-對照轉染的EBs相比,si-β-連環蛋白轉染的EBs中的ARS強度略有降低的趨勢。然而,在si-β-連環蛋白轉染的EBs中,ARS染料的平均吸光度和ARS陽性菌落的數量與僅用DAG處理或與si-對照轉染一起處理時沒有顯著差異。這些數據表明,DAG刺激的EBs礦化及其受拉伸應力的抑制不受β-連環蛋白介導的信號的直接影響。

圖3 拉伸應力不會減弱 DAG 刺激的 EBs 中整合素和 β-連環蛋白的誘導。
為了評估ERK介導的信號對張力施加的EBs的影響,通過免疫印跡測定比較了對照組、DAG組和DAG/拉伸施加EB組之間的p-ERK水平(圖4 A)。與對照組或 DAG 組相比,拉伸應力施加的 EBs 中發現 p-ERK 迅速且持續性增加,然而,在拉伸應力12 小時后,DAG刺激的ERK磷酸化被廣泛抑制。密度分析支持,DAG 處理的 EBs 中張力介導的 p-ERK 降低在 p-ERK1 而不是 p-ERK2 中進一步突出(圖4 B)。這些結果表明,DAG刺激的EBs中ERK1介導的信號與張力介導的成骨抑制作用密切相關。

圖4 拉伸應力以時間依賴性方式抑制了ERK的磷酸化。
進一步地,用每種(10 μM)MAPK 抑制劑研究了 MAPKs 對 DAG 刺激的 EBs 礦化的影響。ARS染色結果表明,DAG誘導的EBs礦化被p-ERK的藥理抑制劑所抑制,非p-JNK或p-p38激酶的抑制劑。在MAPK處理的EB組中,與DAG對照EBs相比,僅在暴露于PD98059的EBs中發現ARS染料特異性吸光度顯著降低。用PD98059預處理也顯著抑制了EBs中DAG刺激的RUNX2,Osterix,BSP和OCN的表達。此外,在與藥理學ERK抑制劑聯合治療中,DAG介導的第5天EBs中RUNX2和Osterix蛋白的誘導顯著降低。這些數據表明,藥理學ERK抑制劑通過下調成骨標記基因表達來減弱DAG介導的EBs礦化。
最后,為了闡明ERK介導的信號在DAG刺激的EBs礦化中的作用,用si-ERK1、si-ERK2或兩者轉染。DAG誘導的EBs礦化通過si-ERK1而不是si-ERK2的轉染而減弱(圖5 A)。ARS染料特異性光密度的測量證實了ERK1介導的信號與DAG刺激的EBs礦化之間的關聯,因此與DAG對照組相比,si-ERK1轉染的EBs礦化顯著較低(圖5 B)。拉伸應力介導的DAG刺激的EBs礦化減少與其直徑大小密切相關,其中si-ERK1或si-ERK1/2轉染的EBs的平均菌落直徑顯著小于DAG對照組(圖5 C)。用si-ERK1或si-ERK1/2轉染,而不用si-對照或si-ERK2轉染,顯著抑制了DAG處理的EBs中RUNX2和OCN的水平(圖5 D、E)。此外,ERK1 而不是 ERK2 介導的信號通過調節 RUNX2 的表達介導 DAG 刺激的 EBs 的礦化(圖5 F、G)。這些數據表明,ERK1介導的信號在DAG刺激的EBs中充當RUNX2的上游效應因子。

圖5 用 si-ERK1 轉染減少了 DAG 刺激的 EBs 礦化。(H)圖形概要
總之,該研究考察了循環拉伸應力對 DAG 刺激的 EBs 成骨能力的影響及其相關機制(圖5 H)。研究表明,拉伸應力抑制了 DAG 刺激的 EBs 成骨分化和礦化;還表明ERK1 介導的信號,而非 Wnt/β-catenin 信號,與張力介導的成骨抑制密切相關;p-ERK1 在 DAG 刺激的 EBs 中作為 RUNX2 的上游效應子。
參考文獻:An JH, Kim CC, Lee J, Kim J, Lee JC, Kook SH. Tension Force Stress Downregulates the Expression of Osteogenic Markers and Mineralization in Embryonic Stem-Cell-Derived Embryoid Bodies. Cells. 2025 Jun 28;14(13):991. doi: 10.3390/cells14130991. PMID: 40643512; PMCID: PMC12248426.
原文鏈接:https://pubmed.ncbi.nlm.nih.gov/40643512/
圖片來源:所有圖片均來源于參考文獻
小編旨在分享、學習、交流生物科學等領域的研究進展。如有侵權或引文不當請聯系小編修正。如有任何的想法以及建議,歡迎聯系小編。感謝各位的瀏覽以及關注!進入官網www.naturethink.com或關注“Naturethink”公眾號,了解更多相關內容。
點擊了解:牽張應變細胞培養儀






