生物制藥抗藥抗體(ADA)的檢測、測量和表征方法
文章來源公眾號:梓樹藝藥薈 作者:梓樹zishu
摘要:
基于抗體的治療劑和其他生物制藥現在用于治療許多疾病。然而,當這些生物藥物給患者服用時,可能會發生免疫反應,從而降低藥物的療效并導致不良副作用。生物制藥的免疫原性可以通過檢測和測量針對這些藥物產生的抗體或抗藥抗體(ADA)來評估。ADA檢測和分析方法在選擇基于此類藥物的治療方法時可能很重要,并且在開發和測試新的生物制藥時也至關重要。本綜述研究了用于ADA檢測、測量和表征的方法。其中許多方法基于免疫測定和抗原結合試驗,包括均勻遷移率轉移測定。其他用于分析ADA的技術包括毛細管電泳、報告基因測定、表面等離子體共振光譜和液相色譜-質譜法。將討論每種方法的一般原則,以及它們在ADA分析方面的最新應用。
【NO.1】簡介
1.1.生物制藥和治療性單克隆抗體
近年來,基于抗體、蛋白質或相關生物制劑的生物制藥已變得普遍。例如,第100種單克隆抗體(mAb)產品最近獲得了美國食品和藥物管理局(FDA)的批準。僅在2020年,美國FDA就批準了13種mAb用作治療劑。基于抗體的生物制藥現在構成了治療市場的重要組成部分,近年來大多數最暢銷的藥物都是基于單克隆抗體的。阿達木單抗(Humira,來自艾伯維)、英夫利昔單抗(Remicade、Johnson)、利妥昔單抗(Rituxan、Roche)和派姆單抗(Keytruda、Merck)都是用于此目的的單克隆抗體。
單克隆抗體的靶標特異性使這些藥物作為治療其他疑難雜癥(如各種癌癥和自身免疫性疾病)引起了人們的極大興趣。通過重組技術,還可以定制單克隆抗體的許多特性,例如它們的親和力、大小和一般結構。然而,由于單克隆抗體和其他生物制藥是人造的,對人體有害,因此這些藥物在給患者服用時有可能引起免疫反應。盡管并非所有免疫應答病例都可能導致不良反應,但免疫原性的發展可導致生物制藥療效喪失。隨著時間的推移,這可能意味著需要增加生物制藥的劑量,或者如果發生更嚴重的免疫反應,可能不得不停用該藥物。
通過分析抗藥抗體(anti-drugantibodies,ADAs)可以檢測生物制藥(如單克隆抗體)的免疫應答。例如,ADA的出現是單克隆抗體(如阿達木單抗)治療失敗的已知因素,單克隆抗體(如阿達木單抗)與腫瘤壞死因子α(TNF-α)結合并抑制腫瘤壞死因子α(TNF-),這可以通過藥物-ADA復合物的形成和藥物活性的中和而發生。這些影響導致對靈敏、精確和可靠的ADA檢測的需求不斷增加。現在有許多方法可用于檢測、測量和表征ADA。本綜述將描述ADA檢測或分析中使用的各種技術,并討論每種方法的應用。
1.2.抗體和單克隆抗體的一般性質
抗體是免疫系統響應外來物質或抗原產生的糖蛋白。典型抗體的基本結構,以免疫球蛋白G(IgG)為代表,由兩條相同的長(或“重”)多肽鏈和兩條較短(“輕”)多肽鏈組成,它們通過二硫鍵連接成“Y”形(見圖1)。該結構的兩個上臂包含抗體的片段抗原結合(Fab)區域,這是抗體具有可以選擇性地與其給定靶標結合的位點的地方。抗體的下莖稱為片段可結晶(Fc)區域。該區域的功能是介導抗體與免疫系統其他組分之間的相互作用。
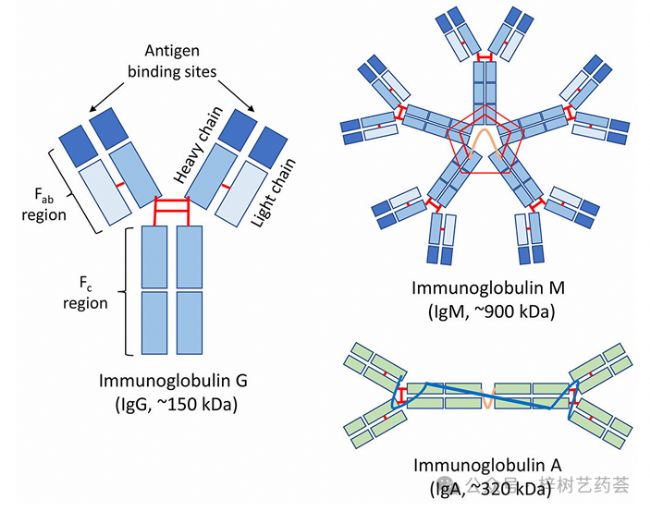
圖1 抗體的一般結構,如使用IgG所示,以及抗體的主要類別或同種型(例如IgG、IgM和IgA)的示例。
抗體屬于免疫球蛋白(Ig)超家族,可分為五個常見類別(或同種型):IgA、IgD、IgE、IgG和IgM(示例見圖1)。IgD、IgE和IgG類抗體以單體形式表達,而IgM在體內以基本Ig結構的五聚體形式存在,IgA通常以二聚體形式存在。這些類中的每一個都有不同的功能。例如,IgM是免疫應答早期血液中產生的最豐富的抗體類型,隨著對外來物質的免疫建立,IgG是循環系統中的主要Ig類別。
單克隆抗體是由單個克隆細胞系產生的抗體。這組抗體既可作為基于抗體的檢測試劑,也可作為生物治療劑,因為它們具有明確的結合強度和對其靶抗原的特異性。與此相反,通常由免疫系統產生的抗體具有高度異質性,由免疫系統中的許多細胞系產生,從而產生一種被稱為“多克隆抗體”的混合物。在開發用于治療的單克隆抗體時,免疫球蛋白同種型是經過精心挑選的,例如在治療中使用期間為藥物提供相對較長的半衰期。在實踐中,IgG類抗體是用于生產治療性單克隆抗體的最常用的免疫球蛋白形式。
單克隆抗體在人體內的免疫原性水平與抗體的修飾水平有關。第一代mAb是通過Kohler和Milstein的雜交瘤技術創建的,該技術涉及小鼠骨髓瘤細胞與B淋巴細胞融合以產生小鼠mAb。盡管鼠mAb作為生化研究的試劑很有價值,但它們在人類中的免疫原性限制了其治療效用。后來發現,與人抗體相比,與人抗體結構差異較小的人類或人源化單克隆抗體誘導的免疫反應低于鼠單克隆抗體。目前已經開發出幾種類型的類人或人源化單克隆抗體。例如,將小鼠來源的可變區域與人類抗體的恒定區域相結合,將產生“嵌合”單克隆抗體。在“人源化”單克隆抗體中,除抗原識別區域外,鼠抗體的所有部分都已被人類對應物取代。在“全人源化”單克隆抗體中,抗體的所有部分均來自人類,不含來自其他物種的任何部分。
1.3.抗藥抗體
免疫原性是指宿主對外來物質(如治療性單克隆抗體)的免疫反應。對于生物治療藥物,這種反應反映在免疫系統產生ADA上。針對生物治療藥物的ADA的形成可導致患者治療期間的不良反應,例如清除率增加和對藥物過敏。第一代生物制藥中使用的鼠單克隆抗體的成功率較低(~3%),證明了免疫原性可能引起的影響。然而,研究還發現,這種免疫反應可以通過重組DNA技術和噬菌體展示方法設計具有更類人結構的單克隆抗體來介導。使用通過這些方法制成的人源化單克隆抗體已將這些生物治療藥物的平均成功率提高到25%。
ADA的存在和水平現在被認為是生物治療藥物(如mAb)衡量免疫原性的指標。此外,ADAs會影響其靶藥的藥效學和藥代動力學,從而降低該藥物的療效。在某些情況下,ADAs可對慢性病患者造成嚴重不良反應。ADA可分為兩大類:中和和非中和。中和ADA可以直接阻斷和干擾生物治療劑的功能活性,使其與所需靶標結合。非中和ADA(或“結合性”ADA)與生物治療劑結合,但結合的區域不會影響藥物與靶標的結合能力。在臨床環境中,中和ADA通常被認為更重要,因為它們直接影響藥物的生物活性,但非中和ADA也可能間接降低藥物的療效。
作為一個具體的例子,已知在患者使用αTNF拮抗劑的生物治療藥物后可以產生ADA。這組藥物包括英夫利昔單抗和阿達木單抗,用于治療慢性炎癥性疾病(如類風濕性關節炎、銀屑病關節炎和克羅恩病)。TNF-α拮抗劑通過靶向TNF-α并抑制其與TNF-α受體的結合來減少炎癥反應。中和ADA可以直接干擾TNF-α拮抗劑與其靶分子(即TNF-α)的結合,從而直接阻止藥物的生物活性。非中和ADA會通過損害藥物的生物利用度并改變藥物從循環中的清除率來間接降低同一藥物的療效,例如通過形成ADA藥物免疫復合物。
【NO.2】抗藥抗體的免疫測定和結合測定
開發具有高靈敏度、精密度和特異性的ADA檢測方法對于生物制藥的質量控制和檢查這些藥物治療患者至關重要。其中許多方法基于免疫測定。免疫測定是利用抗體或抗體相關試劑來鑒定或測量目標分析物的分析技術。抗體與其抗原的強結合使得免疫測定可用于選擇性檢測其靶標,即使在復雜的生物樣本(如血清、血漿、尿液、組織和血液)中也是如此。
通過免疫測定法檢測和定量分析物是通過使用可與其中一種測定組分偶聯并在適當的水平上監測以測量目標來完成的。免疫測定中最常用的標記物是酶、熒光標簽、化學發光標記和放射性同位素。這些標記物可以與抗體-抗原結合一起使用,具有競爭性或非競爭性以及同質或異質形式。如果以其中一種形式使用抗體或抗原以外的生物制劑,則結果有時會被賦予更通用的名稱“結合測定”。本節討論了用于測量或檢測ADA的免疫測定和結合測定的具體示例。
2.1.抗原結合試驗
抗原結合試驗(ABT)是一種結合測定,已用于評估生物制藥的免疫原性。在ABT中,抗體或其相應的抗原被固定化并用于捕獲其相應的結合伙伴或靶分析物。該測定中可以加入各種類型的標記,以產生用于檢測或確定捕獲分析物量的信號。
這種測定的一種形式是pH-shift-anti-idiotypeantigenbindingtest(或PIA),如圖2所示。該方法首先利用酸解離步驟從與這些抗體結合的任何藥物中釋放ADA;然后中和該溶液并添加可以與藥物結合的F(ab)片段以防止藥物與ADA重新結合。然后將ADA和藥物都吸附到含有固定化蛋白A的載體上,該載體可以與ADA(例如,來自IgG的各個亞類)結合,并通過其Fc區域與藥物結合。然后加入標記的藥物F(ab)2部分以結合并檢測捕獲的ADA。該方法已與125份I標記的F(ab)2部分阿達木單抗一起使用,以測量這種基于mAb的藥物存在下的ADA。
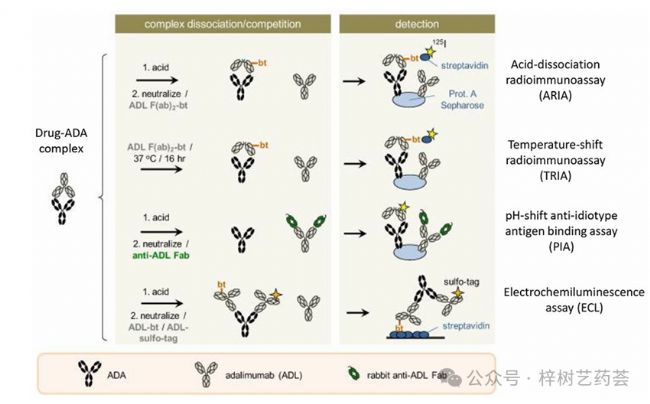
圖2 用于分析ADA與基于mAb的生物制藥的四種免疫測定或結合測定的示例。這些方法通過使用阿達木單抗作為感興趣的藥物來說明。
2.2.電化學發光測定
在基于電化學發光(ECL)的結合測定中,通過使用施加的電位產生來自化學標簽的光來產生信號。標簽通過氧化/還原反應達到激發態,然后通過發光將激發態弛豫為較低能態。這種類型的檢測已被用于ADA檢測,方法是使用釕標記(例如,三(聯吡啶)釕(II)或[Ru(bpy)3]2+)。在這種方法中,允許樣品中的ADA與含有兩種標記的靶單克隆抗體藥物形式結合:生物素和釕。然后讓ADA與標記藥物的橋接復合物吸附到含有固定鏈霉親和素的金板上,該金板可以與生物素標簽結合。然后測量吸附絡合物及其相關釕標簽的ECL信號。
在一項研究中使用了ECL結合測定,其中針對五種基于mAb的藥物的多克隆和親和純化抗體用作模型ADA。將這些抗體的樣品與生物素和釕偶聯形式的藥物一起孵育,然后用釕標簽測量發光。使用酸解離步驟的這種方法的一般方案如圖2所示。在低至5-64μg/L的水平和較寬的動態范圍內(即10-10000μg/L)檢測到給定藥物的ADA。磺化形式的釕偶聯物(即有助于提高水溶性的磺基標簽)也被用于具有ECL檢測的ADA測定。
在ECL檢測測定中,已經探索了一種同時使用藥物-ADA復合物的沉淀和酸解離的策略來檢測ADA。在該方法中,通過添加過量的相應單克隆抗體藥物形成免疫復合物來飽和樣品中的ADA,然后使用聚乙二醇沉淀這些復合物。然后在酸性條件下將藥物和ADA從復合物中釋放出來,并吸附到板上進行檢測。接下來,將磺基標記形式的藥物應用于與固定化的ADA結合并產生由于ECL的信號。與僅使用酸解離的ECL橋接免疫測定相比,這種形式對高藥物濃度的耐受性有所改善,ADA的回收率更高。
在免疫測定法中進行了結構域特異性檢測,并ECL檢測ADAs與moxetumomabpasudotox(即具有兩個特異性結構域的重組抗CD22免疫毒素)。該測定基于在生物素化形式的藥物(即用于捕獲ADA)和藥物的釕酰化標記形式(用于ECL檢測)存在的情況下,具有和不具有含結構域分子的結構域特異性ADA的競爭性結合。信號抑制是由于結構域特異性ADA與含結構域分子結合而發生的。該測定允許在存在更顯性的結構域特異性ADA的情況下檢測低豐度的結構域特異性ADA。
2.3.放射免疫測定
放射免疫測定(RIA)是一種使用放射性同位素作為標記物檢測分析物的免疫測定。碘-125是一種常見的放射性同位素,在RIA中用作標記。盡管使用這種標簽可以提供較低的檢測限,但在使用放射性同位素作為標簽時也需要考慮安全性、處理和標簽存儲方面的問題。其他需要考慮的因素包括使用放射性標記時標記的結合劑可能變性以及隨著時間的推移最終信號丟失。
一些研究使用RIAs分析ADA。藥物-ADA免疫復合物的酸解離已與RIA一起使用,以克服當存在此類免疫復合物時可能發生的對ADA的低估。這種方法被稱為酸解離放射免疫測定(acid-dissociationradioimmunoassay,ARIA)。如圖2所示,在ARIA中,允許針對靶標生物制藥的未結合ADA與針對此類抗體的生物素化F(ab')2片段結合,然后免疫復合物的酸解離是樣品,然后中和溶液。然后使用含有蛋白質A的載體捕獲該混合物中產生的F(ab')2-生物素-ADA復合物,該載體用于與ADA或基于mAb的藥物的Fc區域結合。然后通過添加125個I標記的鏈霉親和素來檢測也與生物素化F(ab')2片段結合的捕獲的ADA,該鏈霉親和素與生物素標簽結合。
其他形式的RIA也已用于ADA的分析。例如,在針對阿達木單抗的ADA的溫移RIA(TRIA)中使用了與PIA類似的方法。該方法(見圖2)使用可與ADA結合的生物素化F(ab')2片段,以取代ADA測定中酸化步驟的需要,該測定將在目標藥物(即阿達木單抗,在本例中為阿達木單抗)存在下進行。另一份報告采用液相RIA聯合親和色譜法測定患者樣本中英夫利昔單抗和阿達木單抗的ADA水平。在這項工作中,通過使用含有抗人免疫球蛋白λ鏈抗體的載體來分離放射性標記英夫利昔單抗的游離形式和抗體結合形式。
2.4.酶聯免疫吸附測定
酶聯免疫吸附測定(ELISA)是用于檢測和測量ADA的最常見免疫測定類型。為此,使用ELISA的優點包括靈敏度高、成本低、易于使用和通量相對較高。有多種ELISA格式可用于ADA檢測,例如直接、間接和橋接(或夾層)方法。
2.4.1.直接和間接ELISA
直接檢測形式是最簡單的ELISA類型。當用于分析ADA時,這種形式涉及將樣品中的ADA固定(例如,通過吸附或共價附著)到ELISA板上。接下來,將含有酶標記的二抗(如辣根過氧化物酶(HRP)或堿性磷酸酶)添加到板中,并使其結合固定化的ADA。然后添加適合酶標記的底物以產生與存在的ADA量成正比的信號。作為替代方法,生物素可用于標記捕獲的ADA,然后與鏈霉親和素偶聯酶結合;然后,該酶標記隨后與其底物結合,產生與捕獲的ADA數量相關的信號。
這種方法的一個例子是基于親和捕獲洗脫(ACE)的直接ELISA,該方法用于檢測針對基于mAb的藥物bamlanivimab的ADA。使用酸解離步驟分解樣品中的ADA-藥物復合物,然后在固相載體上使用靶藥來捕獲游離或釋放的ADA。然后通過采用第二個酸解離步驟將捕獲的ADA從載體中洗脫出來。然后讓洗脫的ADA吸附到ELISA支持表面上,并在添加生物素化形式的藥物、HRP標記的鏈霉親和素和HRP底物后進行檢測。研究發現,在單克隆抗體藥物過量1000倍的情況下,這種直接ELISA形式可以檢測到低至500ng/mL的ADA。
盡管直接ELISA簡單易行,但使用這種方法檢測和測量ADA確實有幾個缺點。首先,將ADA固定在ELISA板上會導致這些抗體的構象發生變化,并掩蓋其結構中的某些區域;這種掩蔽可能會阻礙這些捕獲的藥物與二級結合劑的結合。此外,由于ADA固定在ELISA載體或板上的固定性通常不具有特異性,因此樣品中的其他蛋白質可以與該載體/板結合,并可能導致高背景信號。
在ADA的間接ELISA中,在固定ADA后將原始生物制藥劑添加到ELISA板中。然后將該抗原的二級形式的酶標記形式添加到板中。這形成了標記的免疫復合物,可以產生與板上ADA數量成正比的信號。間接ELISA的一個關鍵特征是需要物種特異性二抗原進行檢測,當動物血清用作檢測人血清中ADA的陽性對照時,該項目可能是一個問題。然而,橋接ELISA(如下一節所述)可用于克服這個問題,并允許檢測任何同種型或物種的抗體。
2.4.2.橋接ELISA
橋接ELISA使用兩種結合劑(如靶藥)與ADA上的不同區域相互作用(見圖3)。其中一種結合劑涂在ELISA板上,用于捕獲ADA。然后將含有酶標記的第二種結合劑添加到混合物中,使其與捕獲的ADA結合,并產生檢測信號。
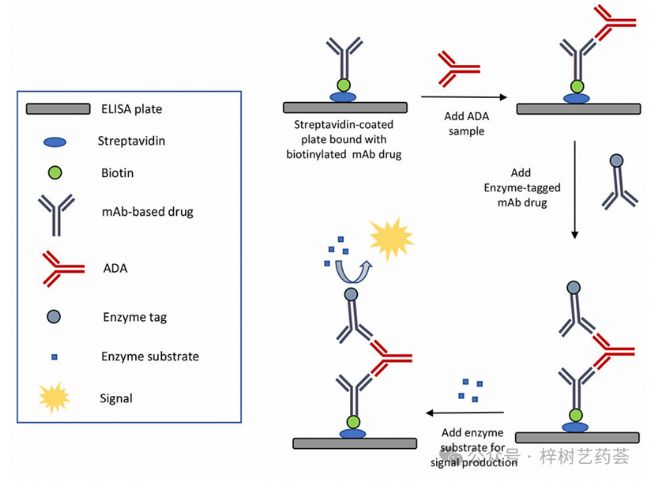
圖3 用于ADA檢測的橋接ELISA中的一般方案
使用對ADA上不同區域特異性的兩種結合劑,使橋接ELISA比直接和間接ELISA格式更具特異性,這一功能在處理復雜樣品時非常有用。與直接和間接ELISA相比,橋接ELISA的其他優點是靈敏度高,不需要物種特異性抗體作為試劑。此外,該方法比直接和間接測定形式更能耐受循環藥物的濃度。由于這些優點,橋接ELISA是目前用于檢測ADA的最常用ELISA格式。
然而,橋接ELISA也有缺點。例如,這種類型的測定比直接或間接ELISA方法更復雜,因為它對ADA上的不同區域使用兩種結合劑。此外,橋接ELISA格式可能無法檢測低親和力ADA和單價抗體。盡管這種形式對循環藥物的存在具有很強的耐受性,但它仍然容易受到高濃度這些藥物的干擾。當該方法與固相萃取和酸解離相結合時,可以在一定程度上減少藥物干擾問題。后一種方法依賴于這樣一個事實,即抗體和固定化抗原之間形成的復合物通常比抗體和可溶性抗原之間形成的復合物或存在于抗體-抗體復合物中的復合物更穩定
橋接ELISA已用于檢測針對各種生物制藥和單克隆抗體藥物的ADA;例如,促紅細胞生成素、干擾素β、美妥珠單抗、阿達木單抗、英夫利昔單抗和Eternacept的ADA檢測。使用橋接ELISA測定法檢測針對美妥珠單抗的抗體,方法是將一些藥物放在微量滴定板上以捕獲針對該藥物的ADA。然后加入HRP標記的美妥珠單抗,并與顯色底物(3,3',5,5'-四甲基聯苯胺或TMB)一起使用,以提供0.39ng/mL的檢測限和0.39-50ng/mL的線性范圍。在另一項研究中,橋接ELISA用于檢測針對基于單克隆抗體的藥物MAB072的IgE類ADA。這項工作使用涂有人IgE受體FcεRIα的板從血清樣本中捕獲IgE類ADA。然后加入生物素化形式的MAB072并使其與捕獲的IgE類ADA結合,然后加入鏈霉親和素標記的HRP和TMB作為顯色底物進行檢測。另一項研究使用橋接ELISA將共價偶聯的高密度抗原表面與酸解離相結合,以盡量減少ADA與基于mAb的化療藥物分析過程中高藥物濃度的干擾。此外,橋接ELISA與基于生物素-親和素系統的固相提取和酸解離預處理相結合,從基于mAb的藥物中分離和測量ADA和藥物結合的ADA。
越來越多的生物治療藥物含有工程序列或多個功能結構域。一項研究使用基于ELISA的測定法檢測ADA并表征雙特異性F抗體片段的免疫原性部分。該方法將間接橋接ELISA與分子工程方法相結合,該方法使用基于藥物變體的多種結構域檢測測定。雷珠單抗是一種抗VEGF抗體藥物,在恒定區域沒有突變,用作測定的對照。結果表明,ADA主要針對藥物的兩個抗原結合位點。此外,該方法可以區分針對單克隆抗體藥物的一個或兩個抗原結合位點的抗體和恒定結構域區域。
近年來,已經開發了橋接ELISA格式,用于測量免疫復合物而不僅僅是游離ADA,或用于分析ADA和免疫復合物。例如,使用橋接ELISA測量在接受阿達木單抗治療的小鼠血漿中發現的循環ADA-人IgG免疫復合物。在該測定中,將多克隆山羊抗人IgG固定在ELISA板上,并用于捕獲樣品中存在的ADA-人IgG復合物。接下來,加入HRP標記的山羊抗小鼠IgG和HRP底物進行檢測。在一項類似的研究中,酸解離與橋接ELISA和色譜法一起使用,采用尺寸排阻支持來定量和表征藥物-ADA免疫復合物。將針對靶藥互補決定區(CDR)的生物素化mAb固定在鏈霉親和素包被的板上,并用于從樣品中捕獲藥物-ADA免疫復合物。隨后加入地高辛標記的單克隆抗體對抗藥物的CDR,然后加入HRP標記的抗地高辛F抗體片段,并使用3-(4-羥基苯基)丙酸作為HRP底物進行基于熒光的檢測。
2.5.均勻遷移率轉移測定
均質遷移率位移測定(HMSA)是一種將配體結合測定與尺寸排阻色譜(SEC)相結合的方法。SEC是一種色譜技術,可以根據目標化合物的相對大小和形狀來分離目標化合物。這種分離是通過使用含有多孔載體的色譜柱進行的。由于較小的靶標將能夠進入更多的載體孔體積,因此它們比較大的化合物更晚從色譜柱中洗脫出來。在HMSA方法中使用SEC可以區分不同大小的ADA同種型,例如基于IgG、IgM或IgA的同種型。
HMSA的一般方法如圖4所示,如該方法在檢測和基于大小分離人血清中ADA與英夫利昔單抗的應用。在本報告中,使用酸解離步驟從ADA-藥物復合物中釋放ADA。然后將含有釋放的ADA的溶液中和,并與熒光標記的英夫利昔單抗(即使用AlexaFluor488標簽)和一種活性位點阻斷的藥物形式的混合物孵育,后者用作內標。為了測量樣品中英夫利昔單抗的濃度,遵循相同的程序,但現在添加了AlexaFluor488標記的TNF-α,并且沒有酸結合步驟。將該方法的結果與橋接ELISA的結果進行了比較。研究發現,在血清中存在高濃度(60ug/ml)英夫利昔單抗的情況下,該方法可以檢測到低至0.036ug/mlADA。
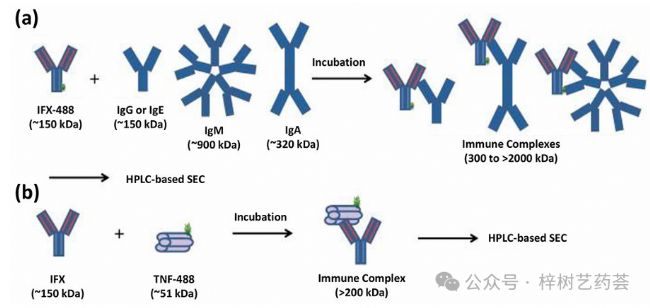
圖4.當用于(a)檢測給定藥物的ADA或(b)母體藥物時,使用英夫利昔單抗(IFX)和AlexaFluor488標記的藥物(例如IFX-488)在本例中。TNF-488代表AlexaFluor488標記的TNF-α。
其他類型的ADA和生物制藥(如阿達木單抗)也采用了相同的方法。例如,使用HMSA鑒定并分離了阿達木單抗和11種不同ADA的二聚體和多聚體免疫復合物。據報道,使用HMSA可以將中和ADA與阿達木單抗和英夫利昔單抗處理樣品中的其他成分區分開來。在HMSA中中和抗體的檢測與另一種基于親和力捕獲和洗脫的測定中發現了相關性。ELISA也進行了類似的比較。HMSA還被用于鑒定基于mAb的藥物那他珠單抗和優特克單抗的ADA。
開發了一種改良的競爭性結合形式的HMSA來測量存在同類藥物的蛋白質療法。以阿達木單抗為模型藥物,并定量了阿達木單抗的血清濃度。將含有英夫利昔單抗作為相關藥物的血清樣品與熒光標記的阿達木單抗混合,然后將ADA添加到阿達木單抗中,并使用1小時孵育步驟以形成免疫復合物。HMSA的SEC組分用于區分游離藥物(摩爾質量,~150kDa)和阿達木單抗-ADA二聚體(~300kDa),并使用ELISA驗證HMSA方法。
【NO.3】ADA的其他分析方法
除了免疫測定和結合測定之外,還采用了其他幾種方法來分析ADA。這些其他技術包括毛細管電泳、報告基因測定、表面等離子體共振光譜和液相色譜-質譜法。本節將研究與ADA檢測、測量或識別相關的每種方法的一般原則和應用。
3.1.毛細管電泳
毛細管電泳(CE)是一種分離技術,它基于分析物通過毛細管和施加電位的差異遷移。影響分析物在CE中的遷移速率和遷移率的因素包括分析物的大小和電荷,以及毛細管內背景電解質的pH值、溫度和組成。CE的幾種模式已被用于檢查基于抗體的藥物和抗體-藥物偶聯物。這些模式包括毛細管區電泳、毛細管等電聚焦(capillaryisoelectricfocusing(cIEF)和毛細管凝膠電泳。
CE已被用于篩選ADA與抗體相關生物治療藥物(包括納米抗體)的對抗。納米抗體是重組VHH片段,源自駱駝科動物產生的獨特重鏈抗體。每個VHH片段都可以通過短肽序列連接,以構建具有特定結合特性的納米抗體。納米抗體的摩爾質量約為15kDa,比傳統的多克隆或單克隆抗體(典型摩爾質量,IgG類抗體為~150kDa)小得多。納米抗體的尺寸較小,加上它們對靶標表現出的特異性和強結合性,使這些藥物作為生物治療藥物的平臺具有吸引力。
一份報告描述了一種自動化CE方法,該方法是毛細管蛋白質印跡系統的改進版本。該方法用于檢測三種不同的多模塊納米抗體的ADA。在這種方法中,將納米抗體固定在毛細血管表面,以分析ADA陽性小鼠樣本中ADA的水平。CE首先用于根據ADA的大小和遷移時間的差異將ADA與其他樣品組件分開。然后通過光活化捕獲化學將分離的ADA固定在毛細管內。然后添加HRP標記的二抗,通過在魯米諾和過氧化物存在下產生光來結合和測量固定化的ADA。通過該方法檢查了多模塊納米抗體中不同區域的誘導免疫反應。
另一種基于CE的ADA納米抗體檢測方法被創建出來,該方法使用PeggySue系統來減少變性步驟對樣品的影響。PeggySue系統是一種基于電荷和大小的分離和定量系統,它結合了免疫測定的特征與蛋白質印跡和cIEF。在該技術中,在毛細管中產生pH梯度,然后在cIEF中用于根據蛋白質的等電點或pI值分離蛋白質。將可能含有ADA的樣品在毛細管內孵育,并與分離的蛋白質一起孵育以形成免疫復合物。然后可以通過使用針對給定ADA物種的酶標記的二抗來檢測這些免疫復合物。
3.2.報告基因檢測
報告基因檢測(RGA)是另一種用于檢查ADA的方法。RGA是一種基于細胞的檢測方法,它使用基于光的信號(例如生物發光)來研究細胞中的給定基因。這是通過測量啟動子和報告基因之間相互作用產生的光發射來實現的,這些酶或蛋白質可以與生物發光信號相連,例如熒光素酶、綠色熒光蛋白、氯霉素乙酰轉移酶、aequorin或β-半乳糖苷酶。例如,熒光素酶可以通過其酶活性產生生物發光,而綠色熒光蛋白由于其固有的熒光可以直接產生信號。
RGA已應用于基于蛋白質的生物治療藥物和相關ADA的研究(見圖5)。使用NFkB調控的螢火蟲熒光素酶和腎熒光素酶報告基因的TNF-α反應性報告基因細胞系來檢查TNF-α和三種TNF-α拮抗劑(英夫利昔單抗、阿達木單抗和依那西普)的活性。在測定中使用TNF-α誘導的螢火蟲熒光素酶活性監測TNF-α拮抗劑。這種反應后來被標準化,由海腎熒光素酶活性產生。使用這兩種熒光素酶活性的信號比來估計TNF-α拮抗劑的中和抗體水平。采用相同的測定形式篩選大量臨床樣本中英夫利昔單抗活性和中和ADA的活性。這證明了RGA在臨床研究中篩選ADA與TNF-α拮抗劑的潛在用途以及ADA的中和活性。
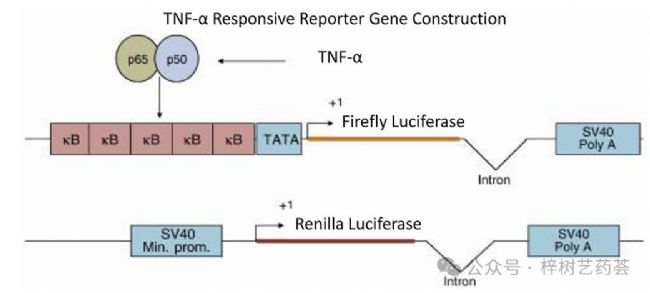
圖5.TNF-α響應性報告基因構建,用于測量ADA對TNF-α拮抗劑。在此圖中,κB是NFκB識別序列;顯示了螢火蟲熒光素酶和海腎熒光素酶的編碼區域。內含子來自人β球蛋白基因,SV40PolyA是SV40聚腺苷酸化位點,SV40Min.prom。代表SV40最小啟動子。
3.3.表面等離子體共振光譜
表面等離子體共振(SPR)光譜是一種基于光學的測量系統,通常用于研究生物相互作用和作為生物傳感器平臺。這種檢測方法利用相鄰兩個界面之間的離域電子,例如介電材料和金屬(例如金或銀)。在SPR中,光源用于激發這些離域電子以產生表面等離子體共振波。電介質(例如棱鏡)將入射光分成與該波共振或不共振的兩個部分。沒有與波的共振,光被反射;在存在共振的情況下,光會激發波并導致金屬表面入射光的折射率發生偏移。這種效應的這種大小可以通過涉及吸附在金屬表面的物質的結合事件來改變,從而使SPR可以用作檢查生物相互作用的程度和速率的工具。
ADA和ADA藥物偶聯物的檢測和測量都是使用SPR進行的。例如,SPR用于評估帕尼單抗的免疫原性,帕尼單抗是一種與表皮生長因子受體結合的單克隆抗體藥物。在基于SPR的免疫測定中,將帕尼單抗樣品共價固定在傳感器芯片上,并用于檢測低至1μg/ml水平的ADA。SPR測定還可以鑒定某些樣品中的中和抗體。SPR被用作與曲巴尼的ADA的ECL檢測橋接試驗的替代方法。另一份報告顯示,在從兒科患者血清樣本中分離出的ADA中發現了解離平衡常數在10−6M至10−9M之間的抗阿達木單抗抗體。
據報道,SPR還有其他一些與ADA相關的應用,例如同時測量生物制藥及其ADA。其中一種應用使用具有六個平行條帶的SPR傳感器陣列,其中固定了TNF-α、英夫利昔單抗和IgG類抗體;該陣列使得在幾分鐘內測量血清中的英夫利昔單抗及其ADA成為可能。此外,使用基于SPR的免疫測定法和免校準濃度分析來估計對照樣品中已知與人胰島素、德谷胰島素(Tresiba)或turoctocogalfa(NovoEight)結合的活性抗體水平。
3.4.液相色譜-質譜
與ELISA和其他配體結合測定相關的局限性,如循環藥物的干擾和無法鑒定同種型,導致了基于ADA檢測的液相色譜-質譜(LC-MS)方法的發展。ADA的LC-MS方法通常從免疫捕獲步驟開始,以結合樣品中的ADA或相關靶標(見圖6)。例如,可以將基于mAb的藥物的生物素化形式添加到樣品中,以結合該藥物的ADA或相關的ADA-藥物免疫復合物。在這種情況下,還可以添加含有固定化鏈霉親和素的磁珠以捕獲藥物的生物素化形式以及與該藥物類似物結合的任何ADA或ADA-藥物復合物。酸解離步驟可用于釋放靶藥,剩余的ADA可以使用胰蛋白酶消化,從而從ADA中獲得可通過LC-MS定量和表征的肽。將免疫捕獲與LC-MS結合使用的一些優點是,它允許在一次檢測中對多類抗體進行抗體同種分型和分析。
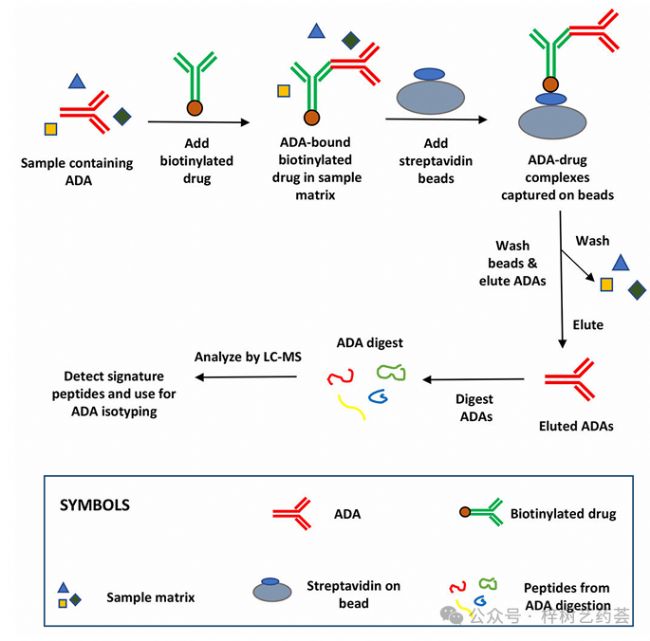
圖6.使用免疫捕獲和LC-MS進行ADA檢測的一般方案
近年來,一些研究使用免疫捕獲和LC-MS來檢測基于mAb的治療藥物中的ADA。實現這一目標的一種方法是通過間接測量ADA。例如,免疫沉淀已與LC-MS一起使用,為血清中的ADA提供間接測定,該ADA也可以耐受高藥物濃度的存在。該方法涉及使用高濃度的靶單克隆抗體藥物使ADA上所有可用的結合位點飽和。在此步驟之后,使用蛋白G(即固定在磁珠上)來分離與添加的基于mAb的藥物結合的IgG類ADA。經過幾個洗滌步驟并洗脫分離的ADA-藥物復合物后,加入穩定同位素標記的肽標準品。在酶解步驟后,使用基質輔助激光解吸/電離飛行時間質譜對單克隆抗體藥物中的幾種肽進行定量。通過將給定肽的量與陽性對照樣品中的抗體濃度相關聯來間接測量樣品中的ADA。另一份報告使用免疫捕獲-LC-MS檢測和間接ADA檢測,同時定量mAb藥物的殘留量、殘留血清成分中存在的IgG類抗體,并通過使用珠子提取和酸解離來中和ADA陽性對照。該測定還使用間接方法來定量人血清中的中和抗體。研究發現,珠子提取和酸解離可有效去除樣品中高濃度的單克隆抗體藥物和干擾血清成分。
使用間接免疫捕獲-LC-MS方法進行ADA檢測的一個主要局限性是無法進行ADA同種分型。通過使用免疫捕獲和LC-MS進行直接ADA檢測,可以克服這個問題。例如,采用免疫捕獲LC-MS測定法,同時提供半定量信息,并對人血漿中的ADA進行同種分型。該測定使用目標藥物或ADA的生物素化形式,該藥物與鏈霉親和素包被的磁珠結合,用于從樣品中捕獲ADA或ADA藥物復合物。隨后從樣品中取出珠子,并使用與珠子的酸解離步驟來釋放ADA。接下來,使用胰蛋白酶消化ADA。然后利用LC-MS檢測和測量抗體重鏈中存在的幾種通用肽,用于ADA的半定量和同種分型。已經評估了類似的方案用于分析生物治療藥物抗體。直接ADA分析的相關策略使用了基于涂覆在磁珠上的單克隆抗體的F抗體區域的免疫捕獲步驟。該技術已與LC-MS一起使用,用于猴血清中ADA的同種分型和半定量,以對抗基于全人源化的mAb藥物。
盡管將免疫捕獲與LC-MS相結合的檢測在ADA的分析中顯示出巨大的前景,但與更常見的配體結合檢測相比,它們確實存在一些局限性。這些限制包括一些可靠性、靈敏度和定量準確性問題,據報道,在LC-MS中使用選定的反應監測來測量藥物基質中的單克隆抗體藥物。此外,選擇最佳肽用于基于ADA分析特征肽的定量方法可能具有挑戰性。
【NO.4】總結
近年來,生物制藥(例如基于單克隆抗體的生物制藥)在藥物方面取得了巨大的增長和興趣。然而,ADA的生產反映了對單克隆抗體和其他生物制藥免疫原性的擔憂,導致需要能夠檢測、測量和表征ADA的陣列。本綜述討論了為此目的創建的幾種測定和分析方法及其應用。許多ADA檢測依賴于涉及抗原-抗體結合或相關生物特異性相互作用的反應。這些方法包括各種形式的免疫測定和抗原結合試驗,例如幾種形式的ELISA、RIA、基于ECL的方法和較新的HMSA方法。其他也用于分析ADA的方法包括使用CE,報告基因測定,SPR或LC-MS。
目前的這套方法使得以更高的精度和良好的檢測限確定ADA濃度成為可能。在這些方法中還采用了許多方案,以便在存在高劑量相應生物制藥的情況下分析ADAs,或鑒定不同抗體類別的ADAs。然而,這方面仍需要進一步的工作。例如,幾項研究表明,當與假陽性或假陰性樣本一起使用時,以及確定同一樣本中的絕對ADA水平時,這些方法的值不一致,這一事實表明需要對該領域的方法進行更多的標準化。已報道的其他問題包括ADA結合測定中樣品存在非平行滴定,其中一些形式在存在高生物制藥水平的情況下容易低估ADA濃度,以及需要確定這些方法中ADA檢測的一組標準截止點。因此,預計該領域的努力將繼續進行,目標是為用于臨床和藥物測試的ADA分析提供更穩健和一致的檢測方法。






