脂質(zhì)體LNP CAR-T技術(shù)的原理及邏輯解析
文章來源公眾號:生物快評 作者:bio2you
細(xì)胞膜和細(xì)胞膜融合是如何發(fā)生的?Lipid nanoparticles,中文翻譯為“脂質(zhì)體”,也就是顆粒在納米尺度上的脂質(zhì)顆粒。為什么我們關(guān)心脂質(zhì)體呢?因為在臨床和科學(xué)上,我們有“操作”細(xì)胞的需求(即把核酸或者蛋白遞送進(jìn)入細(xì)胞)。
我們先以化學(xué)上的甘油三酯為例開始,喚醒一下記憶:
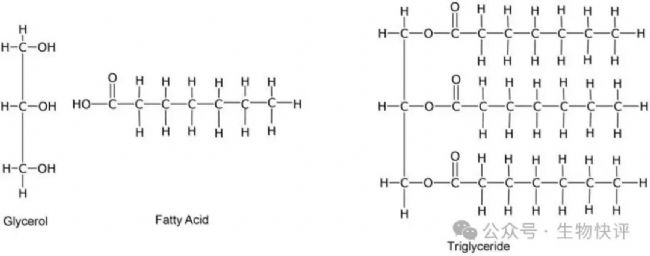
甘油+脂肪酸->形成甘油三酯

這個是甘油三酯,主體是綠色的甘油分子,甘油分子的三個羥基OH分別和脂肪酸形成脂質(zhì)。
如果甘油其中一個OH位置不是脂肪酸,換成一個親水的物質(zhì)呢?
比如以細(xì)胞上的磷脂酰膽堿為例說明:
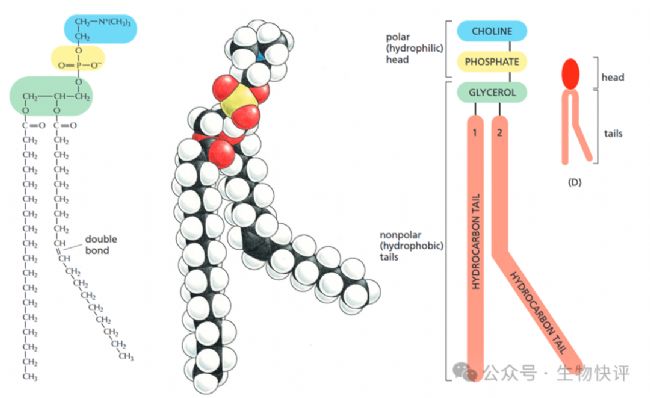
《Molecular Biology of the Cell 6th Edition》
藍(lán)色的為膽堿(親水頭部),綠色為甘油骨架,黃色為磷酸基團(tuán),長長的紅色為脂質(zhì),彎曲的脂質(zhì)是因為有C=C雙鍵,這種雙鍵具有一定的“剛性”,改變了脂肪酸的構(gòu)象。
細(xì)胞不是你想進(jìn),想進(jìn)就能進(jìn)。以哺乳動物的細(xì)胞為例,外面是一層脂質(zhì)雙分子層。如下如所示,紅色的親水的頭部(通常為一些可以結(jié)合水的基團(tuán)),尾巴是分開的脂質(zhì),脂質(zhì)不喜歡水。因為他們的特點,所以在水環(huán)境中,我們看到了細(xì)胞膜是疏水的尾部靠在一起(不喜歡就逃避),親水的頭部朝向胞外液體環(huán)境,或者朝向胞質(zhì)水環(huán)境(喜歡就多接觸)。
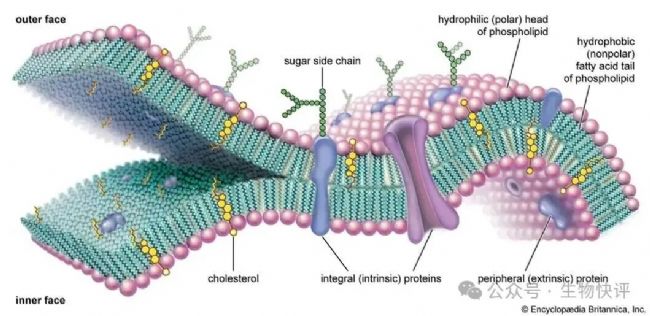
https://www.britannica.com/science/cell-membrane
繼續(xù),我們在熱動力學(xué)角度再分析一下磷脂雙分子成形成的原因
熱力學(xué)中的熵增原理是指在孤立系統(tǒng)中,系統(tǒng)的混亂度(即熵)總是會增加或保持不變,絕不會減少(熱力學(xué)第二定律)。
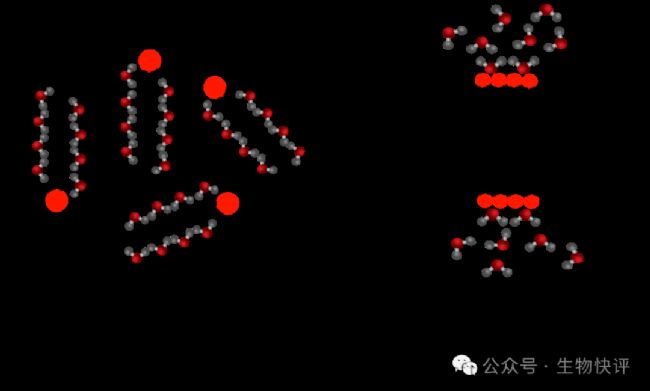
https://www.wizeprep.com/textbooks/undergrad/biology/4164/sections/107355
單個磷脂分子在水相中,它需要接觸水分子,因為疏水端不喜歡水,它會限制水分子的移動。如果磷脂的疏水端合并,減少接觸水,那么更多的水就可以自由移動,自由移動的意思就是“熵增”,即混亂度增加。所以磷脂雙分子層是自發(fā)形成的。
如果在氣相,結(jié)果是相反的。
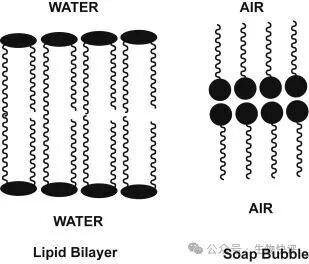
Lipid Bilayer,In subject area: Immunology and Microbiology
自發(fā)形成的磷脂雙分子層怎么就成了細(xì)胞的結(jié)界了呢?
如果我們不在化學(xué)角度上考慮這個磷脂雙分子層,那么就不好理解Na+、K+這種離子,非常小,為什么不能直接通過細(xì)胞膜呢?因為離子在親水頭部向疏水的雙分子層中間轉(zhuǎn)移的過程中,就是遇到脂質(zhì),這個脂質(zhì)就像絕緣體一樣,阻隔了K+的移動,因為他是疏水的,而離子是需要形成離子鍵等,需要親水的環(huán)境。
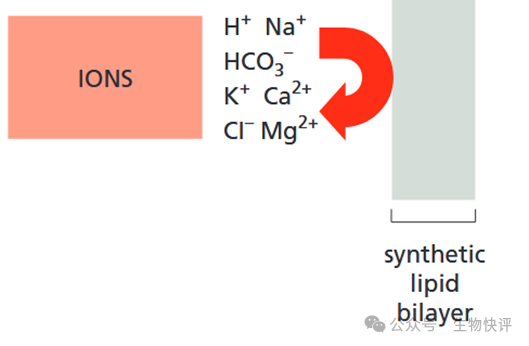

那么又人說:“好像記得化學(xué)老師說過“相似相容””,那么脂質(zhì)體和脂質(zhì)體就是應(yīng)該自發(fā)融解在一起的?換言之,細(xì)胞膜和脂質(zhì)體就是這樣“相似相容”在一起的。
對于“聰明的答案”,我想問:如果按照這個道理,每個細(xì)胞都是脂質(zhì)雙分子層,那我們緊密的細(xì)胞都是“連成”一團(tuán)肉糜了。要記住任何脂質(zhì)體的融合都不是天然發(fā)生的,需要外在的原因,因為在水環(huán)境中脂質(zhì)體融合需要克服水在其中的排斥力。
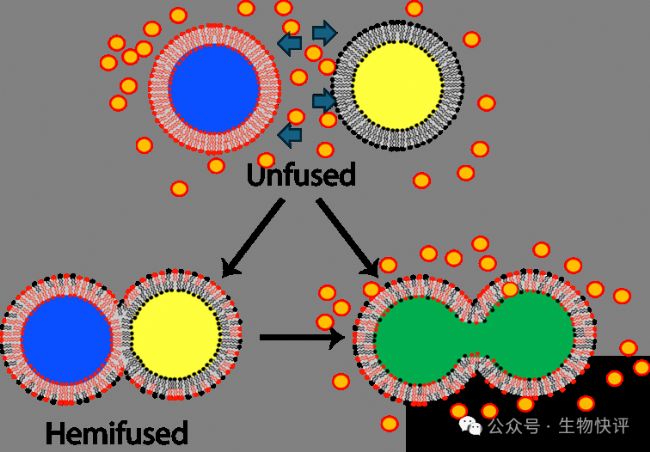
比如這里兩個脂質(zhì)體之間是填充著水分子,水分子進(jìn)行著自由移動,如果需要融合,就需要把兩個脂質(zhì)體中間的水分子都“排開”,這個需要額外的作用力,這個過程不是自發(fā)的。
那難道這個和“相似相容”原則違背了嗎?這個并沒有,相似相容指的是在溶劑中,小分子的化學(xué)物質(zhì),比如脂溶性維生素可以溶解在油脂中,因為維生素和油脂之間尺寸差異非常小,而兩個類似尺寸的脂質(zhì)體需要克服水在其中的排斥力。
我們再看看細(xì)胞中各種尺寸的細(xì)胞器融合,都不是無緣無故自發(fā)產(chǎn)生,都是依靠“外力”作用。
Biomolecules 2023, 13(7), 1130; https://doi.org/10.3390/biom13071130
比如細(xì)胞中囊泡運輸,需要依靠SNARE的作用,即囊泡上SNARE蛋白和靶向的膜上的t-SNAREs(target-menbrance)形成復(fù)合卷曲,這個卷曲叫做SNARE復(fù)合物,然后構(gòu)型的改變排開水分子,形成融合的膜(像個拉鏈一起)。
LNP和Lipo2000、PEI轉(zhuǎn)染試劑有何區(qū)別?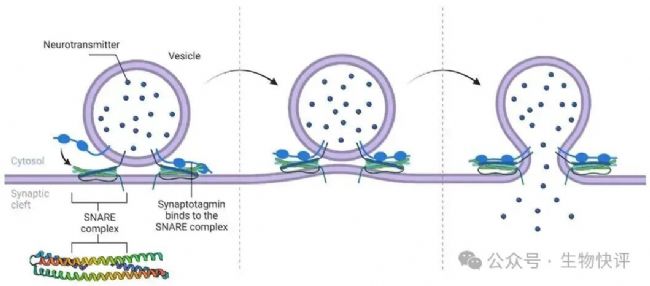
Lipofectamine™ 2000 Transfection Reagent和PEI試劑
Lipofectamine 2000 其成分是商業(yè)秘密,但是從原理來看是一種陽離子脂質(zhì)體混合物,其主要成分很可能包括:這些脂質(zhì)帶正電,可以與帶負(fù)電的DNA或RNA分子自發(fā)結(jié)合,形成穩(wěn)定的“脂質(zhì)-DNA/RNA復(fù)合物”(也稱為“脂質(zhì)納米顆粒”的早期形式)。這能保護(hù)核酸不被降解,并幫助其穿過細(xì)胞膜。
我們知道這種脂質(zhì)體轉(zhuǎn)染原代細(xì)胞困難,大概率這些Lipofectamine 2000缺少兩個關(guān)鍵原因:第一就是他們非pH下降依賴的電離,所以導(dǎo)致了DNA難以從脂質(zhì)體中逃逸進(jìn)入細(xì)胞質(zhì),第二就是他們?nèi)鄙侔邢颍◤某杀緛碚f,肯定無靶向抗體偶聯(lián))。總結(jié)一下,Lipofectamine 2000是初代的脂質(zhì)體。
PEI 聚乙烯亞胺是歷史上繼多聚賴氨酸之后發(fā)現(xiàn)的第二種聚合物轉(zhuǎn)染試劑。PEI能將DNA縮合成帶正電荷的微粒,這些微粒可以黏合到帶有負(fù)電荷的細(xì)胞表面殘基,并通過胞吞作用進(jìn)入細(xì)胞。一旦進(jìn)入細(xì)胞,胺的質(zhì)子化導(dǎo)致反離子大量涌入以及滲透勢降低。上述變化導(dǎo)致的滲透膨脹使囊泡釋放聚合物與DNA形成的復(fù)合物(polyplex)進(jìn)入細(xì)胞質(zhì)。復(fù)合物拆解后,DNA就能自由的融合到細(xì)胞核中。所以這類不屬于脂質(zhì)體,是非脂質(zhì)體形式的大分子聚合物。
LNP是什么?他怎么就可以和細(xì)胞融合呢?以LNP-mRNA技術(shù)為例:脂質(zhì)體是5組分居多,可電離的陽離子脂質(zhì)體(核心),輔助脂質(zhì),膽固醇和PEG,核酸材料(需要遞送的東西),注意這里可電離的陽離子脂質(zhì)體是主要在脂質(zhì)中包裹帶有負(fù)電的核酸物質(zhì)。
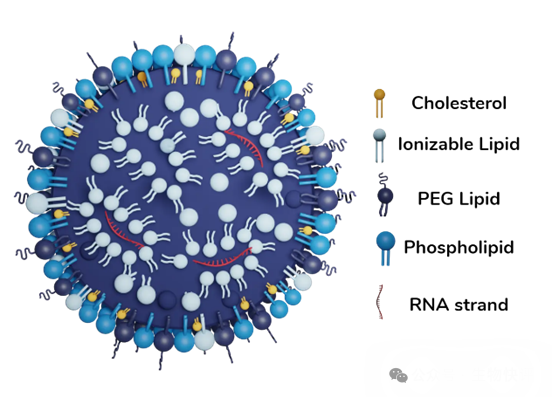
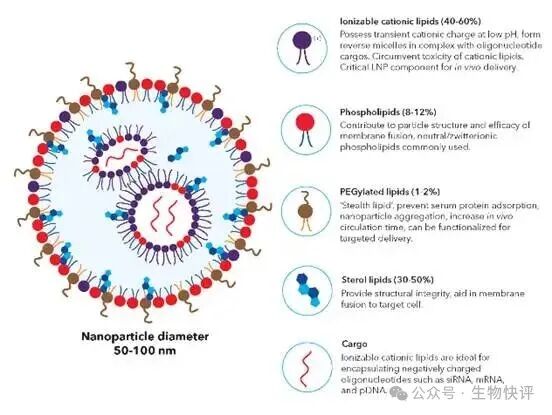
如果是這種無靶向的脂質(zhì)體,那么它注射進(jìn)入人體,就是依靠“被動”進(jìn)入。比如LNP-mNRA疫苗就是依靠肌肉注射,然后被皮下的樹突狀細(xì)胞DC細(xì)胞或者朗格漢斯細(xì)胞攝入,樹突狀細(xì)胞依靠自己的特殊機(jī)制,天然可以“吞噬”體液循環(huán)中的顆粒狀物質(zhì),然后呈遞給T細(xì)胞檢測,讓T細(xì)胞來判讀這個物質(zhì)是自己的還是敵人的殘骸,那么這個就是mRNA的核心機(jī)制。
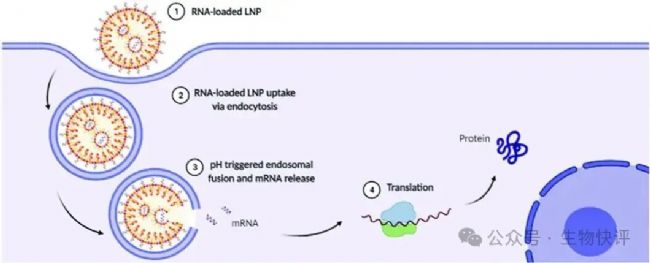
DOI:10.1080/17425247.2022.2135502
如圖所示,吞噬進(jìn)入細(xì)胞內(nèi)的LNP顆粒進(jìn)入到endosome中,然后endosome的pH在質(zhì)子泵的作用下,泵進(jìn)入H+導(dǎo)致endosome的pH下降,然后陽離子脂質(zhì)體開始在這個低pH的環(huán)境下電離而帶電荷,導(dǎo)致脂質(zhì)體膜結(jié)構(gòu)互相排斥而不穩(wěn)定,這樣里面的核酸物質(zhì)就會從脂質(zhì)體中釋放到endosome中了,最后可能1%~4%mRNA逃逸出endosome進(jìn)入細(xì)胞質(zhì),然后mRNA結(jié)合上胞質(zhì)中的核糖體開始編碼蛋白質(zhì)。
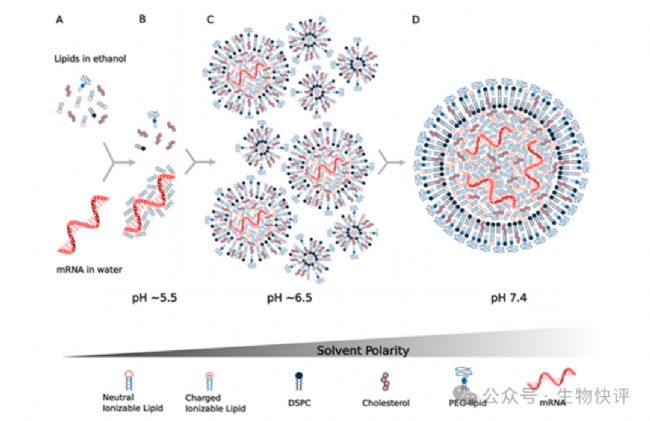
脂質(zhì)體的形成
隨著新冠mRNA疫苗,讓大家看到了LNP-mRNA技術(shù)的優(yōu)點,開始有人想是否可以用LNP來靶向遞送?就是遞送到不具有吞噬攝取能力的細(xì)胞上,比如T細(xì)胞。
如果不加靶向的LNP容易富集到肝臟部位,如果你的靶標(biāo)剛好是肝臟那沒問題,如果不是,則會造成LNP的脫靶向。比如經(jīng)典的ALC0315脂質(zhì)體(BNT162b2遞送新冠疫苗的脂質(zhì)體)和D-Lin-MC3-DMA(Onpattro® ,Patisiran),MC3 是首個獲批的 siRNA 藥物Patisiran 的 LNP 遞送系統(tǒng)的關(guān)鍵脂質(zhì)成分。它負(fù)責(zé)將 siRNA 精準(zhǔn)遞送到肝細(xì)胞,用于治療遺傳性轉(zhuǎn)甲狀腺素蛋白淀粉樣變性(hATTR)。
LNP in vivo CAR-T是什么??
在in vivo CAR-T的研發(fā)目標(biāo)之一就需要減少肝靶向,其次就是重靶向(retargeting)問題,比如靶向T細(xì)胞制備CAR-T。
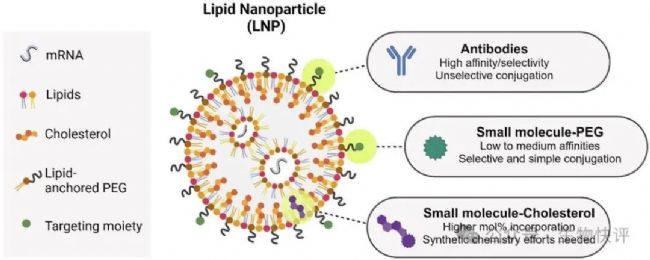
https://doi.org/10.3389/fimmu.2023.1294929
解決辦法有兩個:
第一是對脂質(zhì)體的化學(xué)成分進(jìn)行改造,減少肝靶向。第二脂質(zhì)體偶聯(lián)靶向抗體,比如CD3\CD5\CD7\CD8靶向抗體,通過LNP含有靶向抗體,然后結(jié)合這個靶向抗體后,細(xì)胞通過這個CD3\CD5\CD7\CD8等受體內(nèi)吞LNP復(fù)合物。
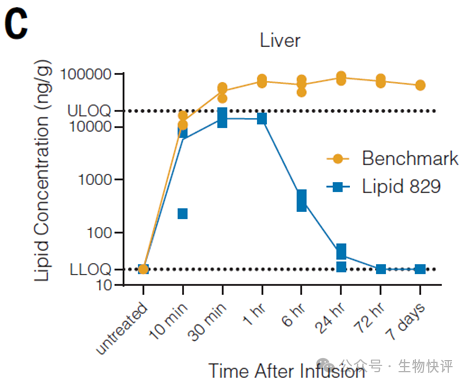
第一個方向比如Capstan研發(fā)的Lipid 829在肝富集問題,顯著比benchmark(ALC0315 (BNT162b2))少(Hunter TL, Bao Y, Zhang Y, et al. In vivo CAR T cell generation to treat cancer and autoimmune disease. Science. 2025;388(6753):1311-1317. doi:10.1126/science.ads8473)。
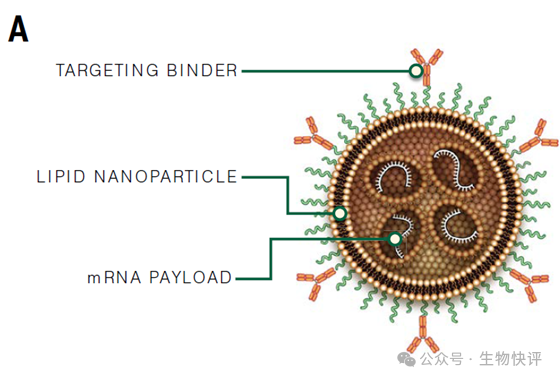
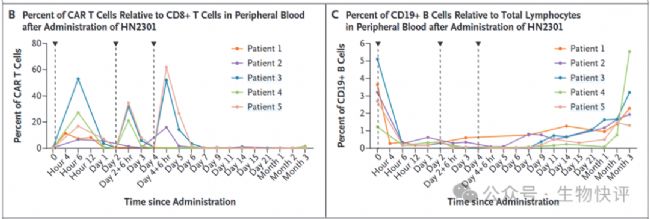
第二個方向,比如025年9月,虹信生物(MagicRNA)在新英格蘭醫(yī)學(xué)雜志(The New England Journal of Medicine)上全球首次公布了基于mRNA-LNP的In vivo CAR T候選藥物HN2301在系統(tǒng)性紅斑狼瘡(SLE)病人的臨床試驗研究數(shù)據(jù),論文題為“In vivo CD19-CAR T-Cell Therapy for Refractory Systemic Lupus Erythematosus”。技術(shù)上通過液相微流控技術(shù)制備形成LNP-mRNA后,再次通過化學(xué)偶聯(lián)CD8-VHH抗體。結(jié)果上通過靜脈按照2mg/kg~4mg/kg給藥可以達(dá)到20%-60% CAR-T生成(6h后),24小時后B細(xì)胞急劇下降。
另外一個重靶向的思路是:不是直接將靶向抗體直接化學(xué)偶聯(lián)在LNP上,而是依靠一個連接用雙特異抗體,讓抗體的一端靶向LNP上的PEG分子,另一端靶向靶細(xì)胞分子(比如CD3 T)。目前菲鵬和Robert Alexander Wesselhoeft(Alex)博士共同創(chuàng)立的Mote Therapeutics(簡稱MOTE)是一家新一代RNA療法公司,該公司的核心技術(shù)平臺MOBILIZ是一種模塊化、可擴(kuò)展、無需化學(xué)反應(yīng)的LNP功能化系統(tǒng),具備高效且特異的細(xì)胞靶向遞送性能。他們的創(chuàng)新在于他們開發(fā)了一個靶向PEG的抗體,因為PEG不是蛋白質(zhì),而是一種大分子聚合物,類似半抗原,比較難以研發(fā)針對PEG的抗體。
LNP in vivo CAR-T在治療自勉疾病效果如何?我們直接看近期的1個臨床文章,看看LNP in vivo CAR-T在臨床上表現(xiàn)如何:

2025年9月,虹信生物(MagicRNA)在新英格蘭醫(yī)學(xué)雜志(The New England Journal of Medicine)上全球首次公布了基于mRNA-LNP的In vivo CAR T候選藥物HN2301在系統(tǒng)性紅斑狼瘡(SLE)病人的臨床試驗研究數(shù)據(jù),論文題為“In vivo CD19-CAR T-Cell Therapy for Refractory Systemic Lupus Erythematosus”。通過虹信生物工程化細(xì)胞靶向平臺(EnC-LNP)開發(fā)新型靶向CD8的脂質(zhì)納米顆粒遞送編碼CD19 CAR的mRNA(HN2301),在SLE病人中首次實現(xiàn)了CAR T細(xì)胞重編程、B細(xì)胞清除,同時觀察到了良好的安全性以及初步的臨床療效。該論文的發(fā)表宣告mRNA-LNP路徑的In vivo CAR T正式進(jìn)入臨床研究階段,并且在人體上首次獲得了臨床驗證。
給藥前無需清淋處理,首先使用低劑量(2mg/dose)進(jìn)行了單次給藥,首次輸注HN2301前一周內(nèi)停用免疫抑制藥物,給藥后患者出現(xiàn)了一過性的發(fā)熱,并且伴隨著CAR T細(xì)胞的生成。給藥后6h監(jiān)測到外周血中CAR T達(dá)到10%,以及外周B細(xì)胞水平降低至給藥前10%。
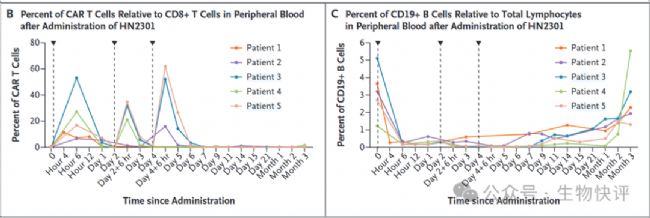
安全性方面:CAR在非CD8+ 的T細(xì)胞上脫靶表達(dá)小于10%。所有3例中劑量患者在第一次給藥后均出現(xiàn)1級CRS,這與CRP和IL-6水平升高相關(guān),3例患者均接受了單劑量tocilizumab治療。值得注意的是,肝酶,包括天冬氨酸轉(zhuǎn)氨酶(AST)和丙氨酸轉(zhuǎn)氨酶(ALT),在觀察期間保持正常范圍。除短暫性淋巴細(xì)胞減少外,未見明顯的血液異常。此外,在治療期間或治療后未觀察到神經(jīng)毒性作用或其他嚴(yán)重不良事件。
評價:LNP-mRNA體內(nèi)生成CAR-T清除B細(xì)胞來治療自免疾病是非常有前景的:1)他解決了CAR-T費用高問題,以后治療自免疾病可能比疫苗貴不了多少,費用和抗體藥物類似,但是僅僅需要一針即可。2)其次安全性高,不涉及到基因編輯和慢病毒插入導(dǎo)致的遺傳物質(zhì)改變。3)最后CAR-T生成快,B細(xì)胞清除迅速,緩解癥狀快速。
最大的待觀察點:B細(xì)胞清除的深度是否足夠,再生的B細(xì)胞依然具有緩慢發(fā)病的可能。
- Th1細(xì)胞極化因子的核心網(wǎng)絡(luò)與信號機(jī)制及在自身免疫病理中的雙重作用
- 干細(xì)胞和免疫細(xì)胞在來源、功能、臨床應(yīng)用上的區(qū)別與共同點
- 組織保存液的作用、特性、使用方法及在科研實驗中的應(yīng)用
- Nature文章分享:警示PD-1療法可能以犧牲長期免疫力換取短期療效
- IL-4/IL-21/IL-10/BAFF等B細(xì)胞極化因子的作用機(jī)制及在疾病中的應(yīng)用
- 大鼠小膠質(zhì)細(xì)胞提取與分選攻略
- 人/小鼠CD8+ T細(xì)胞分選試劑盒特點及驗證數(shù)據(jù)
- IL-10細(xì)胞因子的信號通路、調(diào)控機(jī)制及在自身免疫性疾病治療中的應(yīng)用






