LNP介導的體內CAR-T實現對殺傷性T細胞的靶向遞送進而識別清除B細胞
邁向非病毒細胞治療的新階段:LNP介導的體內CAR-T
文章來源于公眾號:大魚科學 作者:大魚科學
早期嘗試在體內生成CAR-T細胞主要依賴病毒載體進行基因遞送。然而,病毒介導的轉基因方法,在安全性、可控性和公眾接受度上均面臨挑戰。實現“像接種疫苗一樣接受CAR-T治療”的理想模式,仍需更安全、高效的遞送系統。如今,一項基于脂質納米顆粒(LNP)的研究為該概念提供了初步的臨床驗證。
1、全國LNP助力體內基因改造
這項最新發表的研究,采用了脂質納米顆粒(LNP)作為基因遞送系統,以在體內直接對T細胞進行遺傳修飾(圖1)。LNP最初廣泛應用于mRNA疫苗(如抗新冠疫苗)。本研究則在其表面修飾特異性抗體(抗CD8抗體),以實現對殺傷性T細胞的靶向遞送,進而賦予其識別并清除B細胞的能力。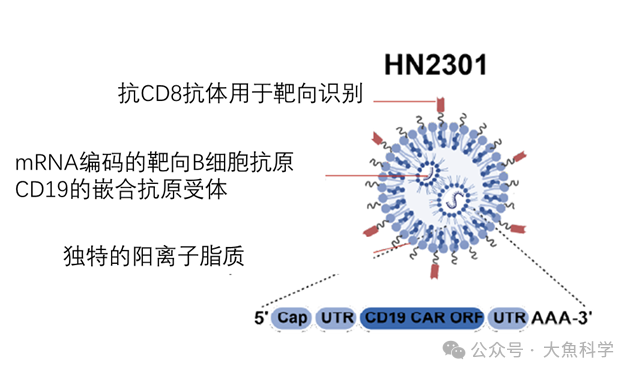
圖1. HN2301脂質納米顆粒(LNP)的示意圖。
2、重復給藥策略
與病毒載體介導的永久性遺傳改造不同,LNP遞送mRNA只能實現瞬時轉基因表達,CAR-T細胞存在時間較短。因此,研究采用了多次注射方案:每兩天給藥一次,共計三劑(圖2)。特別的,該方案無需進行傳統的淋巴細胞清除預處理,也避免了自體或異體CAR-T療法中復雜的細胞制備步驟。
顯著的B細胞清除可持續十幾天至一個月左右(圖2B),但其持久性仍顯著低于報道的自體CAR-T產品。值得注意的是,在輸注后6小時即可觀察到顯著的B細胞減少,而自體CAR-T往往需要經過大量擴增之后才能體現出效果,提示體內制造CAR-T細胞可能具有及時、快速殺傷作用;當然,該現象也可能與淋巴細胞計數的總體下降有關,而此時白細胞數量保持穩定或甚至略有升高。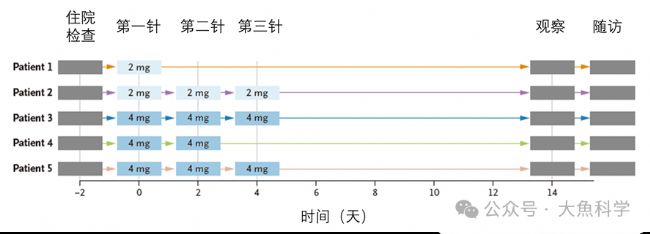
圖2. LNP注射的時間方案。
3、短暫的B細胞清除
轉基因效率相當不錯。特別是在高劑量組(患者3與患者5)中,CAR陽性細胞占CD8⁺ T細胞的比例最高可達60%。然而與病毒載體不同,CAR表達持續時間較短,通常僅約2天(圖3A)。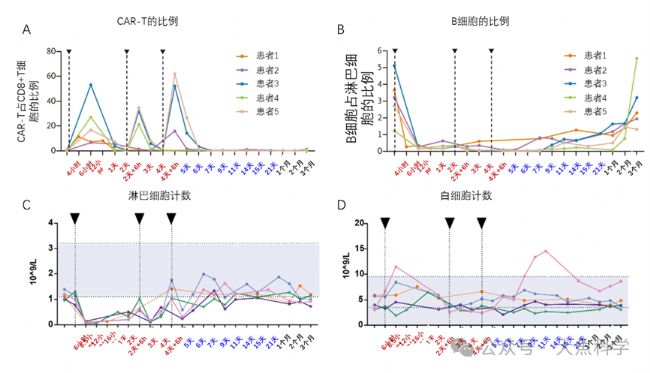
圖3. (A)CAR-T的比例;(B)B細胞占淋巴細胞的比例;(C)淋巴細胞技術在第一次輸注后迅速下降;(3)白細胞計數維持相對穩定。黑色三角形代表注射的時間點。
4、干擾素釋放和抗DNA抗體
干擾素γ(IFNγ)是細胞免疫應答的關鍵指標。在天然情況下,T細胞的激活和殺傷,需要比較長的一段時間。有趣的是,該研究中的IFNγ釋放峰值在第一次注射之后迅速出現(圖3A),與B細胞的迅速減少相一致。
盡管所有患者的臨床癥狀均得到相當程度的緩解,其抗雙鏈DNA抗體水平在短暫下降后再次升高(圖4B),提示B細胞的清除和免疫重建并可能并不徹底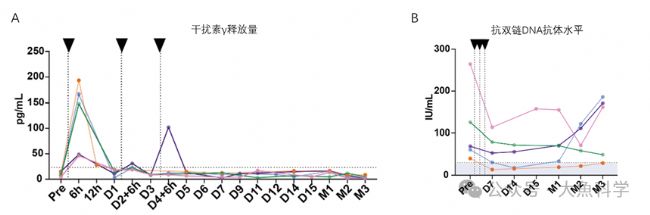
圖4. 干擾素釋放量和抗雙鏈DNA抗體的水平。
基于LNP技術在體內生成CAR-T細胞的首次臨床研究,初步驗證了該策略的安全性與有效性,為利用體內制備CAR-T治療自身免疫疾病提供了新的技術路徑。然而,該方法能否實現最大程度的B細胞清除,并最終替代體外制備的CAR-T療法,并克服遺傳因素,實現長時間的疾病控制,目前仍不確定。
從基因的體內遞送到B細胞清除的生物學過程中,大量未知機制仍有待闡明。劑量優化或許可為進一步提升療效提供方向;但深入研究體內CAR-T生成過程中T細胞的激活、殺傷及擴增等的基本生物學規律,也將為更好的理解控制這一技術,提供額外的思路。






