生物制藥工藝強化:端到端連續流工藝解析
生物制藥工藝強化(Process Intensification, PI)已從概念探索階段邁入工業化實施的關鍵時期,其終極目標被廣泛認同為:建立一個高度整合、無縫銜接的端到端(End-to-End)連續流工藝。這一目標代表著對傳統批次生產模式的根本性顛覆,旨在解鎖生物制藥制造的效率、靈活性與質量潛能。
傳統批次工藝的局限性
傳統批次工藝的核心痛點在于其固有的“離散”特性。上游的批次/補料批次培養與下游的間歇純化單元之間存在著物理和時間上的割裂。
規模放大悖論: 為追求高產量而擴大設備規模(如反應器體積、層析柱尺寸),顯著增加資本支出和運營成本,同時復雜化了工藝驗證與廠房設施要求。
動態不一致性: 各單元操作在時間、空間上的分離,使中間產物經歷了非受控的滯留與條件波動(如產物降解、聚集風險增加),威脅最終產品質量屬性的批內與批間一致性。
資源利用低效: 設備在批次切換、清洗、滅菌及等待過程中大量閑置,整體設備利用率低下,產能彈性受限。
連續流工藝通過將生產流程組織成一系列相互連接、持續運行的單元操作,使物料(細胞、產物、緩沖液)連續、持續通過整個系統(從種子擴增到最終制劑),從而在根本上解決上述痛點。
端到端連續流工藝:整合的力量
端到端連續流工藝的核心在于以“連續”和“整合”為原則。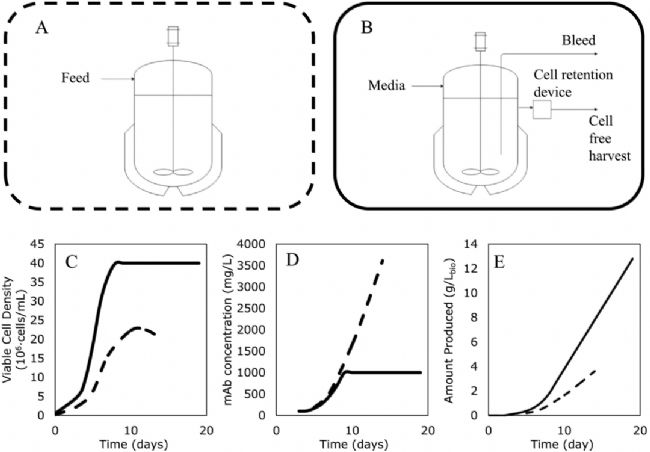 生產 mAb 的細胞系的補料分批 (A) 和灌注 (B) 過程示意圖。細胞密度 (C)、生物反應器內的蛋白質濃度(D) 和總生產率 (E);虛線代表補料分批,實線代表灌注。[1]
生產 mAb 的細胞系的補料分批 (A) 和灌注 (B) 過程示意圖。細胞密度 (C)、生物反應器內的蛋白質濃度(D) 和總生產率 (E);虛線代表補料分批,實線代表灌注。[1]
種子擴增工藝: 結合一次性生物反應器和基于灌注的N-1種子擴增策略,實現快速、穩健的種子供應,與生產反應器高效銜接。
連續精純與制劑: 整合連續流超濾/透析(TFF)、多柱層析精純步驟以及在線稀釋、混合、灌裝技術。這不僅縮小設備規模,更關鍵的是減少了中間產物的暫存時間,最大限度降低降解風險,保障產品關鍵質量屬性(CQAs)的穩定性。
關鍵挑戰與應對策略
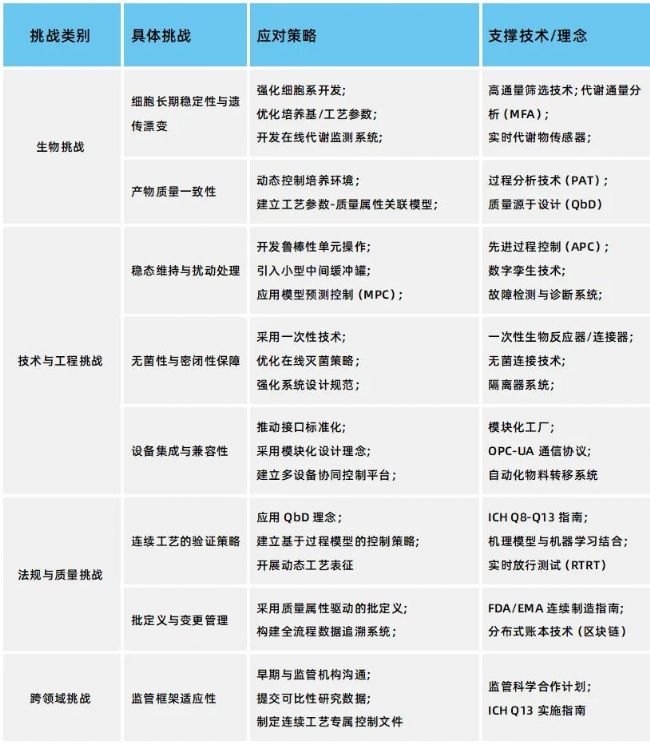 端到端連續流生物工藝的核心戰略價值在于通過全流程的整合與連續化運作,實現顯著的設備與設施小型化、產品質量與一致性提升、生產靈活性與供應鏈韌性增強,以及資源利用效率與可持續性優化。
端到端連續流生物工藝的核心戰略價值在于通過全流程的整合與連續化運作,實現顯著的設備與設施小型化、產品質量與一致性提升、生產靈活性與供應鏈韌性增強,以及資源利用效率與可持續性優化。

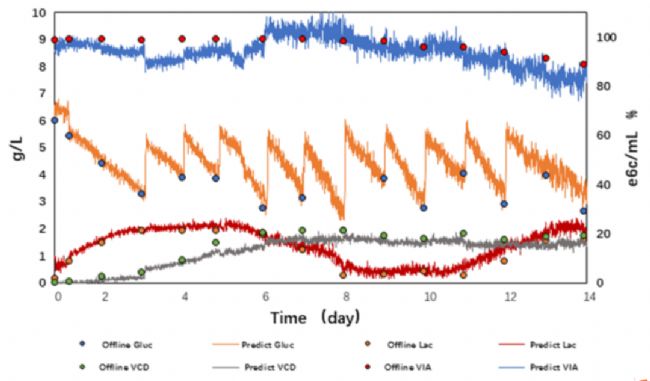
Akwa® PAT在線過程分析系統
Akwa® PAT是由浚真生命科學自主研發的用于關鍵工藝參數(CPP)和關鍵質量參數(CQA)持續監測和優化的在線過程分析系統。包括Akwa®Cyte在線細胞傳感器 、Akwa®Raman在線拉曼分析儀和Akwa®UV在線純化和分離過程分析系統,助力生物藥企通過先進的PAT技術確保產品質量及一致性,從而減少浪費、降本增效、實現高效工藝和技術轉移。

 端到端連續流工藝從根本上保障了藥品供應的安全性和韌性,推動生物制藥工藝向“數智4.0”轉型升級,驅動行業其向著更高效、靈活、敏捷、高質量和可持續的未來堅定邁進。這場革命終將加速創新生物藥的開發與可及,惠及全球患者。
端到端連續流工藝從根本上保障了藥品供應的安全性和韌性,推動生物制藥工藝向“數智4.0”轉型升級,驅動行業其向著更高效、靈活、敏捷、高質量和可持續的未來堅定邁進。這場革命終將加速創新生物藥的開發與可及,惠及全球患者。
參考資料:
[1]Bielser, J.-M., Wolf, M., Souquet, J., Broly, H., & Morbidelli, M. (2018). Perfusion mammalian cell culture for recombinant protein manufacturing – A critical review. Biotechnology Advances, *36*(4), 1328–1340.
傳統批次工藝的局限性
傳統批次工藝的核心痛點在于其固有的“離散”特性。上游的批次/補料批次培養與下游的間歇純化單元之間存在著物理和時間上的割裂。
規模放大悖論: 為追求高產量而擴大設備規模(如反應器體積、層析柱尺寸),顯著增加資本支出和運營成本,同時復雜化了工藝驗證與廠房設施要求。
動態不一致性: 各單元操作在時間、空間上的分離,使中間產物經歷了非受控的滯留與條件波動(如產物降解、聚集風險增加),威脅最終產品質量屬性的批內與批間一致性。
資源利用低效: 設備在批次切換、清洗、滅菌及等待過程中大量閑置,整體設備利用率低下,產能彈性受限。
連續流工藝通過將生產流程組織成一系列相互連接、持續運行的單元操作,使物料(細胞、產物、緩沖液)連續、持續通過整個系統(從種子擴增到最終制劑),從而在根本上解決上述痛點。
端到端連續流工藝:整合的力量
端到端連續流工藝的核心在于以“連續”和“整合”為原則。
- 連續上游生產

種子擴增工藝: 結合一次性生物反應器和基于灌注的N-1種子擴增策略,實現快速、穩健的種子供應,與生產反應器高效銜接。
- 連續下游純化
連續精純與制劑: 整合連續流超濾/透析(TFF)、多柱層析精純步驟以及在線稀釋、混合、灌裝技術。這不僅縮小設備規模,更關鍵的是減少了中間產物的暫存時間,最大限度降低降解風險,保障產品關鍵質量屬性(CQAs)的穩定性。
- 過程分析技術 (PAT)與自動化控制
- 整合平臺與數字化管理
關鍵挑戰與應對策略


Akwa® PAT在線過程分析系統
Akwa® PAT是由浚真生命科學自主研發的用于關鍵工藝參數(CPP)和關鍵質量參數(CQA)持續監測和優化的在線過程分析系統。包括Akwa®Cyte在線細胞傳感器 、Akwa®Raman在線拉曼分析儀和Akwa®UV在線純化和分離過程分析系統,助力生物藥企通過先進的PAT技術確保產品質量及一致性,從而減少浪費、降本增效、實現高效工藝和技術轉移。


參考資料:
[1]Bielser, J.-M., Wolf, M., Souquet, J., Broly, H., & Morbidelli, M. (2018). Perfusion mammalian cell culture for recombinant protein manufacturing – A critical review. Biotechnology Advances, *36*(4), 1328–1340.

Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com






