Tg´調控助力冷不穩定蛋白凍干后活性提升90%
冷不穩定蛋白的誤解與真相
冷不穩定蛋白的誤解澄清:眾多被貼上“冷不穩定”標簽的蛋白,實則并非本質上的不穩定,其活性損失往往源于不當的儲存條件。例如,在-20°C標準冷凍條件下,凍濃縮效應而非蛋白本身的不穩定性是活性喪失的主要原因。
凍濃縮效應:凍干過程中,水分子形成冰晶,導致溶液中溶質濃度升高,從而損害蛋白結構。這種現象不僅影響普通蛋白,也會影響所謂的“冷不穩定”蛋白。
參考資料:關于凍濃縮和低溫與凍結差異的詳細信息可參考taPrime Consulting發布的《Freezing Primer》文檔。
蛋白質在不同溫度下的行為
加熱與冷卻效應對比:加熱過程中,蛋白質會發生變性、結構展開乃至聚集,這一變化類似于煮雞蛋時蛋白的凝固現象。

這一過程可以用熱力學解釋,例如胰凝乳蛋白酶原在升溫時自由能變化(ΔG)逐漸減小,當ΔG < 0 kJ mol⁻¹時,蛋白開始展開。
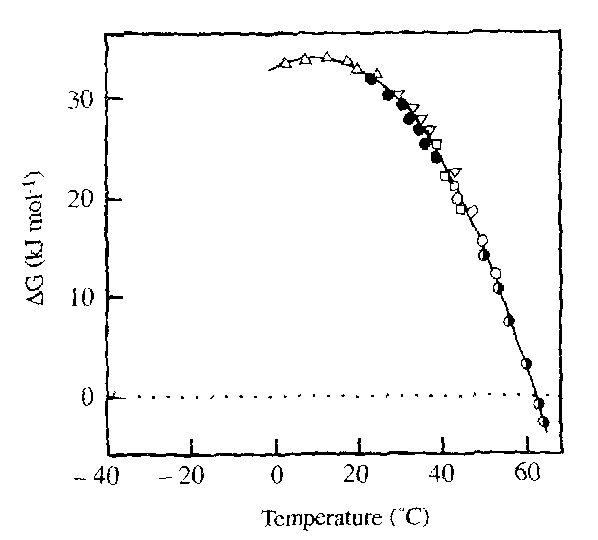
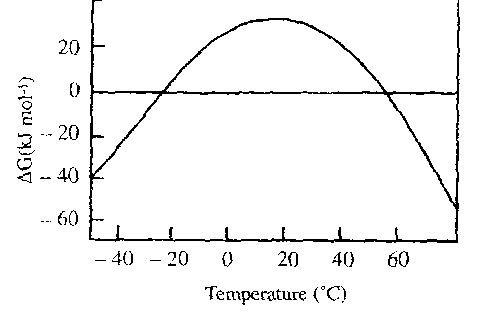
低溫變性的特點:與高溫變性不同,低溫變性通常不會導致聚集,且是可逆的。這是由于低溫下水的離子化程度顯著降低(Kw值從20°C時的10⁻¹⁴降至-20°C時的10⁻¹⁷),使得水更“疏水”,能夠溶解未折疊狀態的蛋白。
研究實例:Franks和Hatley利用過冷技術(將水冷卻至低于0°C而不結冰)研究乳酸脫氫酶(LDH),發現低溫會導致蛋白展開,但該過程完全可逆。
凍干過程中的蛋白穩定性
凍干前的蛋白狀態:若蛋白在溶液達到玻璃化轉變溫度前展開,凍干過程中將保持其未折疊狀態。這會導致復溶困難,因為常溫水(15-20°C)具有更高的離子化能力,無法有效溶解未折疊狀態的蛋白。
實際案例:作者曾遇到一個客戶的產品復溶時間長達5~6分鐘,初步判斷是Tg´與初級干燥溫度不匹配所致。然而,調整工藝后復溶時間反而延長至10~15分鐘。進一步實驗表明,當Tg´高于-15至-13°C時,復溶速度較快;低于此范圍則復溶時間不可接受。推測客戶的蛋白在玻璃化前已展開并被固定在變性狀態。
解決方案與建議
測試方法:對于懷疑冷不穩定的蛋白,首先應測試活性損失是否由凍濃縮引起。制備Tg´分別為-10°C和-30°C的測試配方,將其在-20°C冰箱中存放一夜,然后解凍觀察活性。若-10°C配方活性明顯優于-30°C配方,則說明凍濃縮是主要原因。
優化策略:即使蛋白在異常高溫下發生低溫變性,仍可能適合凍干。在設計冷凍干燥工藝時,制備一系列不同Tg´值的測試配方,并在相同實驗條件下進行凍干。通過評估凍干過程中的關鍵質量屬性,如殘余水分、復溶時間、外觀等,結合Tg´值,繪制性能與Tg´的關系圖,從而確定最佳Tg´值。
商業價值:上述方法不僅能幫助識別低溫變性發生的臨界點,還能為目標產品的商業化提供指導,避免資源浪費。
結論與啟示
結論:冷不穩定蛋白的活性損失往往源于凍濃縮而非真正的低溫敏感性。通過合理設計凍干工藝,大多數蛋白仍可成功凍干。
啟示:許多研究人員可能因誤判而放棄凍干技術。事實上,只要掌握正確的測試和優化方法,即使是復雜的蛋白體系也能實現高效凍干。
參考文獻
Franks, F. Biophysical Chemistry 96 117-127 (2002).
Brandts, J.F. J. Amer. Chem. Soc. 86 4291-4303 (1964).
Franks, F and Hatley R.H.M. Pure & Appl. Chem. 63 1367-1380 (1991).
Hatley, R.H.M and Franks, F. Eur. J. Biochem. 184 237-240 (1989).
冷不穩定蛋白的誤解澄清:眾多被貼上“冷不穩定”標簽的蛋白,實則并非本質上的不穩定,其活性損失往往源于不當的儲存條件。例如,在-20°C標準冷凍條件下,凍濃縮效應而非蛋白本身的不穩定性是活性喪失的主要原因。
凍濃縮效應:凍干過程中,水分子形成冰晶,導致溶液中溶質濃度升高,從而損害蛋白結構。這種現象不僅影響普通蛋白,也會影響所謂的“冷不穩定”蛋白。
參考資料:關于凍濃縮和低溫與凍結差異的詳細信息可參考taPrime Consulting發布的《Freezing Primer》文檔。
蛋白質在不同溫度下的行為
加熱與冷卻效應對比:加熱過程中,蛋白質會發生變性、結構展開乃至聚集,這一變化類似于煮雞蛋時蛋白的凝固現象。

這一過程可以用熱力學解釋,例如胰凝乳蛋白酶原在升溫時自由能變化(ΔG)逐漸減小,當ΔG < 0 kJ mol⁻¹時,蛋白開始展開。


低溫變性的特點:與高溫變性不同,低溫變性通常不會導致聚集,且是可逆的。這是由于低溫下水的離子化程度顯著降低(Kw值從20°C時的10⁻¹⁴降至-20°C時的10⁻¹⁷),使得水更“疏水”,能夠溶解未折疊狀態的蛋白。
研究實例:Franks和Hatley利用過冷技術(將水冷卻至低于0°C而不結冰)研究乳酸脫氫酶(LDH),發現低溫會導致蛋白展開,但該過程完全可逆。
凍干過程中的蛋白穩定性
凍干前的蛋白狀態:若蛋白在溶液達到玻璃化轉變溫度前展開,凍干過程中將保持其未折疊狀態。這會導致復溶困難,因為常溫水(15-20°C)具有更高的離子化能力,無法有效溶解未折疊狀態的蛋白。
實際案例:作者曾遇到一個客戶的產品復溶時間長達5~6分鐘,初步判斷是Tg´與初級干燥溫度不匹配所致。然而,調整工藝后復溶時間反而延長至10~15分鐘。進一步實驗表明,當Tg´高于-15至-13°C時,復溶速度較快;低于此范圍則復溶時間不可接受。推測客戶的蛋白在玻璃化前已展開并被固定在變性狀態。
解決方案與建議
測試方法:對于懷疑冷不穩定的蛋白,首先應測試活性損失是否由凍濃縮引起。制備Tg´分別為-10°C和-30°C的測試配方,將其在-20°C冰箱中存放一夜,然后解凍觀察活性。若-10°C配方活性明顯優于-30°C配方,則說明凍濃縮是主要原因。
優化策略:即使蛋白在異常高溫下發生低溫變性,仍可能適合凍干。在設計冷凍干燥工藝時,制備一系列不同Tg´值的測試配方,并在相同實驗條件下進行凍干。通過評估凍干過程中的關鍵質量屬性,如殘余水分、復溶時間、外觀等,結合Tg´值,繪制性能與Tg´的關系圖,從而確定最佳Tg´值。
商業價值:上述方法不僅能幫助識別低溫變性發生的臨界點,還能為目標產品的商業化提供指導,避免資源浪費。
結論與啟示
結論:冷不穩定蛋白的活性損失往往源于凍濃縮而非真正的低溫敏感性。通過合理設計凍干工藝,大多數蛋白仍可成功凍干。
啟示:許多研究人員可能因誤判而放棄凍干技術。事實上,只要掌握正確的測試和優化方法,即使是復雜的蛋白體系也能實現高效凍干。
參考文獻
Franks, F. Biophysical Chemistry 96 117-127 (2002).
Brandts, J.F. J. Amer. Chem. Soc. 86 4291-4303 (1964).
Franks, F and Hatley R.H.M. Pure & Appl. Chem. 63 1367-1380 (1991).
Hatley, R.H.M and Franks, F. Eur. J. Biochem. 184 237-240 (1989).
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com






