CAR-T技術從機制突破到多領域臨床轉化的全景解析
摘要:
嵌合抗原受體T細胞(CAR-T)治療作為癌癥免疫治療領域的革命性技術,通過基因工程改造T細胞以特異性識別并殺傷靶細胞,已在血液惡性腫瘤治療中取得里程碑式進展,并逐步向實體瘤、自身免疫病等難治性疾病領域拓展。
一、 CAR-T細胞治療的核心機制與技術演化
(一)作用機制
CAR-T細胞的功能實現依賴于合成受體(CAR)介導的特異性識別與信號激活通路,其完整激活過程包含三個關鍵階段:
1. 抗原識別:CAR的單鏈可變片段(scFv)區域與靶細胞表面抗原特異性結合,確保治療的靶向性;
2. 信號轉導:CAR胞內段的CD3ζ鏈免疫受體酪氨酸活化基序(ITAM)啟動磷酸化級聯反應,激活MAPK、PI3K-Akt及NF-κB等下游信號通路;
3. 效應階段:激活后的CAR-T細胞通過穿孔素-顆粒酶途徑或死亡受體介導的凋亡通路殺傷靶細胞,同時分泌IFN-γ等炎癥因子,進一步增強局部免疫應答。
(二)技術演化歷程
CAR-T技術歷經五代迭代,每一代均針對前序版本的缺陷進行核心優化:
第一代(1989年):僅包含CD3ζ信號域,雖能啟動T細胞激活,但缺乏共刺激信號,細胞增殖能力與持久性有限;
第二代(2002年):引入CD28或4-1BB共刺激域,顯著提升CAR-T細胞的體外擴增效率、體內存活時間及殺傷活性;
第三代(2010年):整合雙共刺激域(如CD28+4-1BB),進一步強化信號傳導,增強細胞功能穩定性;
第四代(2015年):新增免疫調節功能模塊,可分泌IL-12、IL-15等細胞因子或表達抗PD-1單鏈可變片段,有效重塑免疫抑制性腫瘤微環境;
第五代(2020年):引入細胞因子受體結構域(如截短的IL-2Rβ鏈)或JAK-STAT信號模塊,實現CAR-T細胞的自主增殖與功能持續激活,同時整合邏輯門控構建體提升治療精準性。
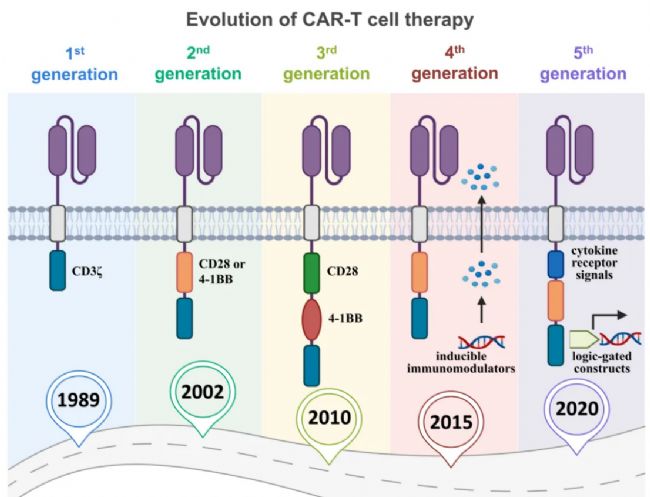
圖1:各代CAR-T細胞療法
二、 CAR-T細胞治療面臨的關鍵挑戰
(一)毒性與安全性問題
CAR-T治療的安全性風險主要包括:細胞因子釋放綜合征(CRS)、免疫效應細胞相關神經毒性綜合征(ICANS)、脫靶毒性及繼發性腫瘤風險。其中,CRS是最常見的急性不良反應,由IL-1、IL-6等炎癥因子大量釋放引發,在CD70-CAR-T臨床試驗中,67%的患者出現CRS,3-4級嚴重反應占3%,嚴重時可導致多器官功能障礙;ICANS表現為意識障礙、癲癇等癥狀,其發生與血腦屏障破壞及炎癥因子浸潤密切相關;脫靶毒性如CD19-CAR-T導致的長期B細胞發育不全,需通過免疫球蛋白替代治療維持患者免疫功能;此外,病毒載體介導的基因整合可能誘發繼發性T細胞惡性腫瘤,限制了治療的長期安全性。
(二)實體瘤治療瓶頸
相較于血液腫瘤,CAR-T細胞在實體瘤治療中療效受限,核心原因包括:
1. 免疫抑制性腫瘤微環境(TME):實體瘤微環境中存在髓源性抑制細胞(MDSC)、調節性T細胞(Treg)等抑制性細胞亞群,同時缺氧、酸中毒等理化條件會直接抑制CAR-T細胞的浸潤與功能;
2. 抗原異質性與逃逸:實體瘤細胞表面靶抗原表達不均一,部分腫瘤細胞可通過下調或丟失靶抗原實現免疫逃逸,導致治療不完全;
3. T細胞耗竭:持續的抗原刺激會誘導CAR-T細胞表達PD-1、CTLA-4等耗竭相關分子,導致細胞增殖能力下降、殺傷活性減弱。
(三)生產與可及性限制
當前CAR-T治療的臨床轉化面臨顯著的生產與成本挑戰:自體CAR-T細胞制備流程復雜,中位制備周期長達108天,且單次治療成本超過40萬美元;此外,41%的淋巴瘤患者因疾病進展迅速,無法在制備周期內接受治療。這些因素嚴重限制了CAR-T治療的普惠性,亟需開發標準化、低成本的生產技術。
三、 CAR-T細胞治療的技術創新進展
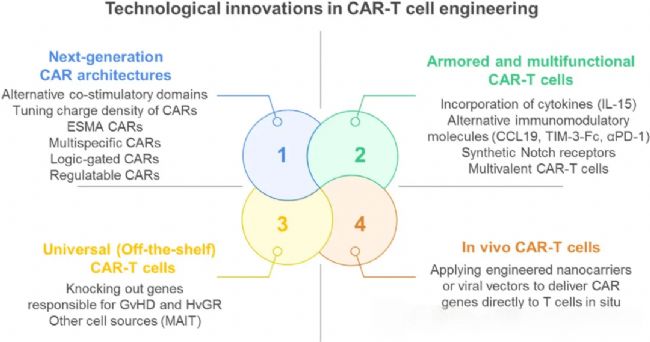
圖2:CAR-T細胞工程中的技術創新
(一)新一代CAR結構優化
為提升治療的精準性與安全性,研究者通過結構設計創新改造CAR分子:
- 信號優化:通過調控CAR胞內段電荷密度降低本底激活信號,增強細胞在體內的適應性; - 內源性信號激活CAR(ESMA-CAR):通過招募內源性信號分子,顯著提升對三陰性乳腺癌等實體瘤的靶向殺傷活性;
- 邏輯門控CAR:如SynNotch受體系統,需同時識別腫瘤細胞表面兩種抗原才能啟動激活,有效降低脫靶毒性,尤其在神經毒性防控方面展現出優勢。
(二)裝甲與多功能CAR-T技術
通過賦予CAR-T細胞額外功能模塊,增強其抗瘤活性與腫瘤微環境適應能力:
細胞因子武裝:分泌IL-15、CCL19等細胞因子的CAR-T細胞,在膠質母細胞瘤模型中展現出更強的腫瘤浸潤能力與長期存活優勢;
多功能設計:如靶向HIV的M10 CAR-T細胞,兼具殺傷感染細胞、中和病毒顆粒及腫瘤歸巢功能,為感染性疾病治療提供了新思路;
抗耗竭工程:通過過表達c-Jun轉錄因子或敲除DGKα基因,可逆轉CAR-T細胞的耗竭表型,恢復其增殖與殺傷功能。
(三)通用型(現貨型)CAR-T技術
通用型CAR-T通過基因編輯技術打破自體細胞治療的局限:利用CRISPR-Cas9技術敲除T細胞受體(TCR)及人類白細胞抗原(HLA)相關基因,顯著降低移植物抗宿主病(GVHD)及宿主抗移植物反應(HvGR)風險;此外,模塊化CAR平臺如ELECTRIC CAR可實現多靶點協同識別,提升對異質性腫瘤的治療效果,同時簡化生產流程,為規模化應用奠定基礎。
(四)體內CAR-T技術
體內CAR-T技術通過納米顆粒或病毒載體直接在體內編程患者自身T細胞,無需體外細胞培養流程,極大簡化了治療環節。該技術的核心優勢在于縮短治療周期、降低生產成本,但目前仍面臨預存免疫反應、基因組編輯安全性及體內劑量控制等挑戰,需進一步優化載體設計與遞送效率。
四、 CAR-T細胞治療的臨床突破
(一)血液惡性腫瘤
CAR-T細胞在血液惡性腫瘤治療中已實現成熟轉化:CD19-CAR-T在兒童及年輕成人復發性/難治性B細胞急性淋巴細胞白血病(B-ALL)的ELIANA臨床試驗中,客觀緩解率(ORR)達82%;針對多發性骨髓瘤的BCMA-CAR-T治療,ORR高達84.6%,雙靶點CAR-T產品GC012F更是實現100%ORR,顯著改善了患者預后。
(二)實體瘤
近年來,實體瘤CAR-T治療取得多項關鍵突破,核心靶點及療效如下:Claudin 18.2靶向CAR-T治療胃癌的ORR達38.8%,治療胰腺癌的疾病控制率(DCR)為70.8%;GD2靶向CAR-T在神經母細胞瘤治療中ORR為60%-63%,3年總體生存率(OS)達60%;GPC3靶向CAR-T治療肝癌的ORR為33%,需通過優化CRS管理提升治療安全性;B7-H3靶向CAR-T經顱內給藥治療彌漫性內生型橋腦膠質瘤(DIPG),將患者中位生存期延長至10.7個月,為中樞神經系統腫瘤治療提供了新策略。
(三)自身免疫病
CAR-T治療已從腫瘤領域拓展至自身免疫病(AID)治療:在系統性紅斑狼瘡患者中,CD19-CAR-T治療實現100%臨床緩解,15例患者均成功停藥并維持緩解狀態;通用型TyU19 CAR-T在免疫性肌病治療中,有效逆轉患者肌無力癥狀及組織纖維化,為自身免疫病的精準治療開辟了新路徑。
五、未來展望與發展方向
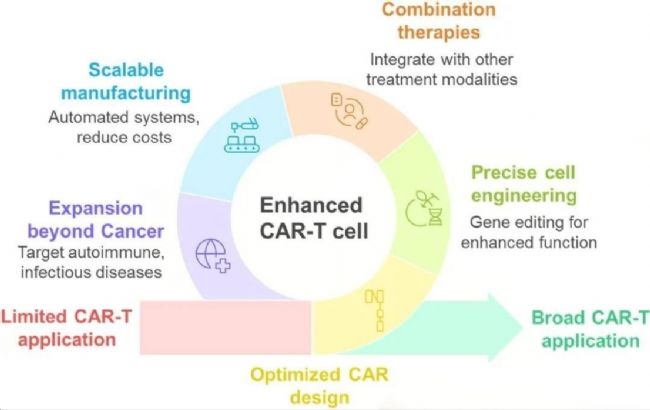
圖3:CAR-T細胞治療的未來前景和潛在策略
(一)CAR設計與細胞工程優化
未來CAR設計將更加注重多功能整合與微環境適應性:開發微環境激活型CAR(如MEAT細胞),僅在腫瘤特異性微環境中啟動激活,進一步降低脫靶風險;整合細胞因子分泌、免疫檢查點調控等多重功能模塊,提升CAR-T細胞在復雜微環境中的存活與殺傷能力。精準基因編輯技術將持續賦能細胞工程,通過CRISPR技術敲除NR4A、CTLA-4等耗竭相關基因,或增強細胞代謝適應性,以抵抗腫瘤微環境的抑制作用。
(二)聯合治療策略
聯合治療是突破CAR-T治療瓶頸的關鍵方向:與免疫檢查點抑制劑(如抗PD-1抗體)聯合使用,可有效逆轉T細胞耗竭;結合溶瘤病毒或STING激動劑,能夠重塑腫瘤微環境,將"冷腫瘤"轉化為"熱腫瘤",增強CAR-T細胞浸潤;此外,CAR-T治療與放療、化療的協同應用,有望進一步提升治療效果,尤其在實體瘤的局部控制方面展現出潛力。
(三)規模化生產與成本控制
為提升CAR-T治療的可及性,規模化生產技術將成為研發重點:自動化生物反應器(如CliniMACS Prodigy)的應用的可標準化生產流程,降低人為誤差;非病毒載體(如轉座子系統)替代傳統病毒載體,可簡化制備工藝并降低生產成本;通用型CAR-T的規模化生產將徹底改變當前自體治療的局限,實現"現貨供應",滿足更多患者的治療需求。
(四)非腫瘤領域應用拓展
CAR-T治療的應用場景正從腫瘤向更多難治性疾病延伸:在感染性疾病領域,靶向HIV感染細胞的M10 CAR-T已展現出抗病毒潛力;在纖維化疾病治療中,抗FAP-CAR-T可有效逆轉肝纖維化,為慢性炎癥相關疾病提供新的治療策略;此外,CAR-T技術在自身免疫病、器官移植排斥反應等領域的應用研究也在持續推進,有望成為多領域疾病治療的通用技術平臺。
六、CAR-T細胞治療科研服務
CAR-T細胞治療作為基因治療與免疫治療的交叉融合技術,已在血液惡性腫瘤治療中確立核心地位,并通過技術創新逐步突破實體瘤、自身免疫病等領域的治療瓶頸。盡管當前仍面臨毒性控制、生產可及性等挑戰,但新一代CAR結構設計、通用型技術、體內工程及聯合治療策略的發展,正推動CAR-T治療向更安全、高效、普惠的方向演進。
科研攻關,檢測先行!LabEx 作為蛋白檢測服務專家,以一站式生物標志物發現平臺為 CAR-T 研究賦能。5000 + 核酸蛋白檢測指標全覆蓋,從單細胞轉錄組、DSP 空間轉錄組到多因子檢測,貫穿 “篩選 - 驗證 - 應用” 全流程,滿足 CAR-T 機制探索、毒性監測、療效標志物篩選等多元需求。
依托 30 + 專業檢測平臺,累計服務 3000 + 客戶、檢測 100 萬 + 樣本的成熟經驗,LabEx 可提供高靈敏度、高重復性的數據支撐,搭配專業數據分析團隊,助力解析 CAR-T 細胞激活、腫瘤微環境調控等核心科學問題。從基礎研究到臨床轉化,LabEx 全程護航,讓科研方向更清晰、成果轉化更高效!
選擇 LabEx,以精準檢測賦能 CAR-T 技術迭代,共繪精準醫療新藍圖!
樂備實是國內專注于提供高質量蛋白檢測以及組學分析服務的實驗服務專家,自2018年成立以來,樂備實不斷尋求突破,公司的服務技術平臺已擴展到單細胞測序、空間多組學、流式檢測、超敏電化學發光、Luminex多因子檢測、抗體芯片、PCR Array、ELISA、Elispot、PLA蛋白互作、多色免疫組化、DSP空間多組學等30多個,建立起了一套涵蓋基因、蛋白、細胞以及組織水平實驗的完整檢測體系。






