抗體偶聯藥物(ADC)領域2024-2025年重大事件梳理
文章來源公眾號:Derek工作室 作者:Derek工作室
2024年抗體偶聯藥物(ADC)領域重大事件
2024年1月:FDA批準Enhertu進軍子宮內膜癌,創下歷史
美國食品藥品監督管理局(FDA)于2024年1月完全批準阿斯利康和第一三共的Enhertu(fam-trastuzumab deruxtecan-nxki)用于治療既往接受過系統性治療的HER2陽性(IHC 3+)子宮內膜癌成人患者,此舉標志著Enhertu成功開拓了繼乳腺癌、胃癌和肺癌之后的第四個癌種,并成為該領域首個靶向HER2的ADC藥物。
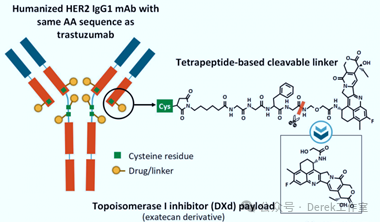
輝瑞ADC藥物Disitamab Vedotin獲FDA優先審評
FDA于2024年1月授予了輝瑞(Pfizer)的ADC藥物Disitamab Vedotin針對表達HER2的尿路上皮癌的優先審評資格,并為其設定了2024年第二季度作為處方藥用戶付費法案(PDUFA)的目標行動日期,加速了該藥物的上市進程。
2024年2月:Enhertu獲FDA批準用于HER2突變非小細胞肺癌
2024年2月,FDA批準了阿斯利康和第一三共的Enhertu用于治療既往接受過治療的HER2突變(激活突變)的不可切除或轉移性非小細胞肺癌(NSCLC)成人患者,該項批準基于DESTINY-Lung02試驗的積極結果,是Enhertu在肺癌治療領域的又一重大進展。
吉利德Trodelvy乳腺癌適應癥在歐盟獲批
歐盟委員會(EC)于2024年2月批準了吉利德(Gilead)的ADC藥物Trodelvy(sacituzumab govitecan)用于治療既往接受過內分泌治療和至少兩種系統性治療的HR陽性、HER2陰性的不可切除或轉移性乳腺癌成人患者,擴大了該藥物在全球的應用范圍。

2024年3月:第一三共HER3-DXd公布肺癌最新數據
在2024年3月舉辦的歐洲肺癌大會(ELCC)上,第一三共公布了其針對HER3的ADC藥物Patritumab deruxtecan(HER3-DXd)在EGFR突變非小細胞肺癌(NSCLC)中的最新數據,進一步證實了該藥物的療效和安全性。
默沙東斥資6.8億美元收購Harpoon Therapeutics
默沙東(Merck & Co., MSD)于2024年3月宣布完成對Harpoon Therapeutics的收購,交易總值約6.8億美元,此舉通過獲得后者基于TriTAC和ProTriTAC技術的T細胞接合器平臺,加強了默沙東在腫瘤免疫領域的管線,與其ADC戰略形成良好互補。
2024年4月:AACR年會成為ADC數據爆發舞臺
2024年4月舉辦的美國癌癥研究協會年會(AACR)成為ADC數據的爆發舞臺,阿斯利康和第一三共公布了其TROP2靶向ADC藥物Dato-DXd(Datopotamab deruxtecan)在三陰性乳腺癌(TNBC)和NSCLC中的最新療效和探索性生物標志物數據,同時針對組織因子(Tissue Factor)的國產ADC藥物MRG004A也公布了在晚期實體瘤中的初步積極數據,此外雙特異性ADC、免疫刺激ADC(ISADC)等新一代技術平臺的早期臨床前數據被大量展示,揭示了未來發展方向。
輝瑞/榮昌Disitamab Vedotin中國獲批新適應癥
中國國家藥品監督管理局(NMPA)于2024年4月批準了輝瑞和榮昌生物的注射用維迪西妥單抗(Disitamab Vedotin, 愛地希®)的新適應癥,即聯合帕博利珠單抗(K藥)用于既往接受過含鉑化療的局部晚期或轉移性尿路上皮癌患者。
2024年5月:ASCO年會摘要揭示多項ADC關鍵數據
2024年5月,美國臨床腫瘤學會(ASCO)年會線上摘要公布,揭示了多項ADC關鍵臨床試驗結果,包括Enhertu在多種HER2表達水平乳腺癌和其他癌種的新數據、Dato-DXd在HR陽性/HER2陰性乳腺癌中的III期臨床試驗(TROPION-Breast01)的詳細總生存期(OS)數據、Trodelvy在TNBC和尿路上皮癌的更新數據,以及科倫博泰的SKB264(TROP2-ADC)、百利天恒的BL-B01D1(EGFR/HER3雙抗ADC)等國產ADC展示出國際競爭力的最新臨床數據。
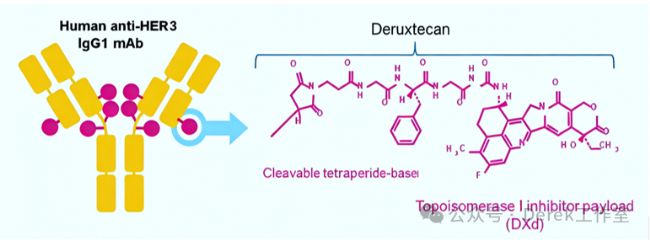
第一三共HER3-DXd獲FDA優先審評
FDA于2024年5月授予了第一三共的Patritumab deruxtecan(HER3-DXd)優先審評資格,用于治療既往接受過至少兩種系統性治療的EGFR突變局部晚期或轉移性NSCLC患者,并將PDUFA日期定為2024年第四季度。
2024年6月:ASCO年會ADC數據引發全球熱議
2024年6月,ASCO年會于芝加哥舉行,會議期間ADC數據成為絕對焦點,其中Dato-DXd在乳腺癌中的OS數據、HER3-DXd在NSCLC中的確認數據、以及眾多中國創新ADC的臨床結果引發了全球腫瘤學界的廣泛關注和熱烈討論,進一步鞏固了ADC作為腫瘤治療支柱性藥物的地位。
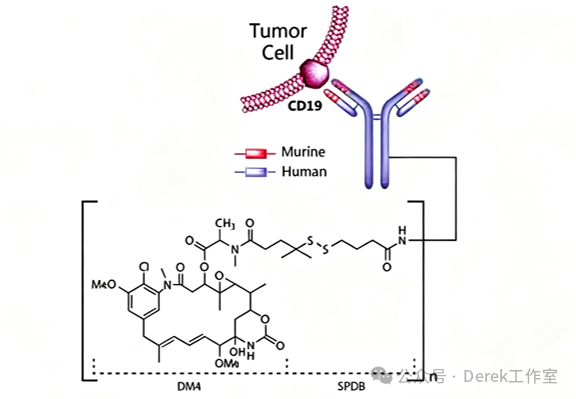
2024年7月:FDA批準羅氏ADC聯合療法用于淋巴瘤
FDA于2024年7月加速批準了羅氏(Roche)的Tukysa(tucatinib)聯合其新型ADC藥物Coltuximab ravtansine(靶向CD19)的方案,用于治療既往接受過至少二線治療的復發/難治性彌漫大B細胞淋巴瘤(R/R DLBCL)成人患者,該批準基于一項單臂II期研究的積極結果。
K藥聯合Enfortumab Vedotin III期研究成功
默沙東(Merck & Co., MSD)于2024年7月宣布其抗PD-1療法Keytruda(pembrolizumab)聯合Enfortumab vedotin一線治療局部晚期或轉移性尿路上皮癌(la/mUC)的III期研究EV-302達到總生存期(OS)和無進展生存期(PFS)的雙重主要終點,結果顯示聯合療法相比標準化療顯著延長患者生存期。
2024年8月:安斯泰來/輝瑞Enfortumab Vedotin中國獲批
安斯泰來和輝瑞的維恩妥尤單抗(Enfortumab Vedotin,商品名Padcev)于2024年8月19日獲中國批準,用于治療既往接受過含鉑化療和PD-1/L1抑制劑治療的局部晚期或轉移性尿路上皮癌(la/mUC)成年患者。
第一三共HER3-DXd獲FDA批準上市
FDA于2024年8月正式批準了第一三共的Patritumab deruxtecan(HER3-DXd,商品名:Herzuma)用于治療既往接受過至少兩種系統性治療的EGFR突變局部晚期或轉移性非小細胞肺癌(NSCLC)成人患者,該批準基于HERTHENA-Lung01 II期研究的結果。
2024年9月:Disitamab Vedotin中國獲批單藥尿路上皮癌適應癥
中國國家藥品監督管理局(NMPA)于2024年9月批準了輝瑞和榮昌生物的注射用維迪西妥單抗(Disitamab Vedotin, 愛地希®)用于單藥治療既往接受過含鉑化療和PD-1/L1抑制劑治療的局部晚期或轉移性尿路上皮癌患者,這是該藥在中國獲批的第三個適應癥。
2024年10月:ESMO大會公布AZD8205首次人體數據
在2024年10月舉辦的歐洲腫瘤醫學學會(ESMO)大會上,公布了由阿斯利康研發的抗體偶聯藥物AZD8205的首次人體臨床研究數據,該研究共計入組了47名患者,其中9名患者出現了部分治療應答,顯示了初步療效。
艾伯維50億美元收購ImmunoGen
艾伯維(AbbVie)于2024年10月宣布以總價約50億美元收購臨床階段生物技術公司ImmunoGen,后者核心資產為針對FRα的ADC藥物Elahere(mirvetuximab soravtansine),用于治療鉑耐藥卵巢癌,此舉顯著增強了艾伯維在實體瘤ADC領域的布局。
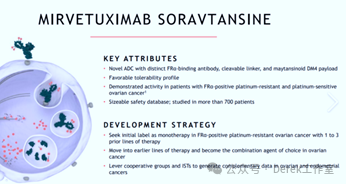
2024年11月:華東醫藥索米妥昔單抗中國獲批
華東醫藥與ImmunoGen合作開發的索米妥昔單抗(商品名:愛拉赫/ELAHERE)于2024年11月27日獲中國批準,用于既往接受過1-3線系統性治療的葉酸受體α(FRα)陽性的鉑類耐藥卵巢癌(PROC)患者。
科倫博泰蘆康沙妥珠單抗中國獲批
科倫博泰的蘆康沙妥珠單抗(TROP2-ADC)于2024年11月28日獲中國批準上市,用于治療既往至少接受過2種系統治療(其中至少1種治療針對晚期或轉移性階段)的不可切除的局部晚期或轉移性三陰性乳腺癌(TNBC)成人患者。
2024年12月:山西納安ADC產品T320獲FDA臨床許可
山西納安生物科技股份有限公司的首個抗體偶聯藥物(ADC)產品T320于2024年12月5日獲得美國食品藥品監督管理局(FDA)的新藥臨床試驗(IND)許可,標志著其國際化研發進程正式啟動。
替朗妥昔單抗Zynlonta中國獲批用于淋巴瘤
瓴路藥業與ADC Therapeutics合作的替朗妥昔單抗(Loncastuximab Tesirine,商品名Zynlonta)于2024年12月10日在中國獲批,用于治療二線或多線系統治療后復發或難治性大B細胞淋巴瘤成年患者。
SABCS展示ADC與PARP抑制劑聯合療法前景
在2024年12月舉辦的圣安東尼奧乳腺癌研討會(SABCS)上,公布了PARP抑制劑奧拉帕利聯合HER2靶向ADC藥物德曲妥珠單抗(Enhertu)在臨床研究中顯示出良好的治療效果,為聯合療法提供了新證據。
2025年抗體偶聯藥物(ADC)領域重大事件
2025年5月:FDA批準阿斯利康/第一三共Trop2 ADC及艾伯維c-MET ADC
FDA于2025年5月批準了由阿斯利康與第一三共聯合開發的靶向Trop2的ADC藥物(Datopotamab Deruxtecan, Dato-DXd),用于治療無法切除或轉移性HR陽性、HER2陰性(HR+/HER2-)乳腺癌成人患者;同期,FDA還批準了艾伯維旗下靶向c-Met的抗體偶聯藥物,用于治療c-Met蛋白高度表達的局部晚期或轉移性非鱗狀非小細胞肺癌(NSCLC)成年患者。
2025年9月:恒瑞醫藥HER2 ADC獲批用于肺癌
2025年上半年,恒瑞醫藥的HER2靶向ADC藥物(SHR-A1811)獲批上市,用于單藥治療存在HER2激活突變且既往接受過至少一種系統治療的不可切除的局部晚期或轉移性非小細胞肺癌(NSCLC)成人患者,標志著國產ADC在該領域取得重要進展。







