ADCs藥物發展史、全球市場現狀及其未來研發趨勢
文章來源公眾號:智享藥界 作者:虎仔奶爸
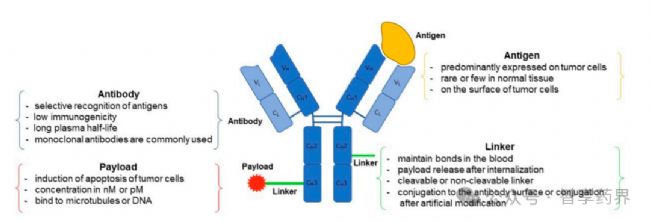
抗體藥物偶聯物(Antibody-Drug Conjugates ADCs)代表了癌癥治療的前沿方法。ADCs創新療法將抗體的靶向能力和細胞毒性藥物的效力相結合。將抗體、細胞毒性藥物通過連接子連接,將小分子藥物精確遞送到癌細胞,提高治療效果的同時最大限度地減少對健康組織的傷害。本文將分享目前已經由FDA批準的上市的ADCs藥物以及簡述ADCs藥物未來發展方向。
ADCs藥物擴大療效-毒性窗

1.ADCs藥物發展史
1913年,德國物理學家和科學家Paul Ehrlich率先提出了針對微生物或腫瘤細胞靶向遞送有毒物質的概念。
1983年,首個ADC臨床試驗開展,使用抗癌胚抗原(CEA)抗體與 長春地辛 偶聯,探索其在癌癥治療中的潛力。盡管初步顯示療效,但因劑量到達腫瘤部位的效率僅1%-2%,后續臨床試驗終止。
2000年,隨著針對成人急性髓系白血病的抗CD33靶向藥物gemtuzumab ozogamicin的出現,ADC的開發取得了重大成功。之后,brentuximab vedotin,被批準用于治療經典霍奇金淋巴瘤和系統性間變性大細胞淋巴瘤。
2013年,第一個被批準用于治療實體瘤的ADC是人表皮生長因子受體2(HER2)靶向ADC,trastuzumab emtansine(T-DM1),用于治療轉移性乳腺癌癥。
2.ADCs藥物全球市場
2024年,全球抗體藥物偶聯物市場規模為114.3億美元,預計到2034年將達到約319.6億美元,2025年至2034年的復合年增長率為10.83%。
3.ADCs藥物抗原靶標
抗原靶標的選擇對于ADCs藥物的設計至關重要,首先抗原應主要在腫瘤細胞中表達,以降低“脫靶效應”(off-target toxicity),其次與靶抗原的結合應導致抗原-抗體復合物的內化,且應在腫瘤細胞表面及應不是分泌型的。FDA批準的血液系統惡性腫瘤的靶抗原有CD19/CD22/CD30/CD33和CD79b,以及實體癌中的HER2/TROP2/NECTIN4/組織因子/葉酸受體α(FRα)。
4.FDA批準的15款ADCs藥物
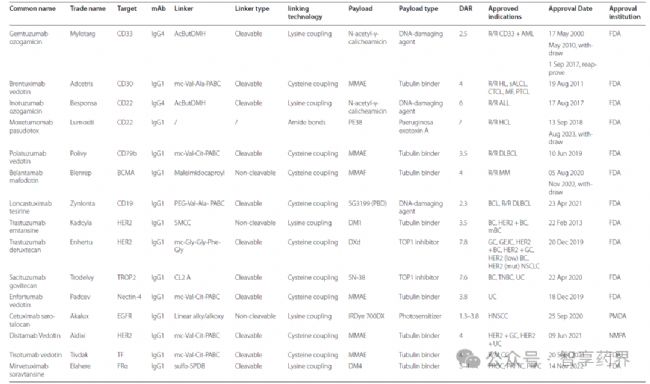
以及2025年批準AstraZeneca/Daiichi Sankyo聯合研制的靶點為TROP2的Datopotamab Deruxtecan(Datroway)用于HR+/HER2– BC;Abbvie研制的靶點為c-Met 的Telisotuzumab vedotin(EMRELIS™)用于NSCLC。
5.ADCs藥物研發考量
抗原靶點:評估癌癥與正常細胞中抗原的表達譜、抗原介導的內吞作用和抗原的親和力(高表達可導致結合位點阻塞)。
- 抗體骨架:考慮因素包括FcγR和FcRn等受體介導的功能。
- 有效載荷:因素包括毒性、作用機制、半衰期、極性(親脂性)和外排轉運體效應。通常,有效載荷的選擇是保守的,通常選擇研究充分的毒素家族,如卡奇霉素、澳瑞他汀類、美登素類、拓撲異構酶I抑制劑和吡咯并苯二氮卓類。
- 連接物:因素包括有效載荷的釋放機制(可切割或不可切割)、親水性/疏水性和釋放部位(溶酶體或腫瘤微環境)。
- 共軛位點:這必須考慮共軛有效載荷的數量、共軛類型(位點特異性或非位點特異性)以及DAR的均勻性。
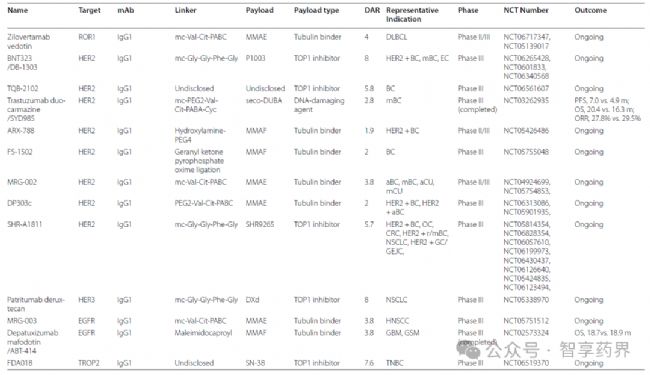
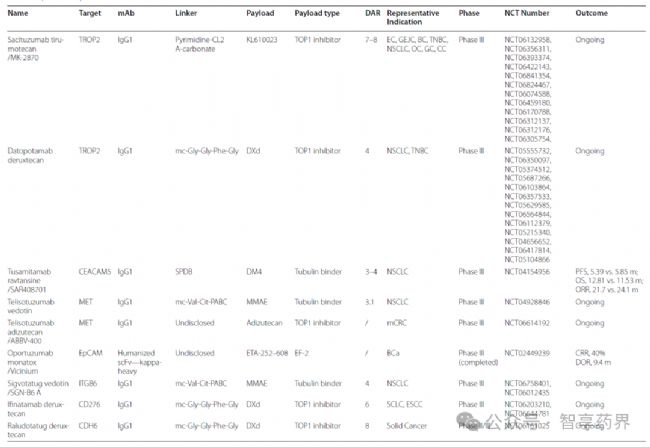
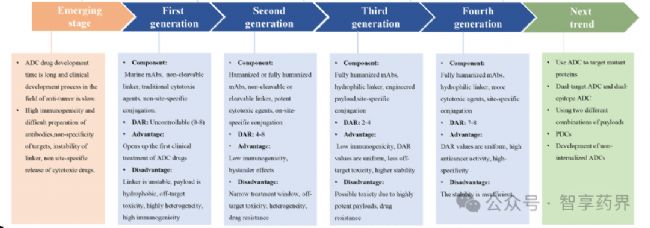
6.ADCs藥物未來研發趨勢
在一項128個臨床研究(2018 至2023年)中顯示,正在研究的主要靶抗原是HER2,在II期臨床試驗中有大量HER2,而在I-II期臨床實驗中有97種HER2。這些ADC使用111個可切割連接體、4個不可切割連接物和13個未知連接體的組合。最常用的接頭是瓜氨酸纈氨酸(Val-Cit)。就有效載荷而言,有90項研究關注微管聚合抑制劑,31項研究探索DNA損傷劑,最常用的有效載荷是MMAE。
處于臨床期間的ADCs藥物