第三代ADC藥物在突破實體瘤治療瓶頸中的策略與創新體現
抗體藥物偶聯物(ADC)作為靶向治療的重要代表,其發展歷程經歷了從隨機偶聯到定點偶聯的技術革新。早期ADC藥物存在諸多局限性:首先,傳統非定點偶聯導致藥物抗體比率(DAR)呈現異質性分布,其中低DAR組分療效不足,而高DAR組分則易被快速清除;其次,抗原表達異質性、內化效率差異以及溶酶體降解缺陷等因素均會影響有效載荷的釋放效率;此外,ADC的較大分子量(約150kDa)限制了其在實體瘤組織中的滲透和分布。
這些技術瓶頸促使研究人員從多個維度進行創新:一是開發位點特異性偶聯技術以提高產品均一性;二是優化抗體骨架以改善腫瘤滲透性;三是開發新型有效載荷以克服耐藥機制;四是設計智能釋放系統以適應腫瘤微環境特性。這些技術突破共同推動了第三代ADC藥物的誕生和發展。
二、位點特異性偶聯技術如何提升ADC藥物質量?位點特異性偶聯技術是第三代ADC的核心特征之一,主要通過三種策略實現:
基于工程化氨基酸的偶聯技術通過在抗體特定位點引入非天然氨基酸或半胱氨酸殘基,實現精準可控的偶聯。例如,在抗體重鏈第265位或第239位引入特定突變,可與連接子實現定點偶聯。研究表明,這種定點偶聯得到的ADC與傳統隨機偶聯ADC相比,在保持相似療效的同時,顯著改善了藥代動力學特性,降低了系統毒性。
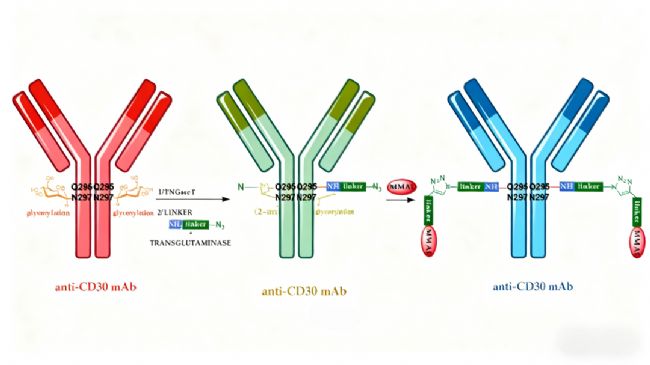
酶介導的偶聯技術利用轉谷氨酰胺酶等特異性酶催化反應,實現對抗體特定谷氨酰胺殘基的修飾。該方法可通過三步法工藝獲得均一的ADC產品,且不影響抗體的抗原結合能力。這種生物催化 approach 為ADC的規模化生產提供了新的技術路徑。
基于新型連接化學的偶聯策略采用二溴甲基酰胺或二噻吩基馬來酰亞胺等異質雙功能連接體,可直接從天然抗體產生DAR為4的均質ADC。這些創新化學方法不僅提高了產品均一性,還增強了ADC在血漿中的穩定性。
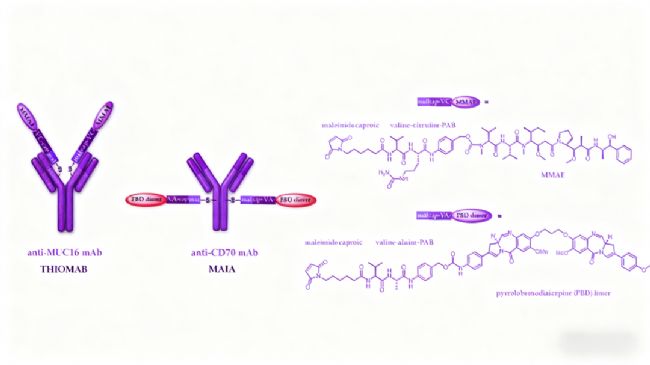
第三代ADC在有效載荷方面的創新主要體現在以下幾個方面:
PBD二聚體作為高效DNA損傷劑,其分子結構包含兩個烷基化亞胺官能團,能夠與DNA形成不可逆交聯,效力比傳統微管蛋白抑制劑高50-100倍。盡管早期基于PBD的ADC(如vadastuximab talirine)因安全性問題在臨床試驗中受挫,但優化后的tesirine衍生物在loncastuximab tesirine等ADC中展現出更好的治療窗口。
為克服IgG骨架在實體瘤治療中的局限性,研究人員開發了多種小型化結合形式:
單鏈抗體片段(scFv)與auristatin衍生物的定點偶聯產生了單鏈抗體藥物偶聯物(SDC)。盡管DAR僅為1,但抗HER2 SDC在體外對SK-BR-3細胞顯示出納摩爾級的殺傷效力(EC50分別為0.68nM和0.32nM),且對HER2陰性細胞無影響,證明了小型化結合物的靶向特異性。
雙特異性ADC通過同時靶向HER2的不同表位,增強了對低HER2表達癌細胞的結合和內化。例如,IMMU-4276在代表不同患者亞群的各種腫瘤模型中顯示出優于T-DM1的抗腫瘤活性。通過引入L234F和S239C突變減少FcγR結合,進一步降低了血小板減少等副作用風險。
小免疫蛋白(SIP)形式將單鏈抗體片段與人IgE εCH4結構域融合,在C末端引入兩個未配對半胱氨酸殘基,實現DM1的區域特異性偶聯。在F9畸胎瘤模型中,SIP(F8)-SS-DM1在等摩爾劑量下比IgG類似物顯示出更優的療效,使80%的小鼠達到完全緩解。
五、智能釋放系統如何提升ADC的治療指數?第三代ADC在釋放系統方面的創新主要體現在對腫瘤微環境的精準響應:
基于細胞外蛋白酶的釋放系統針對實體瘤中難以內化抗原的挑戰,利用腫瘤微環境中的特異性蛋白酶實現細胞外藥物釋放。這種策略使ADC不再依賴于腫瘤細胞的內化過程,有效克服了某些耐藥機制。
pH敏感釋放系統利用腫瘤組織特有的酸性微環境,通過腙鍵等酸敏感化學鍵實現選擇性藥物釋放。這類系統可顯著降低正常組織中的脫靶毒性,提高治療窗口。
可還原二硫鍵連接子通過響應腫瘤細胞內高濃度谷胱甘肽實現特異性釋放。例如,SIP(F8)-SS-DM1中的二硫鍵連接子顯示出優于傳統連接子的釋放動力學特性,在體內表現出更優的療效。
六、第三代ADC的成功案例提供了哪些啟示?Enhertu(DS-8201)的成功代表了第三代ADC的多個技術突破:采用新型拓撲異構酶I抑制劑DXd(exatecan衍生物),效力比SN-38高10倍;通過可裂解四肽連接子實現高達7.7的DAR,且不影響藥代動力學;優化的連接子化學使DXd具有適度的膜滲透性,產生"旁觀者效應"卻不引起顯著靶外毒性。這些特性使Enhertu在HER2低表達腫瘤中仍保持顯著療效。
Trodelvy(sacituzumab govitecan)的創新體現在三重突破:靶向TROP-2這一在多種上皮癌中廣泛表達的靶點;采用具有短PEG單元的CL2A連接子,實現高達7.6的DAR;使用SN-38這一相對溫和的有效載荷。這些特性使其在難治性三陰性乳腺癌中顯示出顯著療效,重新定義了ADC的DAR最佳值概念。
七、ADC藥物的毒性管理策略如何優化?第三代ADC在毒性管理方面取得了顯著進步:
通過位點特異性偶聯技術改善產品均一性,避免了高DAR組分的快速清除和低DAR組分的競爭性抑制,從而優化了治療指數。例如,Enhertu即使DAR高達7.7,仍在臨床前模型中顯示出良好的耐受性。
連接子技術的創新有效降低了脫靶毒性。DXd和SN-38等有效載荷的短半衰期特性,結合優化的釋放動力學,顯著減少了正常組織暴露。
靶點選擇和組織特異性表達的深入研究幫助預測和管理特定毒性。例如,通過突變Fc區域減少FcγR結合,可降低血小板減少和肝毒性風險。
這些技術進步使得第三代ADC在保持高效抗腫瘤活性的同時,顯著改善了安全性特征,為臨床應用提供了更廣闊的空間。隨著技術的不斷成熟,ADC藥物有望在更多難治性腫瘤中發揮重要作用。
樂備實是國內專注于提供高質量蛋白檢測以及組學分析服務的實驗服務專家,自2018年成立以來,樂備實不斷尋求突破,公司的服務技術平臺已擴展到單細胞測序、空間多組學、流式檢測、超敏電化學發光、Luminex多因子檢測、抗體芯片、PCR Array、ELISA、Elispot、PLA蛋白互作、多色免疫組化、DSP空間多組學等30多個,建立起了一套涵蓋基因、蛋白、細胞以及組織水平實驗的完整檢測體系。






