外周免疫耐受相關基因FOXP3的發現及相關動物模型的介紹
每年的諾貝爾生理學或醫學獎都引領著全球目光聚焦于那些對人類健康與生命科學認知產生革命性影響的突破。從青霉素的發現到DNA雙螺旋的揭秘,從免疫檢查點的抗癌奇跡到mRNA疫苗的抗疫壯舉,諾獎始終褒獎著那些撥開生命迷霧、啟迪治療新途的偉大學者。2025年,生理學或醫學獎的桂冠再次垂青免疫學領域——給到了FOXP3基因及其驅動的調節性T細胞(Tregs)。
FOXP3的發現,解開了困擾免疫學家數十年的謎團:為何我們的免疫系統能精準攻擊外來病原體,卻對自身組織保持“寬容”?這一“自我耐受”機制的破譯,不僅重塑了我們對免疫平衡的理解,更為自身免疫病、過敏、癌癥乃至器官移植開辟了前所未有的治療前景。本文將深入探討FOXP3基因的奧秘,解析其問鼎諾獎的實力與未來應用。
基因概述:主宰免疫寬容的“大師基因”
FOXP3,全稱為Forkhead box P3,是位于X染色體上的一個關鍵基因。它編碼的蛋白質屬于Forkhead/winged-helix轉錄因子家族,充當著細胞內部的“總指揮”,通過調控下游眾多基因的表達,決定T淋巴細胞的命運。
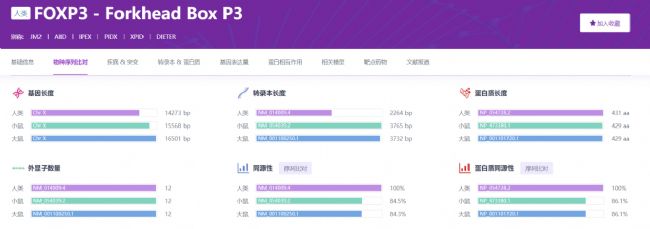
圖1 不同物種基因信息的對比(https://rddc.tsinghua-gd.org/zh)
FOXP3最卓越的地位在于,它被公認為調節性T細胞(Regulatory T cells, Tregs)的譜系決定因子和功能主控開關。在T細胞發育和分化的十字路口,FOXP3的表達如同一道神圣的“任命狀”,將naïve T細胞轉化為具有強大抑制功能的Tregs。這些細胞是免疫系統中的“憲兵”或“和平使者”,專職維持秩序,防止免疫反應過度活躍而傷及自身。缺乏FOXP3基因的個體(如小鼠中的“scurfy”突變體或人類的IPEX綜合征患者),其免疫系統會陷入徹底的混亂,無情地攻擊自身器官,這從反面印證了FOXP3不可或缺的至尊地位。
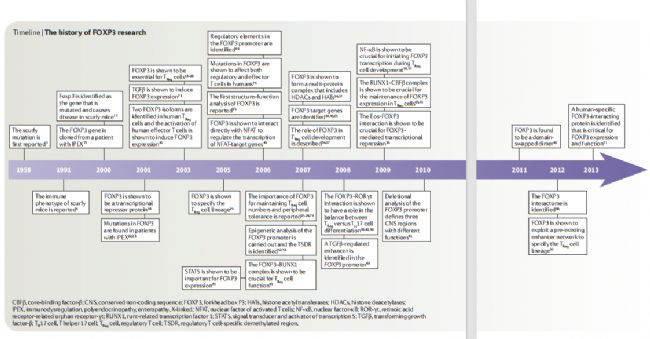
圖2 FOXP3研究歷史
功能與作用機制:精密調控的“交響樂”
FOXP3的功能遠非一個簡單的“開關”所能概括,它指揮著一場精密的細胞內交響樂,通過多維度機制確保免疫穩態。
1、Tregs的發育與穩定:在胸腺中,FOXP3引導著自身反應性T細胞分化為胸腺來源的Tregs (tTregs),這是建立中樞免疫耐受的基礎。在外周,它也能誘導常規T細胞轉化為外周來源的Tregs (pTregs),應對環境中的抗原,維持局部耐受。
2、抑制功能的執行:FOXP3蛋白通過結合到數百個靶基因的啟動子區域,像orchestra指揮一樣調動整個抑制性程序。其核心作用機制包括:
● 細胞因子調控:FOXP3促進抑制性細胞因子(如IL-10, TGF-β)的分泌,同時抑制效應性細胞因子(如IL-2, IFN-γ)的產生。
● 代謝干擾:FOXP3通過高表達CD25(IL-2受體α鏈)“竊取”周圍免疫細胞生存所必需的IL-2,并通過獨特的代謝途徑耗竭局部的必需氨基酸(如色氨酸),間接抑制效應T細胞的增殖與功能。
● 細胞接觸依賴抑制:通過表面分子(如CTLA-4)直接向抗原呈遞細胞傳遞抑制信號,或通過顆粒酶/穿孔素途徑直接殺傷過度活躍的效應細胞。
3、表觀遺傳修飾:FOXP3還能招募其他表觀遺傳修飾復合物,在Tregs的關鍵基因位點上形成特定的“表觀遺傳印記”(如DNA去甲基化),這使得Tregs的抑制表型即使在沒有持續刺激的情況下也能保持長期穩定,成為一種“細胞記憶”。
FOXP3與疾病的關系:失衡背后的“密鑰”
FOXP3/Tregs的任何細微失調都可能導致嚴重的病理后果,使其成為眾多疾病的核心環節。
● 自身免疫性疾病:在Ⅰ型糖尿病、類風濕關節炎、多發性硬化癥、系統性紅斑狼瘡等疾病中,普遍觀察到患者體內Tregs數量減少或功能缺陷。FOXP3的表達或活性受損,導致“和平使者”無力鎮壓自身反應性免疫細胞的“叛亂”,從而引發對自身組織的攻擊。
● 過敏性疾病:如哮喘和特應性皮炎,本質是免疫系統對無害環境抗原(如花粉、塵螨)的過度反應。FOXP3功能的削弱導致無法有效抑制Th2型炎癥反應。
● 癌癥:這是一個“過猶不及”的典型。腫瘤微環境會“劫持”Tregs,誘導其大量浸潤并抑制殺傷性T細胞對癌細胞的攻擊。高水平的腫瘤浸潤Tregs通常與預后不良相關。在這里,Foxp3驅動的免疫抑制成了幫兇,保護了腫瘤。
● 感染與移植:在慢性感染(如HIV、HCV)中,Tregs的過度抑制會削弱機體清除病原體的能力。而在器官移植中,正是需要Tregs的抑制功能來誘導對移植器官的免疫耐受,防止排斥反應。
未來的潛力:從基礎研究到精準醫療的飛躍
基于對FOXP3機制的深刻理解,全新的治療策略正在從實驗室走向臨床,展現出巨大的潛力。
1、增強Tregs療法(用于自身免疫病與移植):
● 過繼細胞療法:從患者體內分離出T細胞,在體外通過基因工程(如導入FOXP3基因)或藥物誘導擴增出大量功能性Tregs,再回輸到患者體內,像投放“增援部隊”一樣強化免疫抑制。這在治療移植物抗宿主病(GvHD)和Ⅰ型糖尿病的早期臨床試驗中已顯示出promising的效果。
● 藥物靶向:開發能夠特異性增強FOXP3表達或穩定性的小分子藥物(如低劑量IL-2療法),旨在“賦能”體內原有的Tregs。
2、抑制Tregs療法(用于癌癥):
● 靶向清除:開發針對Tregs表面特異性標志物(如CD25)的抗體,選擇性耗竭腫瘤內的Tregs,解除免疫抑制,從而解放抗癌免疫反應。
● 功能干擾:使用抗體阻斷Tregs的關鍵功能分子,如CTLA-4抑制劑(伊匹木單抗),其抗癌機制部分就是通過抑制Treg功能實現的。
3、基因治療與再生醫學:對于IPEX綜合征等單基因遺傳病,直接修正造血干細胞中的FOXP3基因突變,再從回輸給患者,有望實現根本性的治愈。
FOXP3相關動物模型:通往真理的“必由之路”
所有關于FOXP3的偉大認知和療法的突破,都離不開動物模型,尤其是小鼠的不可或缺的貢獻。
● “Scurfy”小鼠:這是最著名的天然突變模型,其Foxp3基因突變導致Tregs完全缺失,小鼠表現出與人類IPEX綜合征極為相似的多器官自身免疫炎癥,并早早夭折。該模型首次確證了Foxp3對免疫耐受的絕對必要性。
● Foxp3-GFP小鼠:科學家將綠色熒光蛋白(GFP)報告基因敲入Foxp3基因位點,使得表達Foxp3的Tregs會發出綠色熒光。這成為了分離、追蹤、研究Tregs的“金標準”工具,極大地推動了該領域的發展。
● Foxp3-DTR小鼠:在該模型中,Tregs特異性地表達白喉毒素受體(DTR)。給成年小鼠注射白喉毒素后,可以精準、快速地剔除體內的Tregs。這使得研究人員可以在任何時間點研究Tregs缺失的急性后果,避免了發育代償的干擾。
● 疾病特異性模型:將上述Cre工具鼠與自身免疫病模型(如NOD小鼠用于糖尿病)、或癌癥模型(如MC38結腸癌小鼠)進行交配,可以在特定疾病背景下深入研究Tregs的動態變化和功能,并用于評估靶向Tregs的藥物療效和安全性。






