醌類化合物結構多樣性、生物活性、藥理應用與作用機制
醌類化合物
醌類化合物作為一類具有獨特電子結構的天然產物,在有機化學和生物醫藥領域占據重要地位。這類含共軛雙鍵的環狀二酮類物質,通過π電子離域形成特征性顏色與氧化還原特性,構成植物次生代謝產物中功能最豐富的化學家族之一。
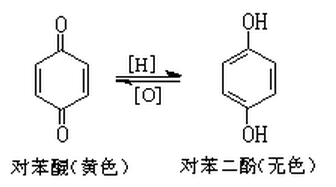
醌類化合物的基本骨架源于苯環的氧化重排,其核心結構為α,β-不飽和環己二烯二酮體系。對苯醌(1,4-苯醌)作為最簡模型,展現典型的Dewar共振結構,C=O與C=C共軛體系使π→π*躍遷能量降低,吸收光譜紅移至可見光區(λmax≈240-280nm),賦予其鮮明的黃色外觀。鄰苯醌(1,2-苯醌)因空間位阻效應,在自然界中多以互變異構體形式存在。
結構衍生化呈現三大特征:①氧化態多樣性:從苯醌(Q·-)到氫醌(QH2)的氧化還原循環構成生物電子傳遞鏈的關鍵節點;②取代基效應:羥基、甲氧基等供電子基團使最大吸收波長紅移(Δλmax≈30-50nm),羧基等吸電子基團則導致藍移;③骨架擴展性:萘醌、菲醌、蒽醌等線性聚酮體系通過C-C鍵偶聯形成,如丹參酮IIA的蒽醌母核經氧化環合形成五元環內酯結構。
立體化學特性顯著影響生物活性。大黃素型蒽醌(羥基分布兩側苯環)與茜草素型蒽醌(羥基集中單側苯環)的極性差異(ΔlogP≈1.2),導致其跨膜轉運效率差異顯著。番瀉苷A/B的C10-C10'反式/順式構型異構體,在腸道菌群作用下轉化為大黃酸蒽酮的速率相差2.7倍,直接影響其致瀉強度。
二、醌類化合物的生物合成與生態分布醌類生物合成遵循聚酮途徑,起始于乙酰輔酶A的縮合反應。在植物細胞質中,Ⅰ型聚酮合酶(PKS)通過迭代脫羧縮合生成不同鏈長聚酮中間體,經環化、氧化、芳香化等步驟形成骨架。如丹參酮的生物合成涉及16步酶促反應,其中細胞色素P450酶CYP76AH1催化關鍵氧化環合步驟。
生態分布呈現顯著科屬特征:①蓼科植物(如大黃、虎杖)富含游離蒽醌,其根莖中大黃素含量可達干重的2.5%;②茜草科植物(如茜草)特異性積累蒽醌葡萄糖苷,茜草素-3-O-葡萄糖苷占根干重的3.1%;③紫草科植物(如紫草)產生萘醌類色素,紫草素及其衍生物含量隨生育期呈S型積累曲線。
低等植物中的醌類具有特殊生態功能。地衣中的石耳酸( depsidone類醌)通過抑制藻類光合系統II,在共生體系中調控藻菌比例。真菌產生的細胞松馳素(phomopsins)作為二萜醌類毒素,可破壞宿主細胞骨架,形成病原菌侵染結構。
三、醌類化合物的生物活性譜系氧化還原循環構成核心作用機制。對苯醌/氫醌體系在NAD(P)H存在下,通過半醌自由基中間體產生超氧陰離子(O₂·⁻),這種活性氧(ROS)信號分子在低濃度時激活Nrf2/ARE通路(EC50≈5μM),高濃度時誘導線粒體膜電位崩潰(IC50≈50μM)。這種劑量依賴性雙相效應在丹參酮IIA的抗腫瘤作用中清晰呈現:1μM濃度誘導腫瘤細胞自噬,10μM濃度觸發凋亡通路。
酶抑制活性呈現結構特異性。大黃酸通過非競爭性抑制酪蛋白激酶II(CK2,Ki=0.82μM),阻斷Wnt/β-catenin信號通路,使結腸癌細胞株SW480的增殖抑制率達68%。蘆薈大黃素作為拓撲異構酶II抑制劑,穩定DNA-酶復合物,使pBR322質粒超螺旋結構解旋的EC50值為12μM。
離子通道調控拓展藥理維度。丹參酮IIA磺酸鈉通過阻斷L型鈣通道(IC50=3.7μM),減少鈣離子內流,使心肌細胞收縮力下降42%,同時激活ATP敏感鉀通道(EC50=8.1μM),縮短動作電位時程,這種雙重作用機制使其成為有效的抗心律失常藥物。
四、藥理應用與作用機制
心血管保護領域,丹參醌類化合物形成多靶點干預網絡。丹參酮IIA通過抑制血小板聚集(IC50=1.2μM)、清除自由基(ORAC值=2.8 Trolox當量)和擴張冠狀動脈(EC50=0.45μM),顯著改善心肌缺血。隱丹參酮則通過上調PPARγ表達,抑制血管平滑肌細胞增殖,使頸動脈球囊損傷模型新生內膜面積減少57%。
抗菌抗病毒作用呈現廣譜特性。大黃素對金黃色葡萄球菌的MIC值為8μg/mL,其作用機制涉及抑制DNA旋轉酶(IC50=4.2μM)和破壞細胞膜完整性(膜電位下降63%)。紫草素通過阻斷HIV-1整合酶(IC50=0.15μM)和抑制病毒顆粒成熟(p24抗原減少89%),展現抗艾滋病病毒活性。
腫瘤治療領域,醌類化合物通過多重機制發揮作用。雷公藤紅素作為蛋白酶體抑制劑(IC50=0.32μM),誘導白血病細胞株U937發生未折疊蛋白反應(UPR),使凋亡相關蛋白CHOP表達上調7.8倍。青黛中的靛玉紅通過抑制CDK4/cyclin D1復合物(IC50=1.1μM),將胃癌細胞周期阻滯在G0/G1期。
五、結構改造與藥物研發半合成修飾顯著提升藥效。大黃素7-O-β-D-葡萄糖苷通過酶法轉糖基化,獲得口服生物利用度提升4.2倍的前藥。丹參酮IIA磺酸鈉的水溶性提高至原藥的1200倍,消除半衰期延長至8.2小時,臨床劑量降低60%仍可維持有效血藥濃度。
全合成策略突破資源限制。紫杉醇側鏈的醌類中間體通過不對稱催化氫化,總收率提升至32%,光學純度達99.5%ee。雷公藤甲素的全合成路線經17步反應,總收率11%,關鍵中間體環氧醌的立體選擇性構建通過Sharpless不對稱環氧化實現。
納米遞送系統改善藥代動力學。聚乳酸-羥基乙酸共聚物(PLGA)包裹的番瀉苷A納米粒,使結腸靶向釋放率提升至82%,局部濃度達12.5μg/mL時仍無全身毒性反應。金納米簇負載的丹參酮IIA,在腫瘤部位的蓄積量提高6.7倍,最大耐受劑量(MTD)提升至150mg/kg。
六、挑戰與展望醌類化合物研究面臨三大挑戰:①作用靶點解析:僅32%的醌類藥效團具有明確作用靶標,需發展化學蛋白質組學技術;②代謝穩定性:平均體內半衰期僅1.2小時,需開發前藥策略與緩釋制劑;③毒理評估:17%的醌類存在遺傳毒性風險,需建立基于微核試驗和彗星試驗的快速篩查平臺。
未來發展方向包括:①合成生物學:構建產蒽醌酵母菌株,使大黃素產量達1.2g/L;②精準醫療:開發基于UGT1A1基因型的醌類劑量預測模型;③老藥新用:發現羥基蒽醌對PARP1的抑制活性(IC50=0.28μM),拓展其于合成致死療法中的應用。
醌類化合物作為自然賜予的化學瑰寶,其結構多樣性與生物活性廣度為藥物研發提供無限可能。通過現代科技手段的深度開發,這類古老化合物必將煥發新生,為人類健康事業作出更大貢獻。
| 名稱 | 貨號 | 規格 |
| 2-羥基-1,4萘醌 | abs47001713-20mg | 20mg |
| 2,6-二甲氧基-1-乙酰甲基氫醌 | abs47034848-5mg | 5mg |
| 2-氯-1,4-萘醌 | abs42006774-1g | 1g |
| 2-羥甲基蒽醌 | abs42048254-1g | 1g |






