Foxp3重編程代謝在提高CAR-T細(xì)胞抗腫瘤療效方面的研究
嵌合抗原受體修飾T細(xì)胞(CAR-T)療法已在血液系統(tǒng)腫瘤治療中取得顯著療效,但其對(duì)實(shí)體瘤的臨床應(yīng)用仍面臨重大挑戰(zhàn)。CAR-T細(xì)胞依賴糖酵解和線粒體氧化磷酸化(OXPHOS)供能,極易受制于低糖、缺氧及乳酸蓄積的實(shí)體瘤微環(huán)境,陷入能量枯竭-功能耗竭的惡性循環(huán)。而調(diào)節(jié)性T細(xì)胞(Treg)因其獨(dú)特的脂代謝優(yōu)勢(shì)可在實(shí)體瘤微環(huán)境中長(zhǎng)期存活并發(fā)揮效應(yīng),為破解CAR-T細(xì)胞實(shí)體瘤治療困局提供關(guān)鍵啟示。
近日,復(fù)旦大學(xué)生物醫(yī)學(xué)研究院/基礎(chǔ)醫(yī)學(xué)院儲(chǔ)以微教授、復(fù)旦大學(xué)附屬華山醫(yī)院駱?lè)品蒲芯繂T團(tuán)隊(duì)首次揭示Foxp3通過(guò)非轉(zhuǎn)錄依賴的線粒體動(dòng)態(tài)調(diào)控機(jī)制,重塑CAR-T細(xì)胞代謝表型,賦予其突破實(shí)體瘤微環(huán)境限制的生存優(yōu)勢(shì),提升CAR-T細(xì)胞實(shí)體瘤治療的持久性和有效性。這項(xiàng)研究為實(shí)體瘤免疫治療提供了增效不增毒的創(chuàng)新解決方案。這項(xiàng)研究成果于05月05日發(fā)表在CellMetabolism雜志上。

圖片來(lái)源:(https://www.sciencedirect.com/science/article/pii/S1550413125002189?via%3Dihub)
研究材料與技術(shù)方法
他們?cè)谘芯恐胁捎昧硕囗?xiàng)技術(shù),包括RNAseq、ATACseq測(cè)序分析、LC-MS、Westernblotting、免疫熒光、LC-MS/MS等分析,同時(shí)還通過(guò)多種分析測(cè)定了線粒體的代謝水平。在這項(xiàng)研究中,研究人員利用免疫系統(tǒng)人源化小鼠(huHSC-C-NKG-ProF小鼠,由賽業(yè)生物提供),驗(yàn)證CAR-T細(xì)胞抗腫瘤功能,進(jìn)一步完善文章結(jié)論。
技術(shù)路線
體外分析Foxp3對(duì)CAR-T細(xì)胞代謝模式的影響
↓
Foxp3影響CAR-T細(xì)胞代謝的機(jī)制
↓
體外評(píng)估Foxp3代謝重編程CAR-T細(xì)胞的抗實(shí)體瘤治療療效
↓
體內(nèi)評(píng)估Foxp3代謝重編程CAR-T細(xì)胞的抗實(shí)體瘤治療療效
研究結(jié)果
1. CAR-TFoxp3細(xì)胞獲得與CAR-TConv細(xì)胞不同的代謝特征,且其代謝特征由Foxp3與Drp1結(jié)合決定:
本研究首先探究了Foxp3過(guò)表達(dá)是否能夠改變CAR-T細(xì)胞的代謝。利用第三代CAR,研究者構(gòu)建了CAR-TFoxp3細(xì)胞,并與CAR-TConv細(xì)胞進(jìn)行比較。結(jié)果顯示,CAR-TFoxp3細(xì)胞在GPC3抗原刺激后表現(xiàn)出較低的ECAR和OCR,這表明其糖酵解和氧化磷酸化水平下調(diào),而脂質(zhì)代謝水平上調(diào)。此外,CAR-TFoxp3細(xì)胞的線粒體數(shù)量減少,線粒體膜電位降低,這表明其線粒體功能發(fā)生改變。以上結(jié)果表明,CAR-TFoxp3細(xì)胞的代謝特征與Treg細(xì)胞相似,而與CAR-TConv細(xì)胞不同。
此外,研究者發(fā)現(xiàn)Foxp3與Drp1存在相互作用,而與其他線粒體動(dòng)力學(xué)相關(guān)蛋白無(wú)相互作用。Foxp3可以進(jìn)入細(xì)胞質(zhì)并與Drp1共定位,并可以降低Drp1在絲氨酸616位點(diǎn)的磷酸化水平,從而抑制線粒體分裂,導(dǎo)致線粒體數(shù)量和線粒體膜電位降低,進(jìn)而導(dǎo)致氧化磷酸化水平下調(diào)。
2. CAR-TFoxp3細(xì)胞不獲得Treg細(xì)胞的染色質(zhì)可及性和抑制功能,且Foxp3介導(dǎo)的代謝下調(diào)會(huì)耗竭相關(guān)抑制分子的表達(dá):
由于Foxp3在Treg細(xì)胞發(fā)育和分化中起關(guān)鍵作用,研究者檢測(cè)了CAR-TFoxp3細(xì)胞是否發(fā)生了染色質(zhì)景觀的改變,從而轉(zhuǎn)化為T(mén)reg細(xì)胞。通過(guò)ATAC-seq分析發(fā)現(xiàn),Treg細(xì)胞的染色質(zhì)可及性低于CAR-TConv和CAR-TFoxp3細(xì)胞。此外,CAR-TFoxp3細(xì)胞不表達(dá)Treg細(xì)胞相關(guān)的抑制性細(xì)胞因子和標(biāo)記物,并且不具有抑制TConv細(xì)胞增殖的能力。以上結(jié)果表明,CAR-TFoxp3細(xì)胞的染色質(zhì)景觀和抑制功能與Treg細(xì)胞存在根本性差異。
此外,研究者還進(jìn)一步探究了Foxp3介導(dǎo)的代謝是否有助于CAR-TFoxp3細(xì)胞的激活和功能。結(jié)果顯示,CAR-TFoxp3細(xì)胞在GPC3抗原刺激后表達(dá)較低的耗竭相關(guān)抑制分子(PD-1、TIM-3和LAG-3),并且具有更強(qiáng)的殺傷能力。此外,F(xiàn)oxp3介導(dǎo)的代謝下調(diào)了CAR-TFoxp3細(xì)胞中耗竭相關(guān)抑制分子的表達(dá),而不會(huì)影響其殺傷能力。
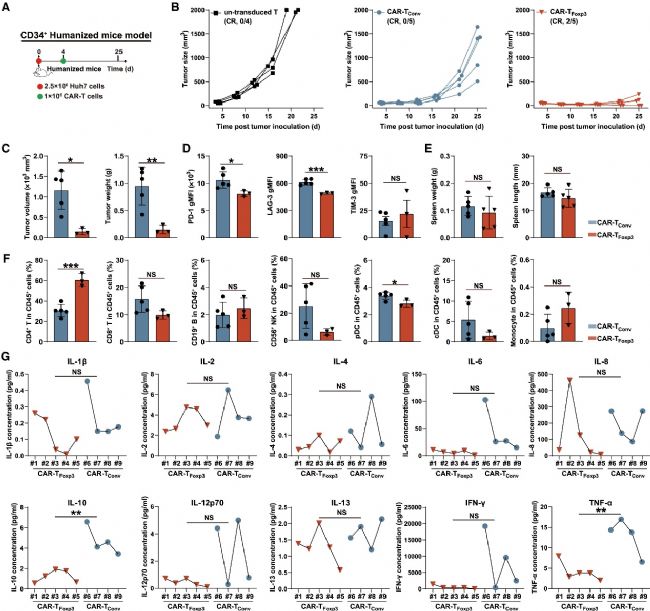
3. CAR-TFoxp3細(xì)胞在人源化C-NKG模型中獲得強(qiáng)大抗腫瘤活性且無(wú)免疫抑制:
為了評(píng)估CAR-TFoxp3細(xì)胞在免疫健全模型中的抗腫瘤效果以及對(duì)其他免疫細(xì)胞的影響,研究人員構(gòu)建了人免疫系統(tǒng)重建(人源化)的Cg-PrkdcscidIl2rgem1Smoc(C-NKG)小鼠模型(由賽業(yè)生物提供)。在該模型中,CAR-TFoxp3細(xì)胞能夠有效抑制腫瘤生長(zhǎng),部分小鼠實(shí)現(xiàn)完全緩解。對(duì)腫瘤浸潤(rùn)的CAR-T細(xì)胞和其他免疫細(xì)胞進(jìn)行分析發(fā)現(xiàn),CAR-TFoxp3細(xì)胞的耗竭相關(guān)抑制分子水平較低,且腫瘤浸潤(rùn)的CD4+T細(xì)胞數(shù)量較多。同時(shí),在該模型中,CAR-TFoxp3細(xì)胞治療組的脾臟重量和重要器官與CAR-TConv細(xì)胞治療組相比,沒(méi)有顯著差異,且外周血中細(xì)胞因子的分泌情況表明,CAR-TFoxp3細(xì)胞治療組的細(xì)胞因子風(fēng)暴現(xiàn)象有所減輕。這說(shuō)明CAR-TFoxp3細(xì)胞在人源化C-NKG模型中不僅具有強(qiáng)大的抗腫瘤活性,而且不會(huì)引起免疫抑制,安全性較高。
總結(jié)
CAR-T細(xì)胞在TME中容易發(fā)生耗竭,這是CAR-T細(xì)胞治療面臨的主要障礙之一。而Tregs能夠在實(shí)體腫瘤中生存、增殖并促進(jìn)腫瘤進(jìn)展,其代謝優(yōu)勢(shì)起到了重要作用。本研究表明,在CAR-T細(xì)胞中過(guò)表達(dá)Foxp3是一種有效的代謝干預(yù)策略,它通過(guò)與Drp1的相互作用重編程CAR-T細(xì)胞的代謝,避免了腫瘤浸潤(rùn)C(jī)AR-T細(xì)胞的耗竭,增強(qiáng)了其細(xì)胞毒性和長(zhǎng)期免疫監(jiān)視功能。總體而言,本研究強(qiáng)調(diào)了Foxp3重編程代謝在提高CAR-T細(xì)胞抗腫瘤療效方面的潛在應(yīng)用前景,為臨床免疫治療提供了新的思路。然而,CAR-TFoxp3細(xì)胞在臨床試驗(yàn)中的療效和持久性仍需進(jìn)一步研究。
參考文獻(xiàn):
[1]Congyi Niu, Huan Wei, Xuanxuan Pan, Yuedi Wang, Huan Song, Congwen Li, Jingbo Qie, Jiawen Qian, Shaocong Mo, Wanwei Zheng, Kameina Zhuma, Zixin Lv, Yiyuan Gao, Dan Zhang, Hui Yang, Ronghua Liu, Luman Wang, Wenwei Tu, Jie Liu, Yiwei Chu, Feifei Luo,Foxp3 confers long-term efficacy of chimeric antigen receptor-T cells via metabolic reprogramming, Cell Metabolism, Volume 37, Issue 6,2025, Pages 1426-1441.e7,ISSN 1550-4131, https://doi.org/10.1016/j.cmet.2025.04.008.
- 復(fù)合因素結(jié)合DNCB誘導(dǎo)的特應(yīng)性皮炎脾虛濕蘊(yùn)證小鼠模型的構(gòu)建方法
- 文獻(xiàn)分享:黃芩素對(duì)UVB誘導(dǎo)的皮膚損傷小鼠模型的保護(hù)研究
- 離體皮膚屏障針頭穿刺破壞實(shí)驗(yàn)中經(jīng)皮水分流失值變化靈敏度測(cè)試研究
- 小鼠模型在揭示PKM2介導(dǎo)組蛋白乳酸化調(diào)控多囊卵巢綜合征機(jī)制中的應(yīng)用
- 多基因表達(dá)實(shí)驗(yàn)中連接元件2A和IRES的優(yōu)缺點(diǎn)比較及選擇
- CD3/CD19/BCMA藥物靶點(diǎn)的分子機(jī)制、研發(fā)進(jìn)展與臨床前動(dòng)物模型的介紹
- 外周免疫耐受相關(guān)基因FOXP3的發(fā)現(xiàn)及相關(guān)動(dòng)物模型的介紹
- 腫瘤疫苗的作用、分類及HLA人源化小鼠在腫瘤疫苗研發(fā)中的作用
- 南模生物原位腫瘤模型構(gòu)建回歸專場(chǎng)活動(dòng)精彩回顧
- 南模生物邀您相約泰州第十六屆泰州醫(yī)藥博覽會(huì)
- 南模生物直播:靶向CD24破解肺癌EGFR-TKI耐藥困局
- 南模生物原位腫瘤模型構(gòu)建實(shí)訓(xùn)班即將再次啟動(dòng)
- 南模直播預(yù)告:Cell一作為您破解骨關(guān)節(jié)炎再生難題
- JAX正式任命北京澄天生物(iBL)為其中國(guó)官方代理商
- 南模生物邀您相約第十八屆中國(guó)實(shí)驗(yàn)動(dòng)物科學(xué)年會(huì)
- 南模生物邀您參加第4屆BIONNOVA北京創(chuàng)新論壇






