小魚大用:斑馬魚呼吸代謝及運動測量技術在生物醫學研究中的應用
斑馬魚(Danio rerio)作為生物醫學研究領域的明星模式生物,憑借其透明胚胎、快速發育等獨特優勢,在胚胎發育、疾病模型構建與藥物篩選等研究方向上大放異彩。近年來,斑馬魚呼吸代謝研究熱度持續攀升,尤其在心血管疾病與代謝疾病研究中扮演著愈發關鍵的角色,為人類健康難題的攻克提供了全新視角與有力工具。
北京易科泰提供生物醫學領域斑馬魚呼吸代謝及行為分析的全套技術方案,涵蓋斑馬魚成魚和魚卵、胚胎、幼魚的呼吸代謝測量、斑馬魚視頻跟蹤和行為分析及游泳能力評估,具體方案如下:
斑馬魚成魚呼吸代謝測量系統:提供4、8、12、16、20通道可選。  易科泰斑馬魚成魚呼吸代謝測量定制系統:提供單通道、多通道可選,具有高性價比,能夠全自動測量耗氧率(VO2)和標準代謝率(SMR)。
易科泰斑馬魚成魚呼吸代謝測量定制系統:提供單通道、多通道可選,具有高性價比,能夠全自動測量耗氧率(VO2)和標準代謝率(SMR)。
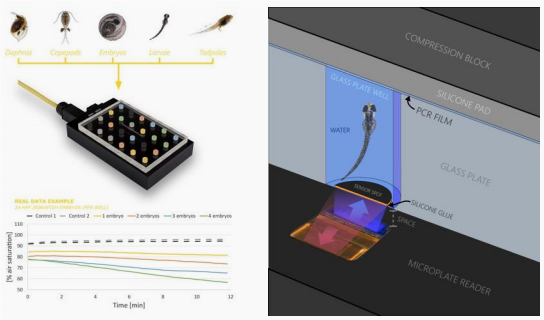
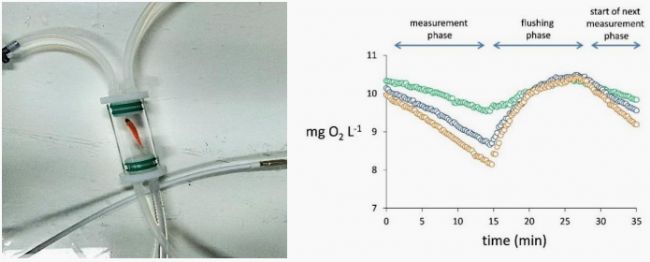 斑馬魚胚胎、幼魚高通量測量系統:提供24至240通道高通量分析,適用于大規模實驗,可同時處理多個樣本,提高實驗效率。
斑馬魚胚胎、幼魚高通量測量系統:提供24至240通道高通量分析,適用于大規模實驗,可同時處理多個樣本,提高實驗效率。
 斑馬魚游泳呼吸儀:具備全自動測量功能,實時測量和分析耗氧率(VO2),并進一步得到參數標準代謝率(SMR)、最大代謝率(MMR)、有氧代謝范圍(AS)、臨界游泳速度(Ucrit)和單位距離能耗(COT)。
斑馬魚游泳呼吸儀:具備全自動測量功能,實時測量和分析耗氧率(VO2),并進一步得到參數標準代謝率(SMR)、最大代謝率(MMR)、有氧代謝范圍(AS)、臨界游泳速度(Ucrit)和單位距離能耗(COT)。
 高通量斑馬魚行為分析系統:一體化實驗動物視頻跟蹤及行為分析系統,可對測量96個通道同步測量。該系統能夠實時記錄斑馬魚的行為數據,為行為學研究提供有力支持。
高通量斑馬魚行為分析系統:一體化實驗動物視頻跟蹤及行為分析系統,可對測量96個通道同步測量。該系統能夠實時記錄斑馬魚的行為數據,為行為學研究提供有力支持。

【案例1】早期生命階段Grb10a基因敲低對斑馬魚心血管和代謝的影響
英國曼徹斯特大學Bridget L. Evans團隊利用斑馬魚作為模型生物,揭示了Grb10a基因敲低對斑馬魚生長、代謝和心血管系統的長期影響,為理解心血管和代謝疾病的發育起源提供了新的視角。
研究人員采用間歇式呼吸代謝測量法,在28℃恒溫條件下實時記錄斑馬魚氧氣消耗率。結果顯示,Grb10a基因敲低的斑馬魚在胚胎階段表現出顯著的生長加速和代謝率提高,但心率降低。成年后,Grb10a基因敲低的斑馬魚表現出更高的最大氧氣消耗率和更大的有氧范圍,這表明其代謝能力顯著增強。此外,這些斑馬魚還表現出更高的空腹血糖水平,提示胰島素信號通能受到影響。 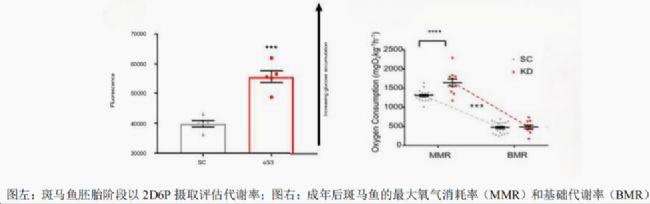 這些發現對于理解心血管和代謝疾病的發育起源具有重要意義。Grb10a基因的敲低不僅影響了斑馬魚的胚胎生長和代謝率,還導致了成年后長期的生理和代謝變化。這些結果支持了健康和疾病的發育起源理論(DOHaD),即成年期的疾病可能起源于胚胎期的發育變化。通過在斑馬魚模型中研究Grb10a基因的作用,研究人員為人類心血管和代謝疾病的預防和治療提供了新的靶點和策略。
這些發現對于理解心血管和代謝疾病的發育起源具有重要意義。Grb10a基因的敲低不僅影響了斑馬魚的胚胎生長和代謝率,還導致了成年后長期的生理和代謝變化。這些結果支持了健康和疾病的發育起源理論(DOHaD),即成年期的疾病可能起源于胚胎期的發育變化。通過在斑馬魚模型中研究Grb10a基因的作用,研究人員為人類心血管和代謝疾病的預防和治療提供了新的靶點和策略。
【案例2】TDP-43基因突變對斑馬魚運動功能的影響
在一項由麥吉爾大學(McGill University)和蒙特利爾大學(University of Montreal)聯合開展的研究中,科學家們利用斑馬魚模型研究其神經退行性疾病研究中的潛在價值。
研究人員使用斑馬魚游泳呼吸儀精確地記錄斑馬魚在不同水流速度下的表現,記錄其最大游泳速度(Umax)。此外,實驗還結合了自由游泳實驗,利用相機記錄斑馬魚在開放水域中的游泳行為,進一步分析其運動功能的變化。 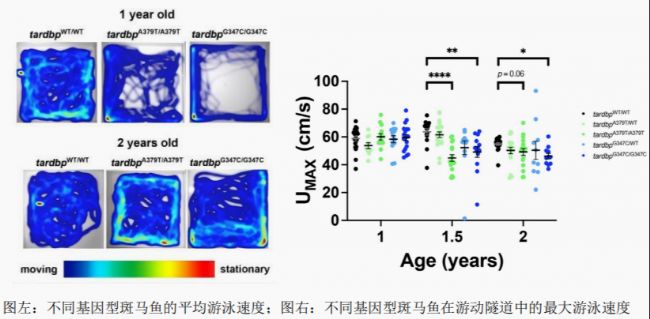 實驗結果顯示,攜帶TDP-43基因突變(A382T和G348C)的斑馬魚模型在1.5歲時表現出顯著的運動功能障礙,其游泳速度明顯減慢。這一發現表明,這些突變可能影響了斑馬魚的肌肉功能和神經控制,進而影響其呼吸代謝效率。此外,研究人員還觀察到這些模型斑馬魚在2.35至3歲時出現了大脊髓運動神經元的丟失,這與人類肌萎縮側索硬化癥(ALS)的病理特征相似。這些結果不僅揭示了TDP-43突變對斑馬魚運動功能的影響,還為理解ALS的發病機制提供了新的視角。
實驗結果顯示,攜帶TDP-43基因突變(A382T和G348C)的斑馬魚模型在1.5歲時表現出顯著的運動功能障礙,其游泳速度明顯減慢。這一發現表明,這些突變可能影響了斑馬魚的肌肉功能和神經控制,進而影響其呼吸代謝效率。此外,研究人員還觀察到這些模型斑馬魚在2.35至3歲時出現了大脊髓運動神經元的丟失,這與人類肌萎縮側索硬化癥(ALS)的病理特征相似。這些結果不僅揭示了TDP-43突變對斑馬魚運動功能的影響,還為理解ALS的發病機制提供了新的視角。
【參考文獻】
1. Evans B L, Garner T, De Leonibus C, et al. Transcriptome remodelling and changes in growth and cardiometabolic phenotype result following Grb10a knockdown in the early life of the zebrafish[J]. Cellular and Molecular Life Sciences, 2025, 82(1): 1-27.
2. Harji Z A, Rampal C J, Rodríguez E C, et al. TARDBP (TDP‐43) Knock‐in Zebrafish Display a Late‐Onset Motor Phenotype and Loss of Large Spinal Cord Motor Neurons[J]. Annals of Neurology, 2025.
3. Sun C C, Yang D, Chen Z L, et al. Exercise intervention mitigates zebrafish age‐related sarcopenia via alleviating mitochondrial dysfunction[J]. The FEBS Journal, 2023, 290(6): 1519-1530.
4. Beaver, L.M., Nkrumah-Elie, Y.M., Truong, L., Barton, C.L., Knecht, A.L., Gonnerman, G.D., Wong, C.P., Tanguay, R.L., and Ho, E. (2017). Adverse effects of parental zinc deficiency on metal homeostasis and embryonic development in a zebrafish model. The Journal of Nutritional Biochemistry 43, 78–87. https://doi.org/10.1016/j.jnutbio.2017.02.006.
5. Kim, S., Chung, A., Na, J.E., Lee, S.J., Jeong, S.H., Kim, E., Sun, W., Rhyu, I.J., and Park, H. (2019). Myelin degeneration induced by mutant superoxide dismutase 1 accumulation promotes amyotrophic lateral sclerosis. Glia. 23669. https://doi.org/10.1002/glia.23669.
6. Park, K.-H., Ye, Z., Zhang, J., Hammad, S.M., Townsend, D.M., Rockey, D.C., and Kim, S.-H. (2019). 3-ketodihydrosphingosine reductase mutation induces steatosis and hepatic injury in zebrafish. Sci Rep 9, 1138. https://doi.org/10.1038/s41598-018-37946-0.
7. Patton, E.E., Zon, L.I., and Langenau, D.M. (2021). Zebrafish disease models in drug discovery: from preclinical modelling to clinical trials. Nat Rev Drug Discov 20, 611–628. https://doi.org/10.1038/s41573-021-00210-8.
8. Yang, J., Shah, S., Olson, T., and Xu, X. (2016). Modeling GATAD1-Associated Dilated Cardiomyopathy in Adult Zebrafish. JCDD 3, 6. https://doi.org/10.3390/jcdd3010006.
北京易科泰提供生物醫學領域斑馬魚呼吸代謝及行為分析的全套技術方案,涵蓋斑馬魚成魚和魚卵、胚胎、幼魚的呼吸代謝測量、斑馬魚視頻跟蹤和行為分析及游泳能力評估,具體方案如下:
斑馬魚成魚呼吸代謝測量系統:提供4、8、12、16、20通道可選。





【案例1】早期生命階段Grb10a基因敲低對斑馬魚心血管和代謝的影響
英國曼徹斯特大學Bridget L. Evans團隊利用斑馬魚作為模型生物,揭示了Grb10a基因敲低對斑馬魚生長、代謝和心血管系統的長期影響,為理解心血管和代謝疾病的發育起源提供了新的視角。
研究人員采用間歇式呼吸代謝測量法,在28℃恒溫條件下實時記錄斑馬魚氧氣消耗率。結果顯示,Grb10a基因敲低的斑馬魚在胚胎階段表現出顯著的生長加速和代謝率提高,但心率降低。成年后,Grb10a基因敲低的斑馬魚表現出更高的最大氧氣消耗率和更大的有氧范圍,這表明其代謝能力顯著增強。此外,這些斑馬魚還表現出更高的空腹血糖水平,提示胰島素信號通能受到影響。

【案例2】TDP-43基因突變對斑馬魚運動功能的影響
在一項由麥吉爾大學(McGill University)和蒙特利爾大學(University of Montreal)聯合開展的研究中,科學家們利用斑馬魚模型研究其神經退行性疾病研究中的潛在價值。
研究人員使用斑馬魚游泳呼吸儀精確地記錄斑馬魚在不同水流速度下的表現,記錄其最大游泳速度(Umax)。此外,實驗還結合了自由游泳實驗,利用相機記錄斑馬魚在開放水域中的游泳行為,進一步分析其運動功能的變化。

【參考文獻】
1. Evans B L, Garner T, De Leonibus C, et al. Transcriptome remodelling and changes in growth and cardiometabolic phenotype result following Grb10a knockdown in the early life of the zebrafish[J]. Cellular and Molecular Life Sciences, 2025, 82(1): 1-27.
2. Harji Z A, Rampal C J, Rodríguez E C, et al. TARDBP (TDP‐43) Knock‐in Zebrafish Display a Late‐Onset Motor Phenotype and Loss of Large Spinal Cord Motor Neurons[J]. Annals of Neurology, 2025.
3. Sun C C, Yang D, Chen Z L, et al. Exercise intervention mitigates zebrafish age‐related sarcopenia via alleviating mitochondrial dysfunction[J]. The FEBS Journal, 2023, 290(6): 1519-1530.
4. Beaver, L.M., Nkrumah-Elie, Y.M., Truong, L., Barton, C.L., Knecht, A.L., Gonnerman, G.D., Wong, C.P., Tanguay, R.L., and Ho, E. (2017). Adverse effects of parental zinc deficiency on metal homeostasis and embryonic development in a zebrafish model. The Journal of Nutritional Biochemistry 43, 78–87. https://doi.org/10.1016/j.jnutbio.2017.02.006.
5. Kim, S., Chung, A., Na, J.E., Lee, S.J., Jeong, S.H., Kim, E., Sun, W., Rhyu, I.J., and Park, H. (2019). Myelin degeneration induced by mutant superoxide dismutase 1 accumulation promotes amyotrophic lateral sclerosis. Glia. 23669. https://doi.org/10.1002/glia.23669.
6. Park, K.-H., Ye, Z., Zhang, J., Hammad, S.M., Townsend, D.M., Rockey, D.C., and Kim, S.-H. (2019). 3-ketodihydrosphingosine reductase mutation induces steatosis and hepatic injury in zebrafish. Sci Rep 9, 1138. https://doi.org/10.1038/s41598-018-37946-0.
7. Patton, E.E., Zon, L.I., and Langenau, D.M. (2021). Zebrafish disease models in drug discovery: from preclinical modelling to clinical trials. Nat Rev Drug Discov 20, 611–628. https://doi.org/10.1038/s41573-021-00210-8.
8. Yang, J., Shah, S., Olson, T., and Xu, X. (2016). Modeling GATAD1-Associated Dilated Cardiomyopathy in Adult Zebrafish. JCDD 3, 6. https://doi.org/10.3390/jcdd3010006.
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com






