ADC抗體從靶點到決定抗體活性的IgG亞型選擇機制
文章來源公眾號:Antibody Insights 作者:longc12
不論 ADC 的毒素有多致命,連接子多精巧,若抗體無法精準識別腫瘤細胞,就好比再鋒利的箭也射不準靶。抗體藥物偶聯物(ADC)雖然在結構上分為三部分,但真正決定其“去哪打”的,是抗體識別的腫瘤靶點。
本期我們來聊聊:ADC 設計的第一步——選一個“好靶點”,以及決定抗體活性的 IgG 亞型選擇。
理想的ADC靶點長什么樣?
一個理想的 ADC 靶點,需要具備幾個重要特征:
- 腫瘤細胞高表達,正常組織低表達或不表達;
- 蛋白定位于細胞表面(非胞內抗原);
- 與抗體結合后,能有效內吞進入細胞內(便于釋放毒素);
- 表達穩定性高,不易隨時間或治療干預發生顯著變化;
- 適合全身藥物輸注后的暴露水平,不受屏障或免疫抑制強干擾;
- 在腫瘤細胞群中表達足夠普遍,避免出現“表達孤島”。
表達密度、內吞速率與異質性問題
- 靶點表達密度越高,抗體結合率越高,有利于毒素有效負載進入細胞。
- 內吞速率決定抗體被吸收入胞的效率,直接影響毒素釋放速度。
- 異質性——指同一腫瘤內的不同區域或不同患者之間的表達差異,是導致 ADC 治療失敗的重要原因。
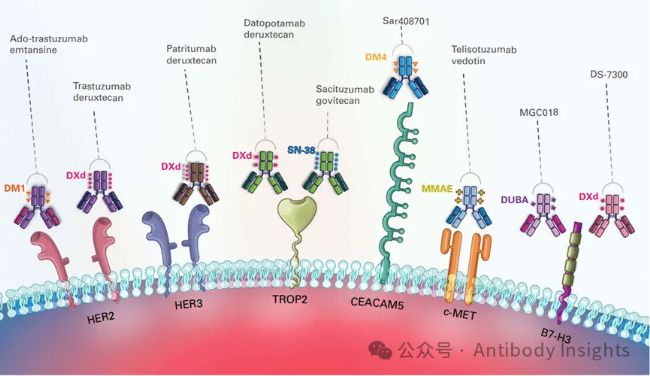
HER2、CD30、TROP2、FRα等靶點解析
- HER2:高表達乳腺癌等適合使用 T-DM1、Enhertu 等不同類型 ADC;
- CD30:在霍奇金淋巴瘤中高表達,內吞活躍,是 Adcetris 的理想靶點;
- TROP2:在上皮來源腫瘤(如 TNBC、NSCLC)廣泛表達,異質性相對小,是 Trodelvy 的成功基礎;
- FRα(葉酸受體α):在卵巢癌、非小細胞肺癌中表達,適合精準靶向,但需警惕正常組織表達。
IgG1 vs IgG4 vs 無Fc抗體:選擇決定機制
抗體的 Fc 區段影響其能否通過 Fc 受體觸發 ADCC(抗體依賴性細胞毒性)或 CDC(補體依賴性細胞毒性)。
- IgG1:能顯著激活ADCC/CDC,適用于希望抗體本身也能殺傷腫瘤的場景;
- IgG4:Fc功能較弱,更常用于需要減少免疫副作用的 ADC;
- 無Fc抗體或工程突變Fc:完全剝離免疫效應,僅作為定位與遞送工具。
是否需要Fc功能,與抗體本身是否也希望承擔部分“協同殺傷”作用有關。例如:
- Adcetris 的 IgG1 可發揮 CD30 靶點下的 ADCC;
- Kadcyla 為 IgG1,但因毒素釋放后殺傷力強,Fc作用相對次要;
- 多數新一代 ADC 傾向于弱化 Fc 功能以降低免疫相關毒副作用。
從“一個靶點”走向“多個靶點”:雙抗與靶點組合策略
為了克服異質性與抗原逃逸問題,一些團隊開始探索雙靶點策略:
- 雙抗ADC(bispecific ADC):抗體可同時識別兩個抗原,提高在復雜腫瘤環境中的結合概率;
- 靶點+環境響應機制:配合腫瘤特有的酶、高還原環境,增強毒素釋放的空間精準性。
總結:ADC設計的第一步,是找準那扇“能被敲開的門”
一個成功的ADC,必須從一個“能進去的入口”開始。腫瘤靶點的選擇,決定了抗體如何進入腫瘤、毒素釋放后能否生效,也決定了藥物治療的范圍、深度與安全性。而抗體亞型的選擇,決定了它只是“搬運工”,還是“協同作戰者”。
標簽:
ADC抗體
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com






