MASLD/MASH治療靶點PNPLA3的介紹及相關小鼠模型
代謝相關脂肪性肝病(metabolic associated steatotic liver disease,MASLD),原稱為非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD),是一種以肝臟脂肪蓄積為特征的疾病,已成為全球最常見的慢性肝病,影響著全球約25%的人口。其中20-30%的MASLD患者會發展為更為嚴重的代謝相關脂肪性肝炎(MASH),意味著全球約有5-7.5%的人口可能患有MASH。
2008年,Romeo等通過全基因組關聯分析(GWAS)發現PNPLA3基因SNP位點rs738409的C/G突變(對應PNPLA3蛋白第148位氨基酸148I、148M)與肝臟脂肪沉積相關,GG突變人群肝臟脂肪水平是其他人群的2倍[1]。此后,多篇文章研究反復驗證PNPLA3 I148M與MASLD密切相關。
PNPLA3概述
PNPLA3(patatin-like phospholipase domain containing 3)基因編碼一種稱為adiponutrin的蛋白質,主要在肝臟和脂肪組織中表達,具有甘油三酯水解酶和乙酰輔酶A依賴性溶血甘油三酯酰基轉移酶活性,在脂質代謝中發揮著重要調控作用。
以往較為流行的假說有兩種,一種認為PNPLA3作為一種甘油三酯水解酶,148M突變會導致其活性下降,從而減少甘油三酯的水解,即功能缺失(loss-of-function)[2];另一種假說認為PNPLA3 148M突變會破壞PNPLA3的泛素化和蛋白酶體降解,最終導致蛋白在脂滴上積累,形成“占位效應”,即功能獲得(gain-of-function)[3]。最新的研究發現[4],PNPLA3可以與肝臟中最重要的甘油三酯水解酶ATGL競爭其激活因子ABHD5,從而抑制肝臟中ATGL介導的脂質水解。正常情況下,PNPLA3的表達隨著食物攝取而增高,在饑餓狀態下則會快速降解。PNPLA3 148M 突變導致PNPLA3的泛素化降解減少,從而富集在脂滴表面,持續抑制ATGL的活性,導致肝臟中脂質的累積。最終驅動肝細胞氣球樣變、免疫細胞浸潤及星狀細胞活化,形成脂肪性肝炎-纖維化級聯反應。
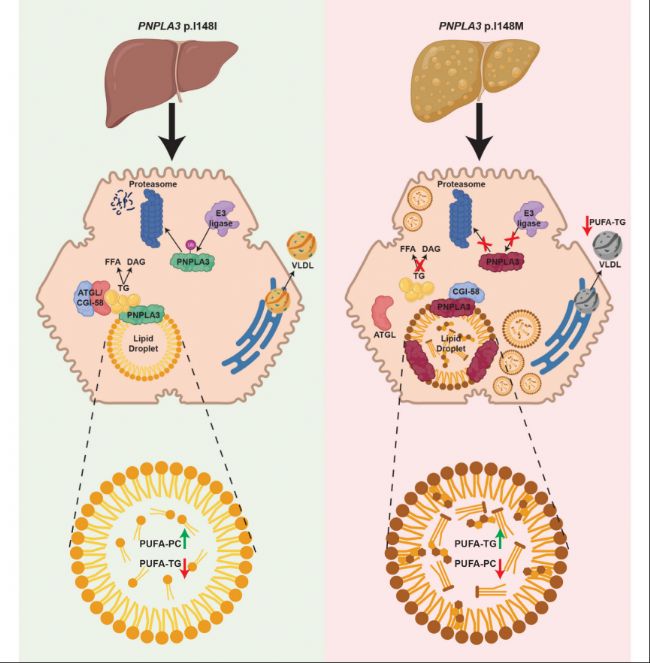
圖1. PNPLA3 I148M 遺傳變異與肝細胞脂肪肝病關聯機制示意圖[5]
靶向PNPLA3治療策略
PNPLA3 I148M突變作為MASLD的治療靶點,包括基因沉默、蛋白降解及小分子抑制策略,已成為全球肝病新藥研發的前沿焦點。
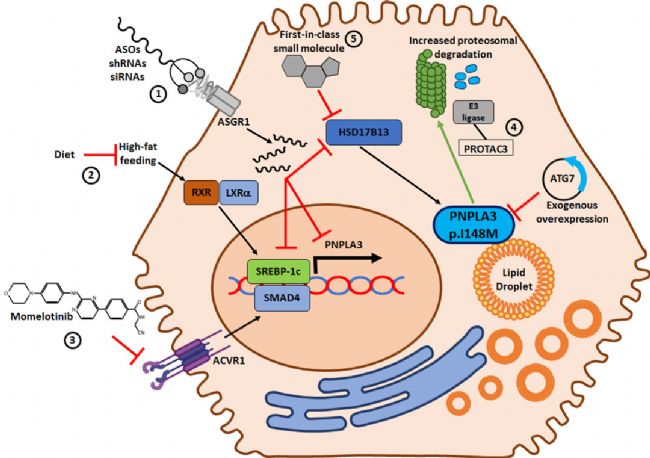
圖2. 潛在PNPLA3治療策略示意圖[5]
寡核苷酸藥物:通過RNA干擾(如反義寡核苷酸、siRNA)降低PNPLA3突變蛋白表達,可改善肝臟脂肪變性和炎癥。阿斯利康最近公布了AZD2693注射液的最新結果:AZD2693能有效降低肝臟 PNPLA3 mRNA(−89%)和肝脂滴上的蛋白質水平。在臨床應用上,總體耐受性良好,沒有出現因不良事件導致停藥的情況,也未發生與治療相關的嚴重不良事件。
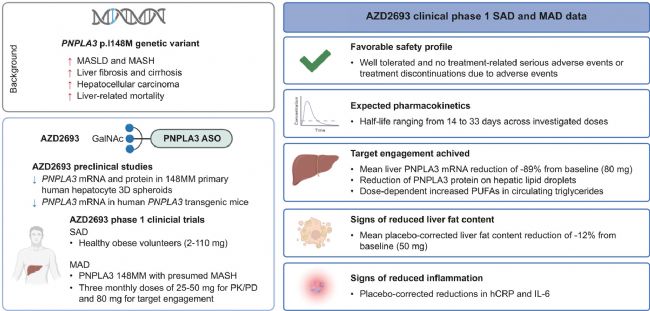
圖3. AZD2693臨床結果概述[6]
小分子藥物:輝瑞的PF-07853578是一種靶向PNPLA3 I148M突變體的小分子共價抑制劑,通過分子氨基甲酸酯基團與 PNPLA3 I148M 變體共價結合,促使突變蛋白從脂滴中清除,并進一步通過蛋白酶體途徑降解致病蛋白。目前,PF-07853578已完成了1期臨床試驗(NCT05890105)。
蛋白降解:盡管目前尚無基于PROTAC(蛋白水解靶向嵌合體)技術的藥物,但一項關鍵臨床前研究成功開發了靶向PNPLA3的降解劑PROTAC 3。該分子結構包含兩個關鍵域:E3泛素連接酶招募域和靶蛋白結合域。結果表明,在表達人源PNPLA3 148M突變蛋白的小鼠肝臟中,PROTAC 3處理顯著降低突變蛋白水平,并改善了與突變蛋白表達相關的脂肪肝病。
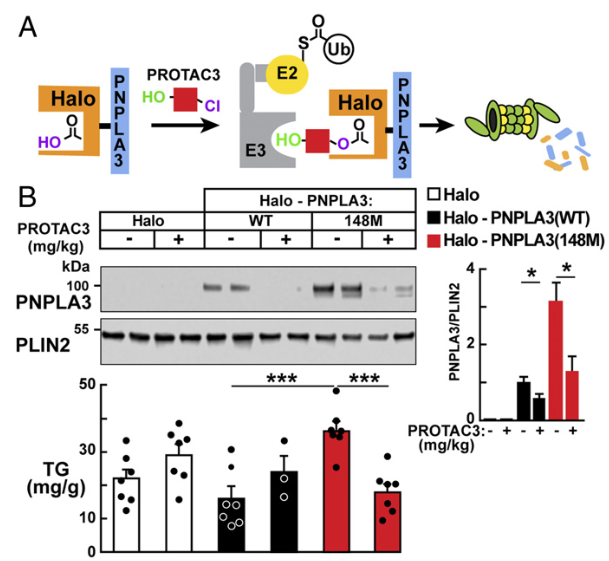
圖4. PROTAC介導的Halo-PNPLA3(148M)蛋白降解顯著降低肝臟甘油三酯[7]
PNPLA3靶點藥物研發現狀
盡管目前全球尚未有靶向PNPLA3的藥物獲批上市,但該靶點因其在MASLD致病機制中的核心地位,已成為肝病領域最具潛力的突破方向之一。現有研發管線高度聚焦于基因特異性干預策略,其中siRNA/ASO等小核酸藥物通過精準靶向PNPLA3 I148M突變等位基因,顯著降低致病蛋白表達,已占據臨床開發的主導地位。這種積極布局凸顯出PNPLA3靶點的巨大市場潛力。
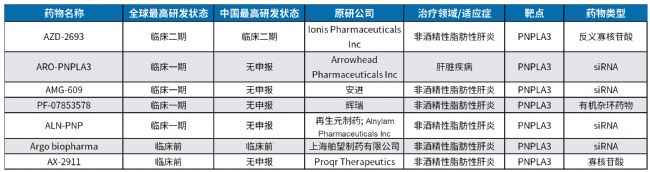
表1. 部分靶向PNPLA3靶點藥物研發進展
南模生物相關小鼠模型
南模生物長期致力于藥物靶點人源化模型研究領域,針對PNPLA3開發了一系列人源化小鼠模型,可用于MASLD臨床前研究和藥效評價。
表2. PNPLA3相關靶點人源化小鼠
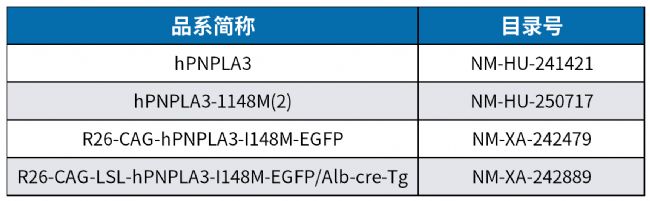
Smagris等[8]人的研究中指出,僅在高糖飲食(high-sucrose diet,HSD)誘導下,PNPLA3I148M/I148M小鼠出現明顯的脂肪肝表型。基于此,南模生物構建了HSD誘導的肝臟特異性過表達人源PNPLA3 I148M模型(目錄號:NM-XA-242889),該模型表現出類人的脂肪肝特征,在高糖誘導下TG、T-CHO含量顯著增加,并伴隨脂肪變性、炎癥浸潤及纖維化。
此外,我們也在肝臟特異性過表達人源PNPLA3 I148M模型上通過GAN飲食誘導構建了MASH模型。
以上模型均適用于MASLD/MASH發病機制研究、靶向PNPLA3的新藥藥效評價及肝病治療策略開發。
以HSD誘導的肝臟脂肪變性為例:
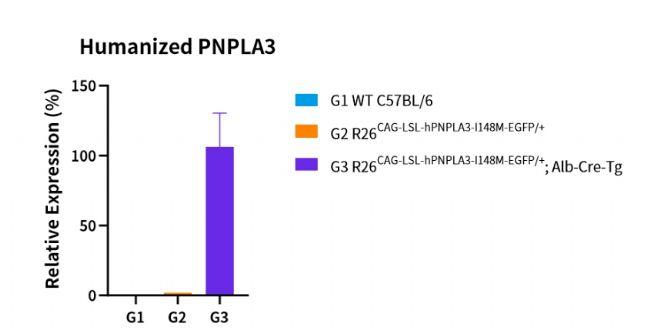
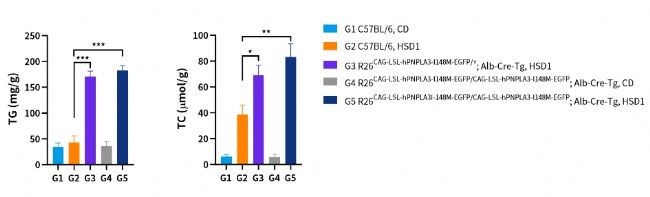
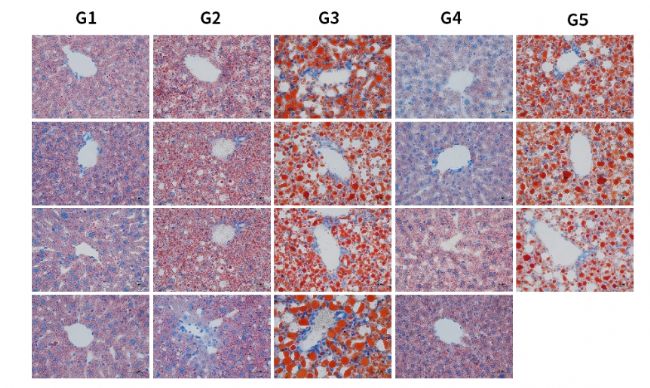
圖6. HSD誘導6周后各組小鼠肝臟中甘油三酯(TG)和總膽固醇(T-CHO)含量。結果顯示,HSD飲食誘導下,肝臟特異性過表達hPNPLA3 I148M小鼠TG、T-CHO含量顯著增加。
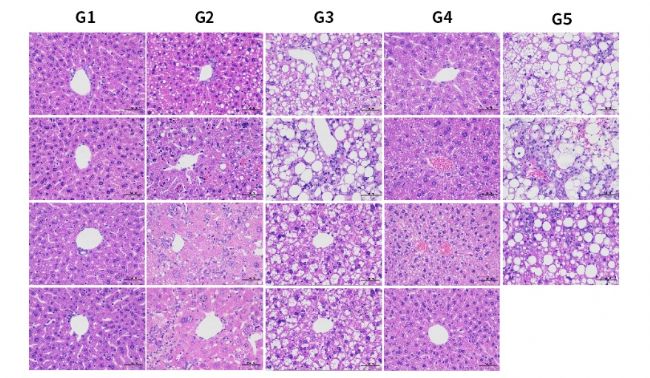
圖7. HSD誘導6周后各組小鼠H&E染色代表圖。結果顯示,HSD飲食誘導下,肝臟特異性過表達hPNPLA3 I148M小鼠出現明顯脂肪空泡(G3,G5)。
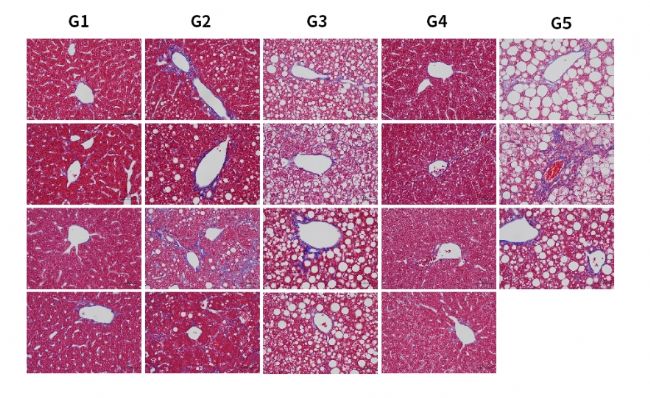
圖8. HSD誘導6周后各組小鼠Masson染色代表圖。結果顯示,HSD飲食誘導下,肝臟特異性過表達hPNPLA3 I148M小鼠出現明顯纖維化(G3,G5)。
Reference:
1. Romeo S, Kozlitina J, Xing C, et al. Genetic variation in PNPLA3 confers susceptibility to nonalcoholic fatty liver disease. Nat Genet. 2008;40(12):1461-1465.
2. Pingitore P, Pirazzi C, Mancina RM, et al. Recombinant PNPLA3 protein shows triglyceride hydrolase activity and its I148M mutation results in loss of function. Biochim Biophys Acta. 2014;1841(4):574-580.
3. BasuRay S, Wang Y, Smagris E, Cohen JC, Hobbs HH. Accumulation of PNPLA3 on lipid droplets is the basis of associated hepatic steatosis. Proc Natl Acad Sci U S A. 2019;116(19):9521-9526.
4. Wang Y, Hong S, Hudson H, et al. PNPLA3(148M) is a gain-of-function mutation that promotes hepatic steatosis by inhibiting ATGL-mediated triglyceride hydrolysis. J Hepatol. 2025;82(5):871-881.
5. Cherubini A, Casirati E, Tomasi M, Valenti L. PNPLA3 as a therapeutic target for fatty liver disease: the evidence to date. Expert [5] Opin Ther Targets. 2021;25(12):1033-1043.
6. Armisen J, Rauschecker M, Sarv J, et al. AZD2693, a PNPLA3 antisense oligonucleotide, for the treatment of MASH in 148M homozygous participants: Two randomized phase I trials. J Hepatol. 2025;83(1):31-42.
7. BasuRay S, Wang Y, Smagris E, Cohen JC, Hobbs HH. Accumulation of PNPLA3 on lipid droplets is the basis of associated hepatic steatosis. Proc Natl Acad Sci U S A. 2019;116(19):9521-9526.
8. Opin Ther Targets. 2021;25(12):1033-1043.Smagris E, BasuRay S, Li J, et al. Pnpla3I148M knockin mice accumulate PNPLA3 on lipid droplets and develop hepatic steatosis. Hepatology. 2015;61(1):108-118.
關于我們
上海南方模式生物科技股份有限公司(Shanghai Model Organisms Center, Inc.,簡稱"南模生物"),成立于2000年9月,是一家上交所科創板上市高科技生物公司(股票代碼:688265),始終以編輯基因、解碼生命為己任,專注于模式生物領域,打造了以基因修飾動物模型研發為核心,涵蓋多物種模型構建、飼養繁育、表型分析、藥物臨床前評價等多個技術平臺,致力于為全球高校、科研院所、制藥企業等客戶提供全方位、一體化的基因修飾動物模型產品解決方案。






