關于揭示DUSP18調(diào)控結直腸癌免疫逃逸分子機制的研究
結直腸癌(CRC)是全球發(fā)病率第三高、致死率第二高的惡性腫瘤。目前,僅有15%的CRC患者能夠從免疫檢查點阻斷(ICB)治療中獲益。一個重要原因在于腫瘤細胞對其新陳代謝進行重編程以產(chǎn)生專門的代謝物,這些代謝物既能促進自身的生長,又能促進腫瘤免疫逃避,即腫瘤以促進浸潤CD8+ T細胞耗竭和失活的方式重塑其微環(huán)境,從而導致“免疫逃逸”的發(fā)生。然而,這些功能之間的關系尚不清楚。
2024年7月,武漢大學生命科學學院李友軍教授團隊在國際主流學術期刊《Nature communications》在線發(fā)表了題為“Inhibition of DUSP18 impairs cholesterol biosynthesis and promotes anti-tumor immunity in colorectal cancer”的研究論文。武漢大學生命科學學院李友軍教授為該論文的通訊作者,生命科學學院博士研究生周小軍為該論文的第一作者。武漢大學生命科學學院與醫(yī)學研究院為該研究提供了技術和平臺支持。
該研究結直腸癌免疫逃逸這一現(xiàn)象為切入點,揭示了DUSP18作為新的調(diào)控膽固醇生物合成的因子,來促進腫瘤微環(huán)境中羊毛甾醇的積累進而限制T細胞的活化,最終促進CRC的免疫逃逸。

研究材料
在這項研究中,研究人員構建了腸上皮細胞Dusp18條件性敲除小鼠模型(其中Dusp18條件性敲除小鼠模型由賽業(yè)生物提供)。體外研究則采用了Dusp18-KD的MC38和HCT116的細胞系
技術方法
研究人員采用了多種技術,包括CRISPR篩選、小鼠模型、細胞培養(yǎng)、流式細胞術、免疫組化、蛋白質(zhì)、單細胞分析,轉(zhuǎn)錄組學和代謝組學等。
技術路線

研究結果
1.sgRNA文庫篩選鑒定DUSP18促進CRC免疫逃逸
研究人員通過sgRNA文庫篩選,并尋找與細胞毒性T淋巴細胞(CTL)評分負相關的交集基因,其中最值得注意的是Dusp18。與正常結直腸組織相比,CRC樣本中DUSP18 mRNA的表達水平也較高。在DUSP18 mRNA低表達的CRC患者中,CTL評分高的患者生存率更高,而DUSP18 mRNA高表達且CTL評分高的患者生存率更低。為了確定抑制Dusp18是否會影響T細胞介導的抗腫瘤功能,研究人員在MC38 CRC細胞和表達卵清蛋白(OVA)的B16黑色素瘤(B16-OVA)細胞中進行shRNA介導的Dusp18抑制。敲低Dusp18并不影響腫瘤細胞在體外的增殖或腫瘤在免疫缺陷裸鼠體內(nèi)的生長。然而,抑制Dusp18確實會影響免疫功能正常小鼠中腫瘤生長并延長其生存時間,而清除CD8+ T細胞則可以消除敲低Dusp18引起的腫瘤生長劣勢。因此,上述結果表明,DUSP18通過CD8+ T細胞依賴的方式來促進CRC的免疫逃避。

圖1 抑制Dusp18表達可增強腫瘤浸潤性CD8+T細胞的功能
2.抑制DUSP18會影響膽固醇的生物合成
為了確定抑制DUSP18表達抗腫瘤免疫的分子機制,研究人員對shCtrl和shDusp18 MC38細胞進行RNA-seq分析。GO和KEGG分析顯示,shDusp18細胞中下調(diào)的基因主要是參與膽固醇生物合成及其下游代謝途徑。基因集富集分析(GSEA)也顯示,與膽固醇穩(wěn)態(tài)相關的基因在對照細胞中呈正富集。隨后通過進一步證實,在shDusp18 MC38細胞和CKO(腸道上皮特異性DUSP18缺失的小鼠)腫瘤組織中(由賽業(yè)生物構建的小鼠),膽固醇生物合成基因的mRNA表達和蛋白水平下降。此外,研究人員還對shCtrl和shDUSP18人CRC HCT116細胞進行RNA-seq分析,以驗證在小鼠MC38細胞中的結果。GO、KEGG和GSEA分析均顯示,抑制DUSP18可顯著降低膽固醇生物合成途徑相關基因的表達。總之,上述研究結果都支持DUSP18通過調(diào)節(jié)細胞膽固醇的生物合成來調(diào)控腫瘤相關的免疫環(huán)境。
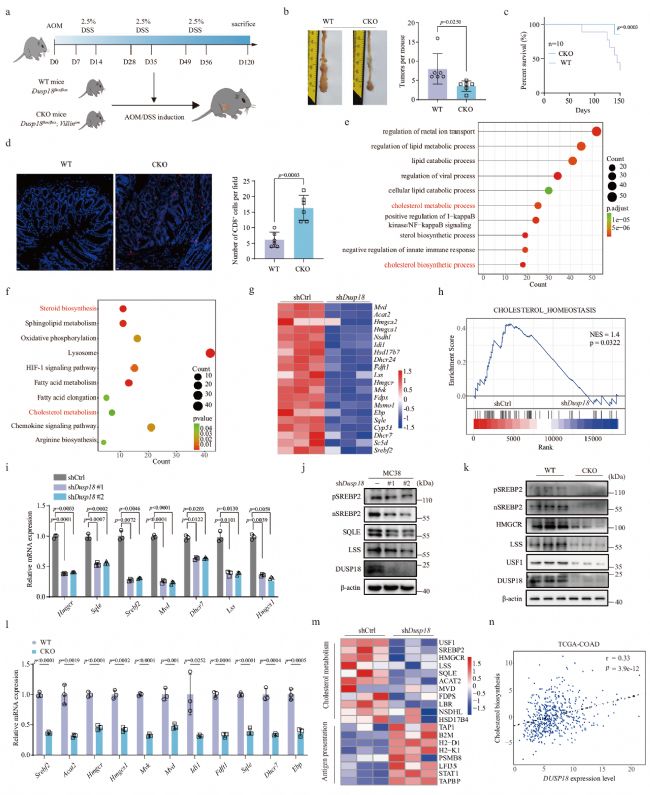
圖2 抑制Dusp18表達降低膽固醇的生物合成
3.TME中的腫瘤細胞來源的羊毛甾醇促進CD8+T細胞失活
研究人員后續(xù)猜想膽固醇生物合成途徑中的一種或多種中間產(chǎn)物可能是抑制CD8+T細胞功能的原因。利用膽固醇代謝組學測定MC38腫瘤間質(zhì)中這些中間產(chǎn)物代謝水平,發(fā)現(xiàn)下調(diào)幅度最大的是羊毛甾醇(40%)。為了直接確定其相關性,研究人員用羊毛甾醇處理原代CD8+T細胞,結果顯示羊毛甾醇以劑量依賴的方式降低CD8+T細胞的活化。據(jù)報道,羊毛甾醇可促進HMG-CoA還原酶(HMGCR)的泛素化和蛋白酶體降解,而HMGCR是甲羥戊酸途徑中的限速酶。與此一致的是,研究人員發(fā)現(xiàn)在小鼠原代CD8+T細胞細胞中,羊毛甾醇處理降低HMGCR蛋白水平,進一步抑制小鼠原代CD8+T細胞中的KRAS蛋白豐度以及ERK和AKT信號傳導。這些結果表明,腫瘤來源的羊毛甾醇作為一種免疫抑制代謝物,通過降低HMGCR蛋白水平從而影響KRAS-ERK信號傳導來限制CD8+T細胞的細胞毒性功能。

圖3 Dusp18驅(qū)動的TME中的羊毛甾醇促進CD8+T細胞失活
4.DUSP18 在CRC患者中過表達,可預測免疫荒漠
研究人員還進一步利用CRC臨床樣本驗證了本文發(fā)現(xiàn)的信號軸在腫瘤=組織中高度上調(diào),也基于單細胞數(shù)據(jù)分析發(fā)現(xiàn)DUSP18的表達與腫瘤浸潤CD8 T細胞功能之間的相關性。

圖4 DUSP18 在 CRC 患者中過表達,可預測免疫荒漠
總結

圖5 DUSP18在促進免疫逃避中的代謝作用[1]
該研究結果揭示了DUSP18在促進免疫逃避中的代謝作用。研究人員發(fā)現(xiàn)DUSP18抑制和免疫檢查點阻斷聯(lián)合使用可增強CRC小鼠模型中CD8+ T細胞的抗腫瘤活性。這提示了一種潛在的聯(lián)合治療形式,在靶向代謝和免疫因子的基礎上激活并維持CD8+ T細胞的抗腫瘤活性。
參考文獻:
Zhou, X., Wang, G., Tian, C., Du, L., Prochownik, E.V., and Li, Y. (2024). Inhibition of DUSP18 impairs cholesterol biosynthesis and promotes anti-tumor immunity in colorectal cancer. Nature Communications 15, 5851. 10.1038/s41467-024-50138-x.






