抗體偶聯藥物的發展歷程、作用機制及相關小鼠模型的介紹
在當今創新藥物百花齊放的時代,ADC(抗體偶聯藥物)領域依然熱度不減,持續成為腫瘤治療領域備受矚目的明星賽道。近期多項臨床進展再次印證了這一趨勢。
近期閉幕的2025年世界肺癌大會(WCLC)上,恒瑞醫藥與合作伙伴IDEAYA Biosciences以口頭報告形式公布了其DLL3 ADC藥物SHR-4849(IDE849)用于治療復發性小細胞肺癌的首次人體I期臨床試驗數據,引發行業廣泛關注。
復宏漢霖HLX43同步亮相WCLC口頭報告環節,HLX43的I期臨床數據同樣亮相WCLC口頭報告環節,該藥物治療EGFR野生型非鱗狀非小細胞肺癌的客觀緩解率(ORR)達到46.7%,其中2.5mg/kg劑量組ORR更高達60%,展現出顯著的臨床獲益。
除了上述案例,諸如DS-8201(Enhertu)在HER2低表達乳腺癌、Padcev在尿路上皮癌等ADC藥物取得的突破,也持續推動該領域向前發展。
ADC藥物發展概述
ADC藥物全稱為抗體偶聯藥物(antibody-drug conjugate, ADC)包括:負責選擇性識別腫瘤細胞表面抗原的抗體(Antibody),負責殺死腫瘤細胞的藥物有效載荷細胞毒性藥物(Payload)以及有效連接抗體和有效載荷的連接子(Linker)。
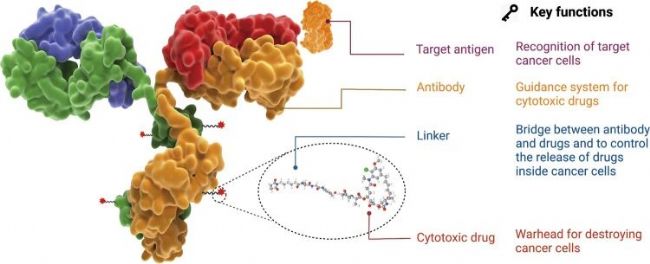
圖1. ADC藥物的結構和特性[1]
ADC藥物的發展歷程經歷了三個主要階段:
第一代ADC:以吉妥珠單抗奧唑米星(Gemtuzumab ozogamicin)為代表,2000年獲FDA批準用于急性髓系白血病(AML),成為全球首款ADC藥物。但因連接子不穩定導致脫靶毒性、治療窗窄及免疫原性強等問題,于2010年撤市,后于2017年通過調整給藥方案重新獲批。
第二代ADC:采用人源化抗體降低免疫原性,選用更強效載荷(如MMAE、DM1)及更穩定連接子。以維布妥昔單抗(Brentuximab vedotin)和恩美曲妥珠單抗(T-DM1)為代表。
第三代ADC:在抗體工程、連接子技術和載荷多樣性實現突破性進展。以德曲妥珠單抗(Trastuzumab deruxtecan, DS-8201)為代表,該藥物于2019年獲FDA批準用于HER2陽性乳腺癌,臨床獲益顯著。
ADC藥物作用機制
ADC協同發揮了“特異”靶向作用和“高效”殺傷癌細胞的效果。
其作用機制可概括為以下關鍵步驟:
系統遞送:ADC藥物經靜脈注射進入全身循環;
靶向結合:抗體單元特異性識別并結合腫瘤細胞表面抗原;
內吞轉運:ADC-抗原復合物通過Clathrin或Caveolin蛋白介導的內吞作用進入細胞,依次形成初級內體(Early Endosome)和次級內體(Late Endosome);
毒素釋放:次級內體與溶酶體(Lysosome)融合后裂解釋放細胞毒素(注:含可裂解連接子(Linker)的ADC可能在初級/次級內體中經水解、蛋白酶或還原作用提前釋放毒素);
細胞殺傷:毒素通過破壞DNA復制或微管組裝等關鍵機制誘導腫瘤細胞凋亡;
旁觀者效應:具有膜滲透性的毒素可擴散至鄰近腫瘤細胞,通過直接殺傷和改變腫瘤微環境(TME)雙重途徑增強整體療效。
該機制使ADC藥物如同“生物導彈”般精準摧毀癌細胞,顯著提高治療窗口(Therapeutic Window),同時降低脫靶毒性風險。
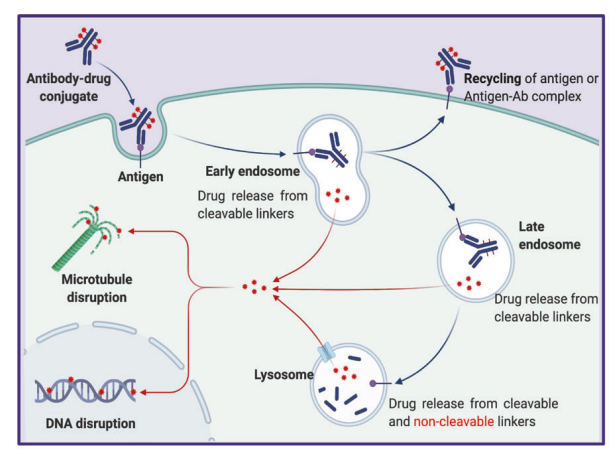
圖2. ADC的主要作用機制[2]
其他作用機制:
除上述主要作用機制外,ADC還能通過抗體依賴性細胞毒性(ADCC)、抗體依賴性細胞吞噬作用(ADCP)和/或補體依賴性細胞毒性(CDC)來激活免疫系統,達到抑制腫瘤的效果。一些ADC的抗體Fab段可與病毒感染細胞或腫瘤細胞的抗原表位結合,而 FC段則與殺傷細胞(NK 細胞、巨噬細胞等)表面的 FCR 結合,從而介導直接殺傷效應。
此外,ADC中的抗體成分可以特異性地與癌細胞的表位抗原結合,抑制抗原受體的下游信號轉導。例如,T-DM1的曲妥珠單抗可與癌細胞的HER2受體結合,阻斷HER2與HER1、HER3 或HER4形成異二聚體,從而抑制細胞生存和增殖的信號轉導通路(如 PI3K或MAPK),誘導細胞凋亡。
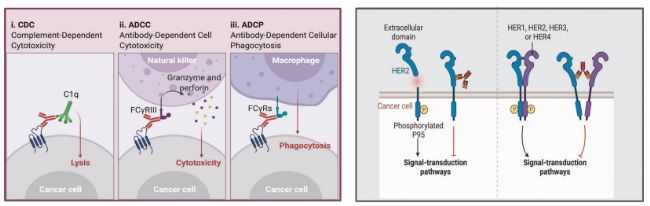
圖3. ADC的其他作用機制[2]
ADC藥物聯合治療策略
在癌癥治療領域,人們普遍認為結合多種作用機制的治療藥物,可以提高緩解腫瘤發展和治愈的可能性,特別是在面對腫瘤異質性的復雜性時,主要就是將 ADC 與不同的治療策略相結合,以解決腫瘤的耐藥性和/或增強 ADC 療法的效果。
1. ADC 聯合化療
臨床前和臨床研究已證明,將不同形式的化療與ADC相結合是克服耐藥性和取得良好治療結果的一種廣為接受的策略。
作用機制:化療和ADC具有協同作用,針對細胞周期的不同階段或調節腫瘤細胞表面抗原的表達。
2. ADC聯合放射治療
放療與ADC的聯合治療包括外放射治療與ADC和放射性核素抗體偶聯物 (Radionuclide antibody conjugates,RAC)的聯合治療。
作用機制:放療與ADC聯合應用的協同機制包括放療調節腫瘤細胞表面抗原的表達、ADC增加腫瘤細胞的放射敏感性,以及其他潛在機制,如影響腫瘤微環境(tumor microenvironment, TME)、血管通透性等。
3. ADC 聯合內分泌治療
內分泌治療是激素敏感性癌癥(例如乳腺癌和前列腺癌)的一種廣泛使用的治療方法,它通過阻斷激素合成或干擾刺激腫瘤細胞生長的激素起作用。
作用機制:ADC和內分泌治療藥物均可誘導細胞效應,共同阻礙腫瘤細胞存活和增殖。
4. ADC聯合分子靶向癌癥治療
靶向治療,包括單克隆抗體、酪氨酸激酶抑制劑(TKI)和抗血管生成藥物。
作用機制:分子靶向藥物(包括抗體)與ADC的協同作用涉及通過靶向腫瘤血管改善腫瘤內藥物輸送、調節腫瘤細胞表面抗原的表達、克服腫瘤內異質性和腫瘤耐藥性、合成致死等多種機制。
5. ADC 聯合免疫療法
越來越多的證據表明,ADCs會增加免疫治療藥物的療效,將免疫療法與ADC相結合是當前臨床實踐的趨勢。
作用機制:潛在機制多種多樣,包括 Fc介導的效應功能、啟動免疫原性細胞死亡(immunogenic cell death,ICD)、DC成熟、增強 T 細胞浸潤、強化免疫記憶以及表達免疫調節蛋白,如PD-L1和MHC。多項研究表明,ADC 在免疫功能正常的動物模型中的作用比在免疫缺陷模型中更強,具有顯著的免疫調節能力。
ADC藥物研發進展
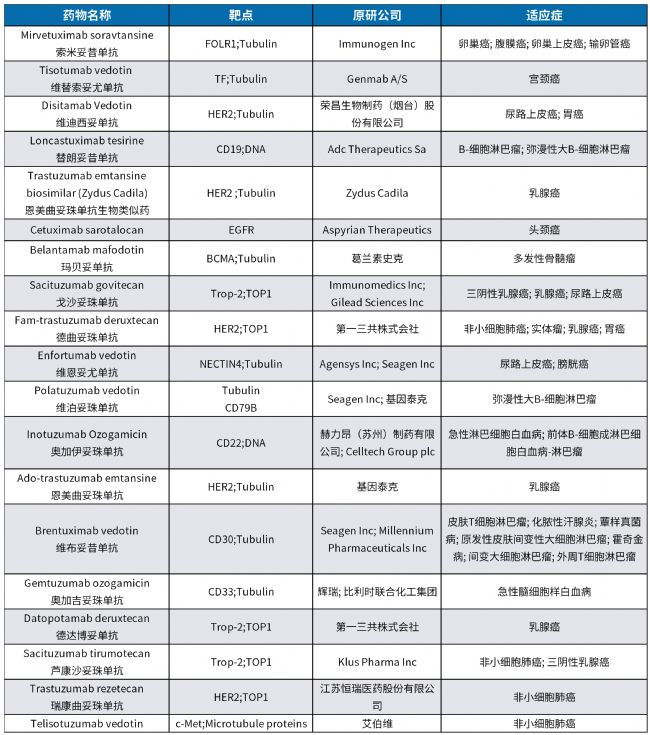
目前,全球范圍內已有超過19款ADC藥物獲批用于臨床治療(見下表),同時還有超過1000個ADC候選藥物正處于不同研發階段,顯示出這一領域持續強勁的創新活力。ADC研發至今仍是全球創新藥中最為活躍和增長最快的方向之一。其中,進入臨床階段的ADC藥物已超過200個,覆蓋從I期至III期的完整研發流程。在靶點選擇方面,當前ADC藥物呈現出顯著的“靶點聚集效應”:HER2、TROP2、EGFR和Claudin18.2這四大靶點占據主導地位,相關在研藥物合計占比超過50%。
表1. ADC上市藥物
在ADC藥物研發過程中,優質、可靠的動物模型是評價藥效和評估安全性的關鍵工具。南模生物依托全面而專業的抗腫瘤藥效評價平臺,建立了覆蓋數百種腫瘤模型的資源庫,可為企業與研發機構提供從候選藥物篩選、藥理藥效評價到藥代動力學研究的一體化、全流程創新服務,助力ADC藥物高效轉化與臨床開發。
南模生物相關小鼠模型
CDX和PDX模型
為支持ADC藥物的研發,南模生物開發了多種臨床前研究動物模型,包括針對不同癌癥類型的CDX和PDX模型。
公司建立了一系列成熟的免疫缺陷小鼠品系,如BALB/c-Nude、M-NSG等及其衍生品系,并擁有超過200種CDX細胞系資源,包括神經系統、內分泌系統、消化系統等多組織器官,覆蓋包括胰腺癌、肺癌、胃癌及急性髓系白血病(AML)等多種高發與罕見腫瘤,能為ADC藥物的作用機制驗證與臨床前評價提供全面支持。

鈣黏蛋白17(CDH17)是一種膜細胞黏附分子,其在CRC及其他多種胃腸道(GI)癌癥中頻繁過表達,而在正常腸組織與胰腺導管中表達有限。這種腫瘤與正常組織間的差異表達特征,使其成為胃腸道癌癥(尤其是CRC)抗體偶聯藥物(ADC)開發的理想靶點。
南模生物在BALB/c Nude小鼠上接種人結腸癌腫瘤細胞系COLO 205細胞系,構建CDX異種移植瘤模型,可用于靶向CDH17 ADC藥物的藥效評價。

圖4. 靶向CDH17的ADC藥物抑制人結腸癌腫瘤細胞系COLO 205。A.每組小鼠的相對腫瘤體積變化曲線;B.體重。
同系移植瘤模型
在ADC藥物與免疫療法聯用的臨床前評價體系中,南模生物構建了涵蓋多靶點的人源化同系移植瘤模型,這些模型具有健全的免疫系統,為聯合治療方案提供了理想的體內評估工具。

表2. ADC靶點人源化小鼠
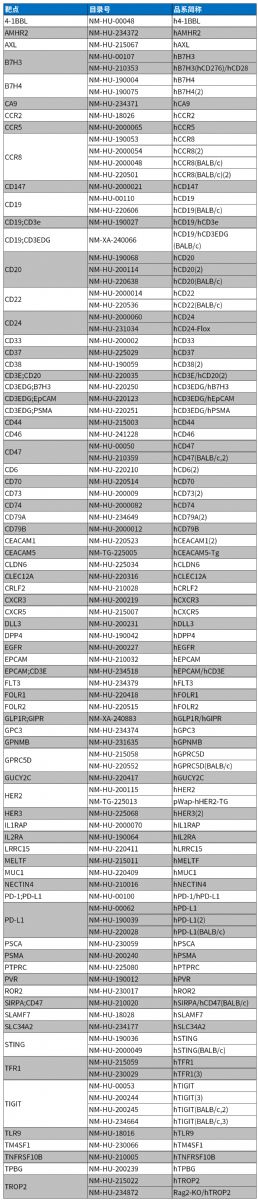
案例一:靶向NECTIN4 ADC藥效評價
在C57BL/6背景的hPD-1小鼠上接種南模生物自主研發的MC38-hNectin4細胞系,構建同系移植瘤模型,用于靶向NECTIN4 ADC藥物的抗腫瘤藥效評價。
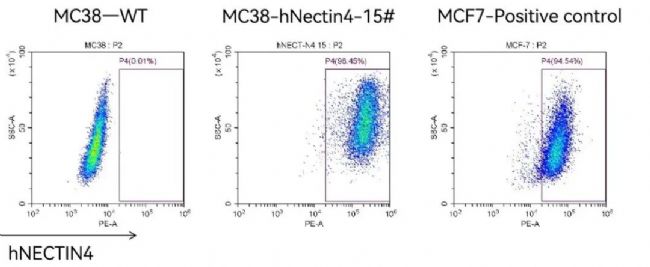
圖5.流式檢測MC38-hNectin4人源化細系中人源 NECTIN4的表達。

圖6. 靶向NECTIN4的ADC藥物抑制MC38-hNectin4腫瘤細胞進展的體內藥效 (宿主小鼠為C57BL/6背景的hPD-1小鼠)。A.每組小鼠的相對腫瘤體積變化曲線;B.體重。
案例二:靶向B7H3 ADC藥效評價
在C57BL/6背景的hPD-1小鼠上接種南模生物自主研發的MC38-hB7H3細胞系,構建同系移植瘤模型,用于靶向B7H3 ADC藥物的藥效評價。
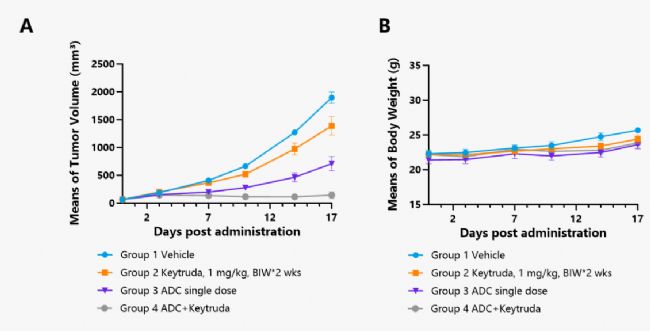
圖7. 靶向B7H3的ADC藥物抑制MC38-hB7H3腫瘤細胞進展的體內藥效 (宿主小鼠為C57BL/6背景的hPD-1小鼠)。A.每組小鼠的相對腫瘤體積變化曲線;B.體重。
案例三:靶向Trop2 ADC藥效評價
在C57BL/6背景的hPD-1小鼠上接種南模生物自主研發的MC38-hTrop2/hPD-L1細胞系,構建同系移植瘤模型,用于靶向Trop2 ADC藥物的藥效評價。
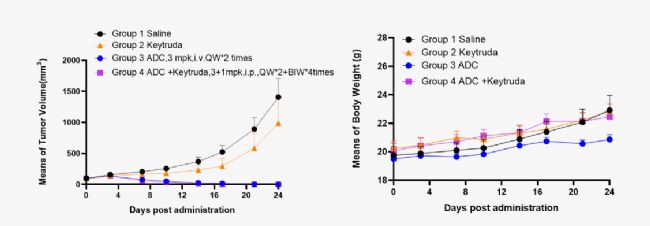
圖8. 靶向Trop2的ADC藥物抑制MC38-hTrop2/hPD-L1腫瘤細胞進展的體內藥效 (宿主小鼠為C57BL/6背景的hPD-1小鼠)。A.每組小鼠的相對腫瘤體積變化曲線;B.體重。
案例四:靶向HER2 ADC藥效評價
在C57BL/6小鼠上接種南模生物自主研發的MC38-hHER2細胞系,構建同系移植瘤模型,用于靶向HER2 ADC藥物的藥效評價。
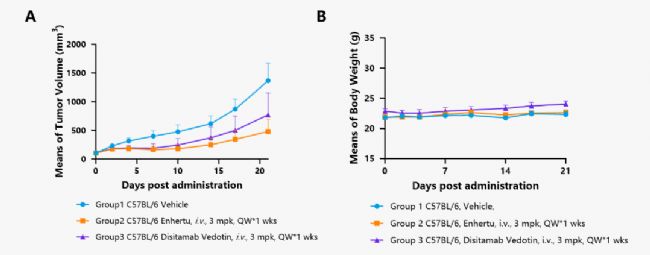
圖9. 靶向HER2的ADC藥物抑制MC38-hHER2腫瘤細胞進展的體內藥效 (宿主小鼠為C57BL/6鼠)。A.每組小鼠的相對腫瘤體積變化曲線;B.體重。
參考文獻:
1. Fu Z, Li S, Han S, Shi C, Zhang Y. Antibody drug conjugate: the "biological missile" for targeted cancer therapy. Signal Transduct Target Ther. 2022;7(1):93. Published 2022 Mar 22. doi:10.1038/s41392-022-00947-7
2. Wei Q, Li P, Yang T, et al. The promise and challenges of combination therapies with antibody-drug conjugates in solid tumors. J Hematol Oncol. 2024;17(1):1. Published 2024 Jan 4. doi:10.1186/s13045-023-01509-2
關于我們
上海南方模式生物科技股份有限公司(Shanghai Model Organisms Center, Inc.,簡稱"南模生物"),成立于2000年9月,是一家上交所科創板上市高科技生物公司(股票代碼:688265),始終以編輯基因、解碼生命為己任,專注于模式生物領域,打造了以基因修飾動物模型研發為核心,涵蓋多物種模型構建、飼養繁育、表型分析、藥物臨床前評價等多個技術平臺,致力于為全球高校、科研院所、制藥企業等客戶提供全方位、一體化的基因修飾動物模型產品解決方案。






