雙特異性抗體的作用機制及在重塑腫瘤靶向治療中的應用及挑戰
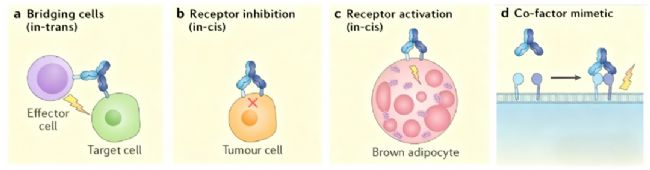
雙特異性抗體作為抗體工程技術的重要突破,其核心特征在于能夠同時識別兩個不同的抗原表位。從結構角度來看,這類抗體通過基因工程技術將兩個不同特異性的抗原結合域整合到單一分子框架中,形成了獨特的Y型或鏈狀結構。這種結構設計使得雙特異性抗體具備了傳統單克隆抗體無法實現的生物學功能,特別是在介導免疫細胞橋接和信號通路協同調控方面展現出獨特優勢。
在作用機制層面,雙特異性抗體主要通過三種模式發揮治療作用:首先是細胞橋接效應,通過一個結合域靶向腫瘤細胞表面抗原,另一個結合域連接免疫效應細胞,直接引導免疫細胞對靶細胞進行殺傷;其次是信號通路協同阻斷,同時抑制兩個不同的疾病相關信號通路,產生協同治療效應;第三是促進蛋白復合物形成,通過同時結合兩個不同靶點,引導功能性蛋白復合物的組裝,進而激活特定的生物學過程。
從分子動力學角度分析,雙特異性抗體的效力不僅取決于其對單個靶點的親和力,更依賴于兩個結合域之間的空間構象和相對取向。理想的雙特異性抗體應該確保兩個結合域能夠同時與各自的靶點結合,且不會產生空間位阻。這種結構優化需要綜合考慮抗體構象的柔韌性、連接區的長度和剛性,以及糖基化修飾對抗體結構的影響等多重因素。
二、雙靶點橋接機制如何增強抗腫瘤效能?
雙靶點橋接是雙特異性抗體最顯著的特征之一,其核心在于建立免疫效應細胞與靶細胞之間的物理連接。這種橋接機制能夠將細胞毒性T淋巴細胞或自然殺傷細胞直接導向腫瘤細胞,在局部形成免疫突觸,顯著增強特異性殺傷效率。研究顯示,通過雙特異性抗體介導的免疫細胞招募,其殺傷效率比依賴天然趨化因子梯度的方法提高數個數量級。
在實體瘤治療中,雙靶點橋接展現出獨特優勢。通過同時靶向腫瘤相關抗原和免疫檢查點分子,雙特異性抗體不僅能引導免疫細胞定位,還能解除腫瘤微環境的免疫抑制狀態。例如,同時靶向程序性死亡配體1和轉化生長因子β的雙特異性抗體,在臨床前研究中顯示出協同增強抗腫瘤免疫應答的能力。這種雙重作用機制有效克服了腫瘤微環境中的免疫抑制屏障。
從藥代動力學角度看,雙靶點橋接設計還能改善藥物在腫瘤組織的富集特性。借助兩個結合域與不同靶點的協同作用,雙特異性抗體在腫瘤部位的滯留時間顯著延長,同時加速了從循環系統的清除速度,這種特性有助于提高治療指數并降低系統性毒性。此外,通過優化結合親和力的平衡,可以確保雙特異性抗體優先結合同時表達兩個靶點的病變細胞,進一步提高治療特異性。
三、協同阻斷策略如何克服耐藥性問題?協同阻斷是雙特異性抗體的另一重要機制,其核心在于同時干預多個疾病相關的信號通路。在腫瘤治療領域,這種策略能有效應對單靶點藥物的耐藥性問題。通過同時抑制兩個不同但功能相關的信號通路,雙特異性抗體可以阻斷代償性通路的激活,這是單靶點治療產生耐藥的主要機制之一。
在生長因子受體信號網絡中,協同阻斷展現出顯著優勢。例如,同時靶向表皮生長因子受體和胰島素樣生長因子1受體的雙特異性抗體,能夠有效抑制由于單個受體信號抑制而引發的代償性激活現象。實驗研究表明,這種協同阻斷策略在多種耐藥腫瘤模型中均顯示出持續的治療效果,且能延緩獲得性耐藥的發生。
從信號轉導機制分析,協同阻斷的有效性源于其對信號網絡的系統性干預。許多疾病相關通路存在交叉對話和反饋調節機制,單一靶向往往無法完全阻斷信號傳導。雙特異性抗體通過同時作用于信號網絡中的兩個關鍵節點,能夠產生"1+1>2"的抑制效果。這種網絡水平的干預特別適用于RAS-RAF-MEK-ERK和PI3K-AKT-mTOR等復雜的信號網絡。
在免疫調節領域,協同阻斷同樣具有重要意義。通過同時靶向兩個不同的免疫檢查點,如程序性死亡蛋白1和淋巴細胞激活基因3蛋白,雙特異性抗體能夠更徹底地解除免疫抑制狀態,增強抗腫瘤免疫應答。這種協同阻斷策略在免疫治療耐藥的患者群體中展現出巨大潛力,為克服免疫治療耐藥提供了新的解決方案。
四、雙特異性抗體的工程技術面臨哪些挑戰?雙特異性抗體的開發面臨多重技術挑戰,其中結構穩定性是首要問題。由于非天然的組合方式,雙特異性抗體容易發生結構錯配和聚集,影響其理化性質和藥代動力學特征。為解決這一問題,研究人員開發了多種工程技術,包括引入促進正確配對的突變、優化連接肽設計、以及應用結構指導的計算機輔助設計等方法。
生產可行性是另一個重要挑戰。雙特異性抗體的復雜結構導致其在傳統表達系統中產量較低,且容易產生錯誤組裝的副產物。通過細胞系工程改造、培養基優化和純化工藝創新,目前已顯著提高了雙特異性抗體的生產效率和產品質量。特別是基于連續生產工藝的開發,為大規模生產高質量的雙特異性抗體提供了技術支持。
免疫原性風險是雙特異性抗體臨床轉化的重要考量因素。非天然的抗體結構可能被免疫系統識別為外源物質,誘發抗藥物抗體的產生。通過人源化改造、表位優化和糖工程技術,可以顯著降低雙特異性抗體的免疫原性。此外,深入理解T細胞表位分布和B細胞應答特征,有助于在設計階段預測和規避潛在的免疫原性風險。
五、雙特異性抗體的未來發展方向何在?雙特異性抗體的未來發展將集中在三個主要方向:功能多樣化、應用拓展化和技術精準化。在功能多樣化方面,新一代雙特異性抗體將整合更多的功能性模塊,如細胞因子、放射性核素或小分子藥物,形成多功能治療平臺。這種"雞尾酒"式設計能夠同時實現免疫細胞招募、信號通路調控和直接殺傷等多種治療機制。
在應用拓展方面,雙特異性抗體正從腫瘤治療向自身免疫性疾病、感染性疾病和代謝性疾病等領域擴展。例如,在自身免疫性疾病中,通過同時靶向炎癥因子和免疫細胞亞群,雙特異性抗體能夠更精確地調節異常免疫應答。在抗感染領域,同時識別病毒不同表位的雙特異性抗體展現出更強的中和能力和更廣的抗菌譜。
技術精準化是另一個重要趨勢。隨著結構生物學和計算生物學的發展,雙特異性抗體的設計正變得更加精確和理性。基于人工智能的抗體設計平臺能夠預測最佳的表位組合和結構構型,顯著提高開發效率。同時,基于患者特異性生物標志物的個性化雙特異性抗體設計,也代表著未來精準醫療的重要方向。
在給藥策略和劑型創新方面,雙特異性抗體也面臨新的機遇和挑戰。長效制劑、局部給藥系統和條件性激活前體藥物的開發,將進一步提高雙特異性抗體的治療效果和安全性。特別是針對中樞神經系統疾病的治療,能夠穿越血腦屏障的雙特異性抗體設計將成為重要的技術突破點。
結語雙特異性抗體代表著抗體工程領域的重要突破,通過雙靶點橋接和協同阻斷等創新機制,為復雜疾病的治療提供了新的解決方案。隨著工程技術的不斷進步和作用機制的深入理解,雙特異性抗體有望在精準醫療時代發揮更加重要的作用。未來研究應重點關注提高靶向特異性、優化藥代動力學特征和降低免疫原性風險,推動這一創新治療模式在更廣泛疾病領域中的應用,最終為患者提供更有效、更安全的治療選擇。
樂備實是國內專注于提供高質量蛋白檢測以及組學分析服務的實驗服務專家,自2018年成立以來,樂備實不斷尋求突破,公司的服務技術平臺已擴展到單細胞測序、空間多組學、流式檢測、超敏電化學發光、Luminex多因子檢測、抗體芯片、PCR Array、ELISA、Elispot、PLA蛋白互作、多色免疫組化、DSP空間多組學等30多個,建立起了一套涵蓋基因、蛋白、細胞以及組織水平實驗的完整檢測體系。






